Le infezioni nella sindrome del piede diabetico sono comuni, causano un’elevata morbilità e spesso richiedono lunghi ricoveri con interventi chirurgici multipli, fino alla perdita dell’arto. L’eziologia è multifattoriale, con la malattia vascolare periferica, la neuropatia e l’immunopatia che svolgono il ruolo principale. Il trattamento richiede un approccio sistematico e multidisciplinare. I segni clinici classici sono spesso assenti o compaiono solo in una fase avanzata. I campioni dalla ferita e, se necessario, dall’osso sono necessari per iniziare la terapia antimicrobica. Gli interventi chirurgici sono necessari per le ferite da moderatamente a gravemente avanzate o per l’infestazione sistemica. Lo sbrigliamento è la procedura più importante e deve includere tutti i compartimenti interessati. L’amputazione e/o la chiusura della ferita devono avvenire solo quando le condizioni del paziente sono stabili e la strategia di trattamento è definita. La diagnosi precoce è molto importante per limitare l’estensione del danno tissutale. La cura post-operatoria è essenziale per evitare recidive e complicazioni.
Le ulcere infette del piede nei pazienti con diabete mellito sono una causa importante di morbilità, associata a una ridotta qualità di vita, alla necessità di curare le ferite in modo specializzato, alla terapia antimicrobica e a frequenti interventi chirurgici. Sono anche la causa più comune di ricoveri ospedalieri associati al diabete e di perdita degli arti inferiori. In un ampio studio retrospettivo su pazienti con ulcere del piede diabetico, l’infezione ha aumentato il rischio di amputazione minore del 50% rispetto alle ferite non infette. Circa il 15% dei pazienti con diabete sviluppa ulcerazioni ai piedi nel corso della vita e circa due terzi di questi si trasformano in casi complicati con osteomielite. Per questo motivo, la diagnosi precoce e un piano di trattamento accurato sono di estrema importanza per evitare la progressione dell’infezione e l’amputazione. In questo breve articolo, ci concentreremo sulle attuali linee guida terapeutiche nella diagnosi e nel trattamento.
I tre maggiori fattori di rischio sono la malattia vascolare periferica, la neuropatia e l’immunopatia. Più precisamente, una sensibilità ridotta o completamente abolita, combinata con un trauma minore, porta a un danno tissutale ripetitivo. Questo porta a infezioni e a una guarigione peggiore, a causa della riduzione del flusso sanguigno e della compromissione del sistema immunitario. La fisiopatologia è semplice: alti livelli di glucosio nel sangue portano a cambiamenti metabolici nei nervi (glicolizzazione delle proteine e diminuzione del trasporto assonale), riducono la fagocitosi dei leucociti e quindi espongono a eventi infettivi. Per questo motivo, è sempre necessario un approccio multidisciplinare che coinvolge un’ampia gamma di discipline: chirurgia vascolare, angiologia, ortopedia, chirurgia plastica, neurologia, nonché consulenza nutrizionale, fisioterapia e, naturalmente, internisti e diabetologi.
Diagnosi
La diagnosi delle infezioni dei tessuti molli in questi pazienti non è sempre facile, poiché i sintomi tipici sono spesso poco pronunciati o assenti: La risposta infiammatoria può essere limitata (ischemia e/o neuropatia) e spesso il dolore è minimo o assente (neuropatia). I segni sistemici spesso si manifestano tardivamente e in casi molto gravi, quando è già presente uno shock settico o la condizione è pericolosa per la vita. I segni locali come edema, ipertermia e dolore (nonostante la neuropatia) suggeriscono un’infezione. Il campionamento microbiologico è quindi obbligatorio per confermare la diagnosi e stabilire la terapia. Gli esami del sangue devono sempre essere eseguiti (CRP, procalcitonina, leucociti…). La massima sensibilità è spesso offerta dall’iperglicemia incontrollata nonostante la terapia.
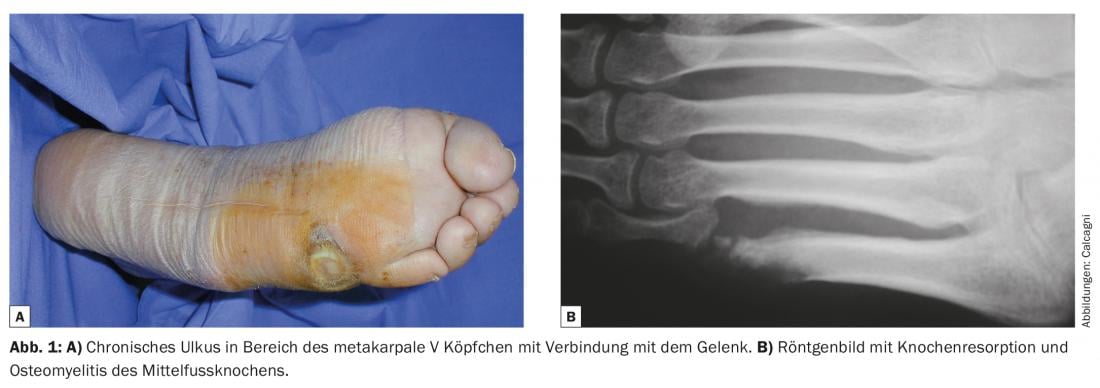
Ulteriori esami diagnostici includono un esame neurologico per cercare una neuropatia concomitante e/o una compressione dei nervi periferici. Non appena si sospetta un coinvolgimento osseo, è necessario eseguire un esame di risonanza magnetica; questo deve essere fatto prima di iniziare la terapia antibiotica, in quanto è necessaria una biopsia ossea (per la coltura batterica e l’istologia) se si notano segni di osteomielite. Le radiografie convenzionali sono necessarie anche per escludere problemi ossei o articolari acuti (fratture, lussazioni) o patologie degenerative (come l’artropatia di Charcot) (Fig. 1) . Infine, è necessario ottenere uno stato angiologico per valutare la perfusione arteriosa. A tale scopo si consigliano metodi non invasivi (Doppler) e, se è necessaria la rivascolarizzazione periferica, la diagnostica invasiva (angiografia TC o RM, angiografia diretta).
Una volta effettuata la diagnosi, la classificazione in livelli di gravità può aiutare a pianificare la strategia di trattamento. La tabella 1 mostra la classificazione della Infectious Disease Society of America (IDSA) basata sui segni clinici locali e sulle condizioni generali del paziente.
Trattamento
La strategia di trattamento dipende dalla gravità dell’infezione. La Tabella 2 mostra le raccomandazioni dell’IDSA.
Il paziente deve essere stabilizzato per quanto riguarda il diabete; anche tutti gli altri sistemi di organi anormali (cuore, reni…) richiedono un trattamento. La terapia antibiotica deve essere adattata all’antibiogramma dei germi rilevati. In letteratura esistono diverse raccomandazioni sulla durata e la forma della terapia antibiotica, ma non esistono prove chiare e quindi la terapia deve essere guidata dai segni clinici.

Se dovesse essere indicato lo sbrigliamento chirurgico (Fig. 2), Per ottenere un risultato ottimale, il chirurgo deve soprattutto prevenire la diffusione dell’infezione e l’eventuale progressione della necrosi, incidendo tutti i compartimenti coinvolti, sbrigliando le aree necrotiche, prelevando campioni ossei per la microbiologia e l’istologia, effettuando un’emostasi meticolosa e un intenso follow-up postoperatorio. Il chirurgo deve conoscere le strutture del piede e dei compartimenti della gamba (profondi e superficiali) e le vie tipiche di diffusione dell’infezione. Di solito questo avviene lungo i tendini che presentano la minore resistenza dei tessuti. Le articolazioni e le ossa infette devono essere ampiamente sbrigliate o, a seconda della situazione vascolare locale, amputate.

Il momento dell’operazione dipende dalle condizioni generali del paziente. Se lo shock settico è imminente, è necessario eseguire un’incisione e uno sbrigliamento di emergenza. Le amputazioni definitive di solito possono essere pianificate in seconda battuta. Nella maggior parte dei casi, è necessario ripetere lo sbrigliamento per creare ferite pulite e vitali. La terapia a pressione negativa delle ferite (NPWT) è spesso molto utile per proteggere le ferite dall’essiccamento e dalla necrosi, ma non può effettivamente curare l’infezione. Solo uno sbrigliamento accurato, tutte le volte che è necessario, può stabilizzare la situazione e, insieme a un miglioramento delle condizioni di accompagnamento, portare alla fine alla guarigione completa della ferita. Tuttavia, la terapia a pressione negativa è estremamente valida per ridurre le dimensioni delle ferite e stimolare il tessuto di granulazione. Spesso è l’unico modo per ottenere la chiusura definitiva della ferita nei pazienti con una situazione vascolare molto scarsa, anche se può richiedere mesi.
Il passo finale è la chiusura definitiva della ferita, che deve essere conforme alle regole della chirurgia plastica ricostruttiva. Le ferite superficiali e di piccole dimensioni di solito guariscono secondariamente; le ferite più grandi e profonde possono richiedere medicazioni in split-skin o addirittura con lembi complessi. Anche in questo caso, le decisioni devono essere prese alla luce di tutti i fattori (ferita, età, stato vascolare, comorbilità).
Trattamento post-operatorio
Il trattamento delle ulcere del piede diabetico è spesso lungo e difficile, quindi il trattamento costante deve continuare anche dopo la dimissione dall’ospedale o da una struttura ambulatoriale. La cura della pelle, il bendaggio compressivo (se necessario), la cura del piede e la regolazione delle scarpe sono importanti per mantenere i risultati ottenuti e per prevenire una ricaduta.
Letteratura:
- Ahmad J: Il piede diabetico. Diabetes Metab Syndr. 2016; 10(1): 48-60. doi:10.1016/j.dsx.2015.04.002.
- van Baal JG: Trattamento chirurgico del piede diabetico infetto. Clin Infect Dis. 2004; 39 Suppl 2(Supplemento 2): S123-S128. doi:10.1086/383273.
- La Fontaine J, et al: Concetti attuali nella gestione chirurgica delle infezioni acute del piede diabetico. Foot (Edinb) 2014; 24(3): 123-127. doi:10.1016/j.foot.2014.05.003.
- Noor S, et al: Comprendere l’infezione del piede diabetico e la sua gestione. Diabetes Metab Syndr. Giugno 2016. doi:10.1016/j.dsx.2016.06.023.
- Wallace GF: Debridement delle infezioni invasive del piede diabetico. Clin Plast Surg. 2007; 34(4): 731-734. doi:10.1016/j.cps.2007.07.009.
- Linee guida IDSA: Lipsky et.al: Diagnosi e trattamento delle infezioni del piede diabetico, CID 2004: 39.
PRATICA GP 2016; 11(10): 27-30