L’embolectomia polmonare è diventata un’opzione terapeutica importante nei pazienti con embolia polmonare acuta massiva con segni presenti di tensione ventricolare destra, quando l’indicazione è accurata e interdisciplinare (cardiochirurgia, cardiologia, angiologia, medicina intensiva e anestesiologia). Il nostro attuale algoritmo all’Inselspital per i pazienti con embolia polmonare acuta prevede innanzitutto una rapida classificazione dei pazienti in gruppi di rischio, in modo che se è presente una situazione di “rischio elevato” o “rischio intermedio”, si possano valutare ulteriori opzioni terapeutiche (oltre all’anticoagulazione) il più rapidamente possibile. I risultati dell’embolectomia polmonare chirurgica sono oggi molto buoni e potrebbero essere confermati dai dati di diversi gruppi. Il trattamento dell’embolia polmonare centrale grave deve essere effettuato in un centro dove, oltre alla terapia di lisi locale farmacologica e catetere, viene offerta anche la terapia chirurgica.
L’embolia polmonare acuta (LE) è una malattia importante del sistema cardiovascolare, con un’incidenza annuale di 100-200 persone su 100.000 [1]. Lo spettro dell’embolia polmonare va dai risultati incidentali clinicamente inapparenti sulla diagnostica per immagini all’embolia polmonare massiva acuta con shock cardiogeno e morte.
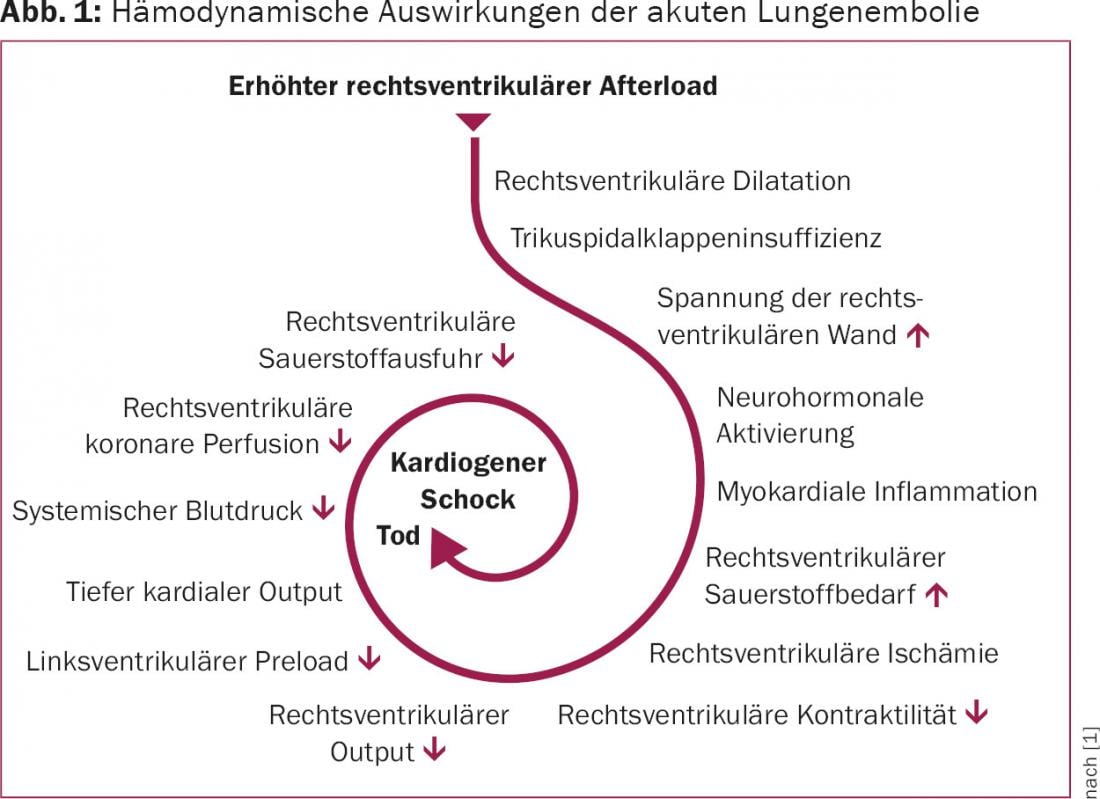
Quando il %–50% dell’intera circolazione polmonare è ostruita da una tromboembolia, la resistenza aumenta e la pressione arteriosa polmonare sale. Con l’aumento immediato del postcarico associato, lo stress di parete del ventricolo destro aumenta e con esso la richiesta di ossigeno, e si verifica un’ischemia ventricolare destra relativa, che a sua volta porta a una diminuzione della gittata ventricolare destra. Questa diminuzione riduce consecutivamente la funzione cardiaca del ventricolo sinistro e può infine portare allo shock cardiogeno o alla morte del paziente (Fig. 1).
Nuove linee guida
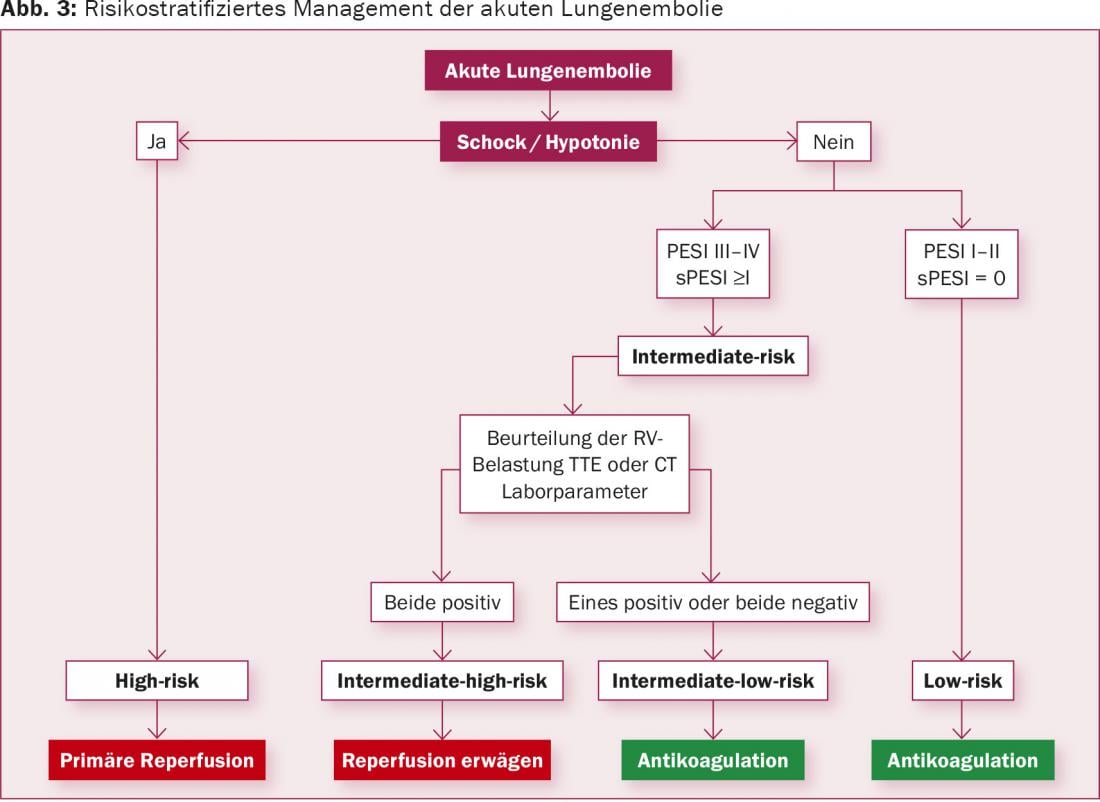
La Società Europea di Cardiologia (ESC) ha pubblicato nuove linee guida per la diagnosi e il trattamento dell’embolia polmonare acuta nel 2014 [1]. Secondo l’ESC, l’embolia polmonare acuta viene classificata in base al rischio di mortalità stimato (“alto rischio”, “rischio intermedio”, “basso rischio”). Questa classificazione guida la decisione sulla terapia successiva. Il fattore più significativo nella prognosi dell’embolia polmonare acuta è la tensione ventricolare destra. Un paziente con segni clinici di disfunzione ventricolare destra, come ipotensione persistente e shock cardiogeno, ha un rischio elevato di mortalità e viene inserito nel gruppo “ad alto rischio”.
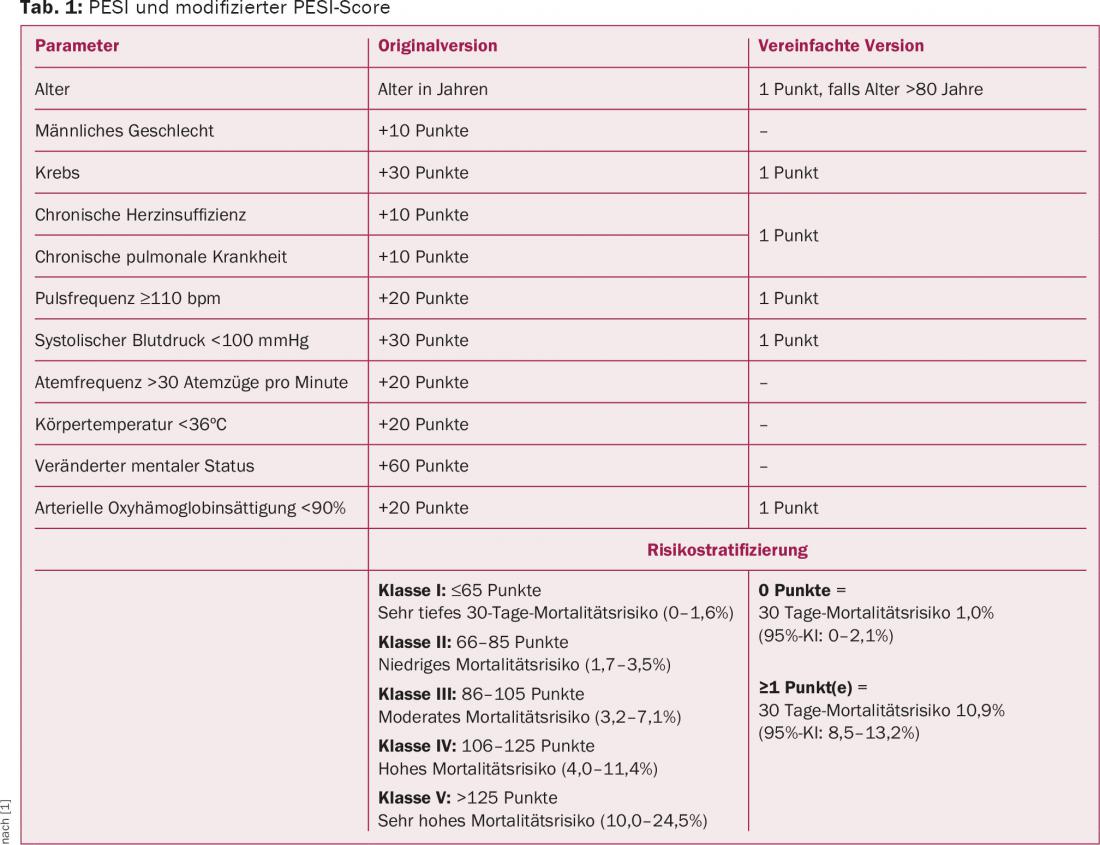
Utilizzando ulteriori parametri clinici, il Pulmonary Embolism Severity Score Index (PESI) può essere utilizzato per differenziare ulteriormente il rischio per i pazienti con embolia polmonare acuta (tab. 1) . Nei pazienti con un PESI di classe II-V, si raccomanda di ricercare attivamente il ceppo ventricolare destro utilizzando la diagnostica per immagini e il laboratorio.
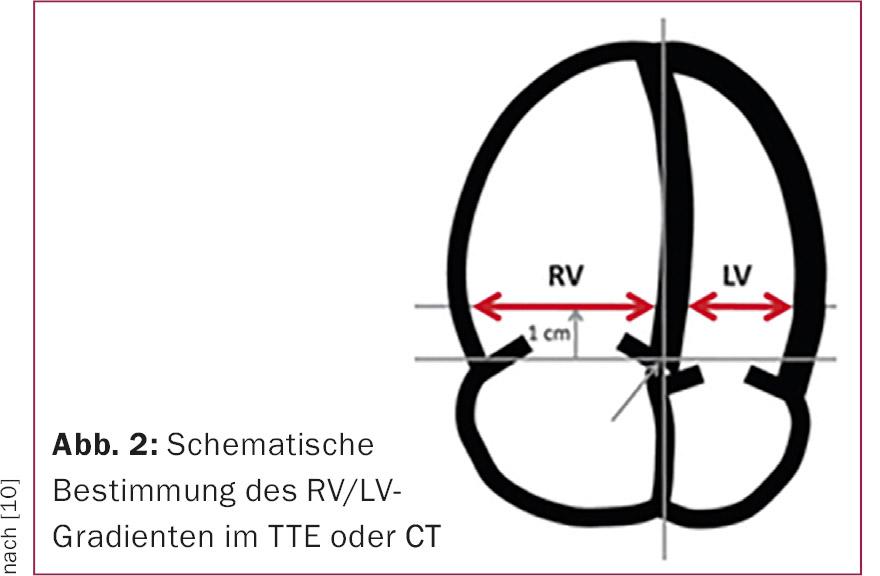
Si può ipotizzare che circa un quarto dei pazienti abbia un’evidenza ecocardiografica di sforzo del cuore destro [2]. La dilatazione e/o l’ipocinesia del ventricolo destro e l’aumento del quoziente RV/LV (Fig. 2) indicano uno stress ventricolare destro dovuto all’embolia polmonare acuta. Inoltre, l’ecocardiografia può mostrare un forame ovale pervio o trombi intracavitari nell’atrio destro/ventricolo, che influenzano la decisione sulla terapia successiva.
Oltre alla diagnostica per immagini mediante ecocardiografia transtoracica (TTE) e tomografia computerizzata (TC), anche i parametri di laboratorio possono fornire prove di deformazione del ventricolo destro. La troponina elevata, che riflette il danno cardiaco nei pazienti con embolia polmonare acuta, è associata a una prognosi peggiore [3].
Classificazione dei pazienti
Questi parametri clinici, di imaging e di laboratorio vengono utilizzati per classificare i pazienti con embolia polmonare acuta (Fig. 3) . I pazienti con ipotensione sistemica persistente (definita come pressione sistolica <90 mmHg o calo della pressione sistolica >40 mmHg in 15 min) o shock cardiogeno sono classificati nel gruppo ad alto rischio. I pazienti senza questi segni clinici vengono ulteriormente suddivisi con la diagnostica per immagini (TTE, TC) e i parametri di laboratorio in “a rischio intermedio” se mostrano segni di deformazione del ventricolo destro, o “a basso rischio” se non sono rilevabili segni clinici e non c’è deformazione del ventricolo destro sulla diagnostica per immagini o in laboratorio. I pazienti del gruppo “a basso rischio” hanno un rischio di mortalità molto basso e sono già sufficientemente trattati con l’anticoagulazione.
La terapia di riperfusione è chiaramente indicata per i pazienti del gruppo “ad alto rischio”. La raccomandazione principale delle linee guida è la fibrinolisi sistemica; in alternativa, devono essere valutate l’embolectomia polmonare chirurgica o le procedure locali con catetere. La terapia di lisi farmacomeccanica locale mostra alcuni vantaggi rispetto alla lisi sistemica in diverse applicazioni nella letteratura attuale e viene eseguita nel nostro centro come terapia di scelta per la terapia di riperfusione non chirurgica.
La situazione è un po’ più differenziata per i pazienti del gruppo “a rischio intermedio”. Diversi studi hanno dimostrato che i pazienti con segni di affaticamento del cuore destro e ulteriori enzimi cardiaci positivi beneficiano di un’ulteriore terapia (fibrinolisi sistemica) oltre all’anticoagulazione, in quanto questa riduce il tasso di scompenso cardiaco [4]. Tuttavia, questo vantaggio è limitato nella fibrinolisi sistemica da un tasso significativamente maggiore di complicanze emorragiche (soprattutto emorragie intracraniche). Tuttavia, sembra chiaro che certamente i pazienti del gruppo “ad alto rischio” e probabilmente anche quelli del gruppo “a rischio intermedio” traggono beneficio dalla terapia di riperfusione in aggiunta all’anticoagulazione. Secondo le attuali linee guida, la fribrinolisi sistemica non è generalmente raccomandata nei pazienti a rischio intermedio, a causa del rischio di sanguinamento [1]. Tuttavia, l’embolectomia chirurgica o la terapia fibrinolitica locale con catetere devono essere valutate in questo gruppo di pazienti con una raccomandazione IIb [1].
Il ruolo della chirurgia nell’embolia polmonare acuta: prima…
Prima che i pazienti con embolia polmonare acuta potessero essere trattati efficacemente con i farmaci – gli anticoagulanti sono stati scoperti e utilizzati clinicamente solo in seguito – è stata descritta la prima terapia chirurgica di successo dell’embolia polmonare massiva centrale [5]. Nel 1924, è stata eseguita la prima embolectomia polmonare di successo. La tecnica chirurgica era stata sviluppata da Trendelenburg negli anni precedenti. L’operazione di Trendelenburg ha poco in comune con la moderna terapia chirurgica per l’embolia polmonare. Bisogna immaginare: I pazienti colpiti hanno dovuto essere portati in sala operatoria subito dopo la diagnosi dell’embolia polmonare acuta e del collasso circolatorio che ha innescato. Ciò significa che l’embolia polmonare acuta doveva essere osservata da uno specialista. Il pericardio è stato quindi aperto attraverso una toracotomia, l’arteria polmonare è stata legata e quindi è stata creata un’occlusione dell’afflusso. L’arteria polmonare è stata poi aperta e la massa del trombo è stata rimossa manualmente. È ovvio che l’operazione di Trendelenburg ha un’elevata mortalità perioperatoria. Lo sviluppo della circolazione extracorporea ha rivoluzionato le opzioni cardiochirurgiche e la procedura è ora utilizzata come prassi nel trattamento chirurgico dell’embolia polmonare acuta.
… e oggi
Oggi, l’embolectomia polmonare chirurgica viene eseguita attraverso una sternotomia mediana. Il pericardio viene aperto e la macchina cuore-polmoni (HLM) viene collegata, come in altri interventi di cardiochirurgia. L’intervento chirurgico viene eseguito sul cuore battente oppure il cuore viene cardioplegatizzato e l’intervento viene eseguito durante l’arresto cardiaco. Il vantaggio della chirurgia a cuore battente è che non viene impostato un ulteriore danno miocardico ischemico se il ventricolo destro è già compromesso.
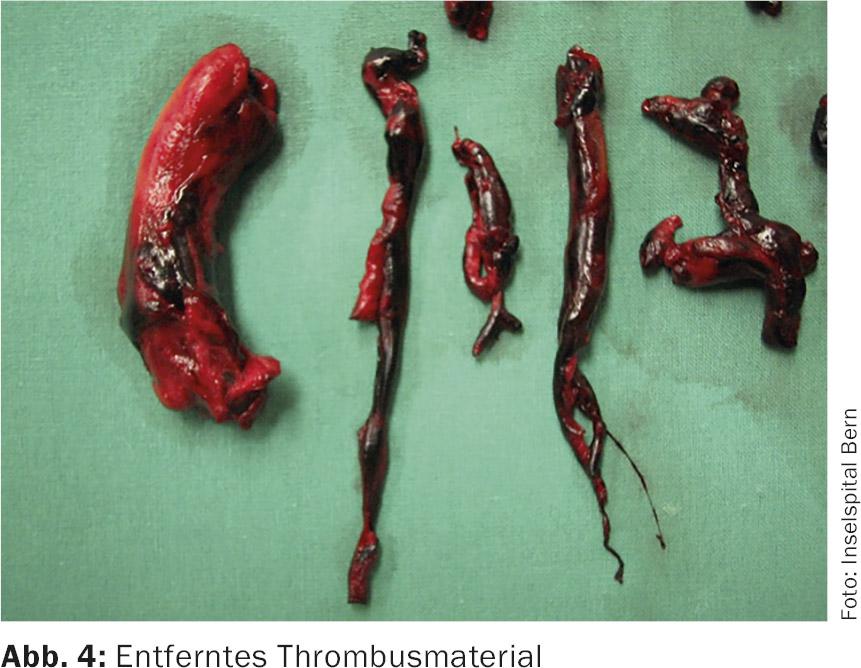
Il tronco polmonare principale viene aperto e l’incisione viene estesa nell’arteria polmonare sinistra. Il materiale del trombo viene rimosso sotto controllo visivo (Fig. 4). L’arteria polmonare destra viene sezionata tra l’aorta e la vena cava superiore, aperta separatamente e il materiale del trombo viene rimosso in modo simile. Si utilizza un angioscopio flessibile per verificare che tutto il materiale trombotico sia stato rimosso il più completamente possibile. Dopo la chiusura di entrambe le arterie polmonari con sutura continua, il paziente viene svezzato dall’HLM. L’uso di routine di una TEE intraoperatoria all’inizio dell’intervento cerca un forame ovale aperto o un trombo intracavitario – se presente, viene trattato di conseguenza.
Il momento critico dell’operazione è lo svezzamento dall’HLM. La maggior parte dei pazienti sottoposti a intervento chirurgico si trova in condizioni emodinamiche critiche. L’intervento chirurgico è spesso considerato come una procedura di salvataggio dopo una fibrinolisi infruttuosa o nei pazienti in grave shock cardiogeno, a volte sotto rianimazione meccanica. Il ventricolo destro è spesso gravemente colpito in queste situazioni e può essere un fattore limitante per il successo dell’intervento. In questa situazione, l’ossigenazione extracorporea temporanea a membrana (ECMO artero-venosa) offre la possibilità di concedere al ventricolo destro qualche giorno per recuperare.
Risultato
L’embolectomia polmonare è una procedura chirurgicamente gestibile e può essere eseguita con ottimi risultati nei pazienti che si presentano all’intervento in condizioni emodinamicamente stabili. L’indicazione corretta è importante. Le difficoltà possono essere presentate dalle cosiddette embolie polmonari “acute o croniche”. Se si esegue un intervento chirurgico acuto su un paziente con emboli polmonari cronici ricorrenti, la rimozione del materiale embolico dai vasi polmonari centrali e paracentrali potrebbe non migliorare significativamente l’ipertensione arteriosa polmonare già cronica e il paziente non trarrà beneficio dall’intervento. Se necessario, l’intervento molto più esteso di un’endarterectomia polmonare deve essere effettuato nella situazione acuta, con il relativo rischio più elevato.
Secondo le attuali linee guida, l’intervento chirurgico per l’embolia polmonare acuta è raccomandato per i pazienti “ad alto rischio” in cui la trombolisi sistemica è controindicata o non ha avuto successo [1]. Può essere valutata anche nei pazienti a rischio intermedio, se il rischio di emorragia con la trombolisi è considerato troppo elevato. In pratica, questo può portare a un rinvio (troppo) tardivo alla chirurgia. Per molto tempo, quindi, solo i pazienti che erano già in condizioni molto precarie (situazione di bail-out) venivano solitamente trattati chirurgicamente. Per questo motivo, i tassi di mortalità dell’embolectomia polmonare erano molto elevati. Una revisione dei risultati ha mostrato un tasso di mortalità superiore al 30% negli anni precedenti al 1985 e un tasso di mortalità del 20% nei pazienti operati dopo il 1985 [6].
Nel 2008, il nostro gruppo ha pubblicato una serie di 25 pazienti che avevano subito un intervento chirurgico tra gennaio 2000 e marzo 2007 [7]. 18 pazienti sono stati operati in stato di shock cardiogeno (otto in rianimazione meccanica). La mortalità a 30 giorni è stata solo dell’8%, nonostante le cattive condizioni di partenza. L’anno scorso sono state pubblicate due serie con risultati molto buoni di embolectomia polmonare. Nella serie più ampia di 115 pazienti successivi, poco meno della metà dei pazienti è stata sottoposta a un intervento chirurgico in una situazione di “alto rischio”. Questo gruppo ha avuto una mortalità del 10,2% rispetto al 3,6% dei pazienti operati senza limitazione emodinamica. Tuttavia, entrambi i gruppi hanno mostrato chiari segni di disfunzione del cuore destro [8]. In un’altra serie di 96 pazienti è stata riscontrata una mortalità a 30 giorni ancora più bassa, pari al 4,2% in generale (e solo all’1,2% nei pazienti a rischio intermedio) [9].
Attualmente, presso il nostro centro sta iniziando uno studio in collaborazione con i nostri colleghi di angiologia, in cui i pazienti con embolia polmonare acuta in situazioni di “alto rischio” e “rischio intermedio” vengono inclusi e randomizzati a ricevere una lisi locale con catetere o un trattamento chirurgico aperto. Questi dati forniranno ulteriori informazioni sulla terapia differenziale dell’embolia polmonare acuta.
Letteratura:
- La Task Force per la diagnosi e la gestione dell’embolia polmonare acuta della Società Europea di Cardiologia (ESC): Linee guida ESC 2014 sulla diagnosi e la gestione dell’embolia polmonare acuta. Europen Heart Journal 2014; 35: 3033-3080.
- Kreit JW: L’impatto della disfunzione ventricolare destra sulla prognosi e sulla terapia dei pazienti normotesi con embolia polmonare. Chest 2004; 125(4): 1539-1545.
- Becattini C, Vedovati MC, Agnelli G: Valore prognostico delle troponine nell’embolia polmonare acuta: una meta-analisi. Circolazione 2007; 116(4): 427-433.
- Meyer G, et al; PEITHO Investigators: Fibrinolisi per i pazienti con embolia polmonare a rischio intermedio. N Engl J Med 2014 Apr 10; 370(15): 1402-1411.
- Kirschner M: Un caso di embolia dell’arteria polmonare curato con l’operazione di Trendelenburg. Archivi di Chirurgia Clinica 1924; 133: 312-359.
- Stein PD, et al: Esito dell’embolectomia polmonare. Am J Cardiol 2007; 99(3): 421-423.
- Kadner A, et al: Eccellente risultato dopo il trattamento chirurgico dell’embolia polmonare massiva in pazienti critici. JTCVS 2008; 136(2): 448-451.
- Neely RC, et al: Embolectomia chirurgica per embolia polmonare acuta massiva e submassiva in una serie di 115 pazienti. Ann Thorac Surg 2015; 100: 1245-1252.
- Hartmann AR, et al: Embolectomia polmonare chirurgica acuta: un’analisi retrospettiva di 9 anni. Tex Heart Ins J 2015; 42(1): 25-29.
- Kucher N, et al: Studio randomizzato e controllato sulla trombolisi catetere-diretta con ultrasuoni per l’embolia polmonare acuta a rischio intermedio. Circolazione 2014; 129: 479-486.
CARDIOVASC 2016; 15(1): 28-32