La terapia del linfoma primario del SNC si è sviluppata molto negli ultimi anni. L’aspettativa di vita dei pazienti è aumentata. Il metotrexato rimane la base di tutte le terapie di induzione. Nel consolidamento, la situazione è un po’ meno chiara.
I linfomi primari del SNC (PZNSL) sono varianti extranodali dei linfomi non-Hodgkin che insorgono in modo limitato nel cervello, nel midollo spinale, nelle leptomeningi o negli occhi e in cui non vi è un coinvolgimento sistemico. I PZNSL sono molto aggressivi. In genere rispondono alla chemioterapia e alla radioterapia, con buone probabilità di remissione. Tuttavia, il rischio di recidiva è elevato e la prognosi è scarsa in questo caso. Il PZNSL può verificarsi nel contesto dell’immunosoppressione (HIV/AIDS, congenita, dopo un trapianto d’organo) o in pazienti immunocompetenti. Questo riassunto si occupa di questi ultimi pazienti.
Epidemiologia e prognosi
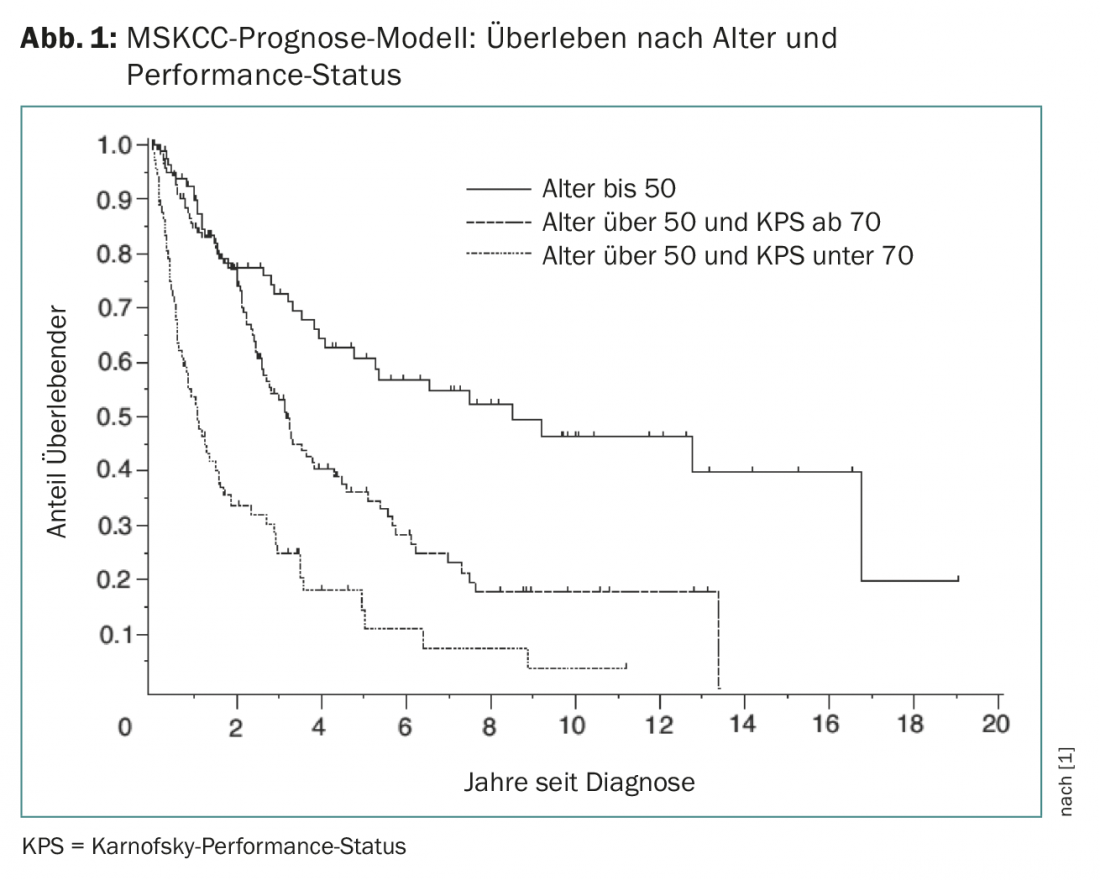
Il PZNSL è una malattia rara con un’incidenza di 0,4-0,5:100.000 all’anno. Rappresenta circa il 4% di tutti i tumori cerebrali diagnosticati e il 4-6% di tutti i linfomi extranodali e può verificarsi in tutti i gruppi di età. L’età mediana alla diagnosi è di 65 anni. Il modello MSKCC (Memorial Sloan Kettering Cancer Center) può prevedere l’esito in base al performance status di Karnofsky e all’età (Fig. 1) [1].
Clinica
La clinica può variare molto a seconda del paziente e della localizzazione dell’infestazione nel cervello. I deficit neurologici focali sono presenti fino al 70% dei pazienti. Fino al 43% di tutti i pazienti presenta disturbi psichiatrici o comportamentali. Sono comuni anche i segni di aumento della pressione intracranica. Quando gli occhi sono colpiti (infiltrazione del vitreo), i pazienti lamentano una visione offuscata o poco chiara nel 20-25% dei casi.
Diagnosi e stadiazione
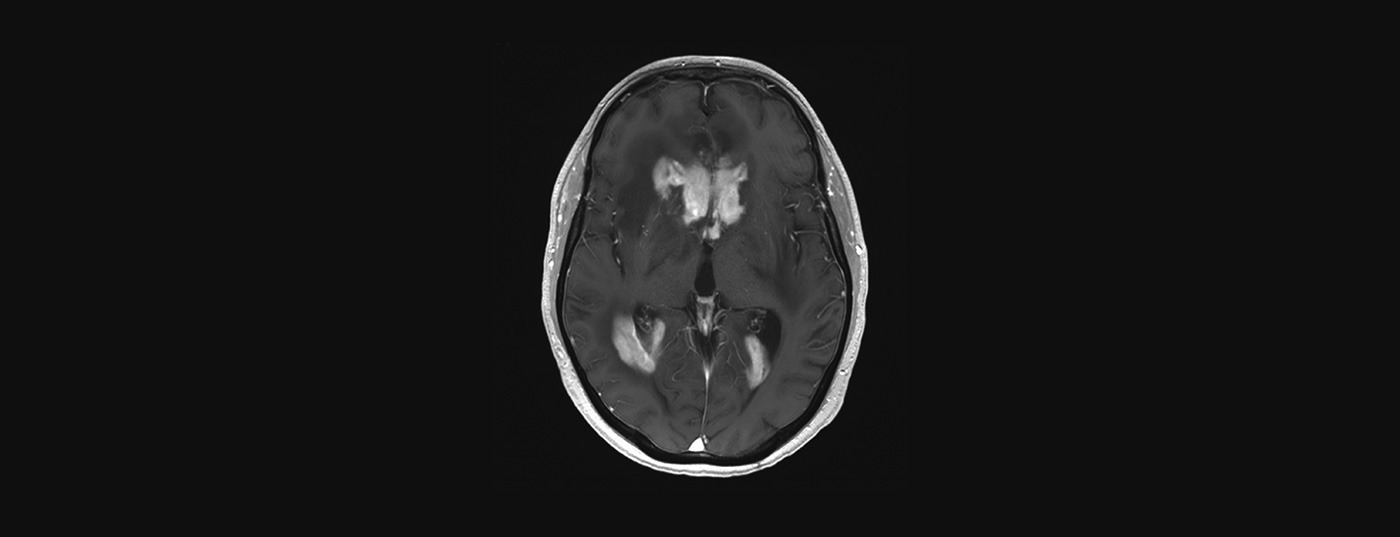
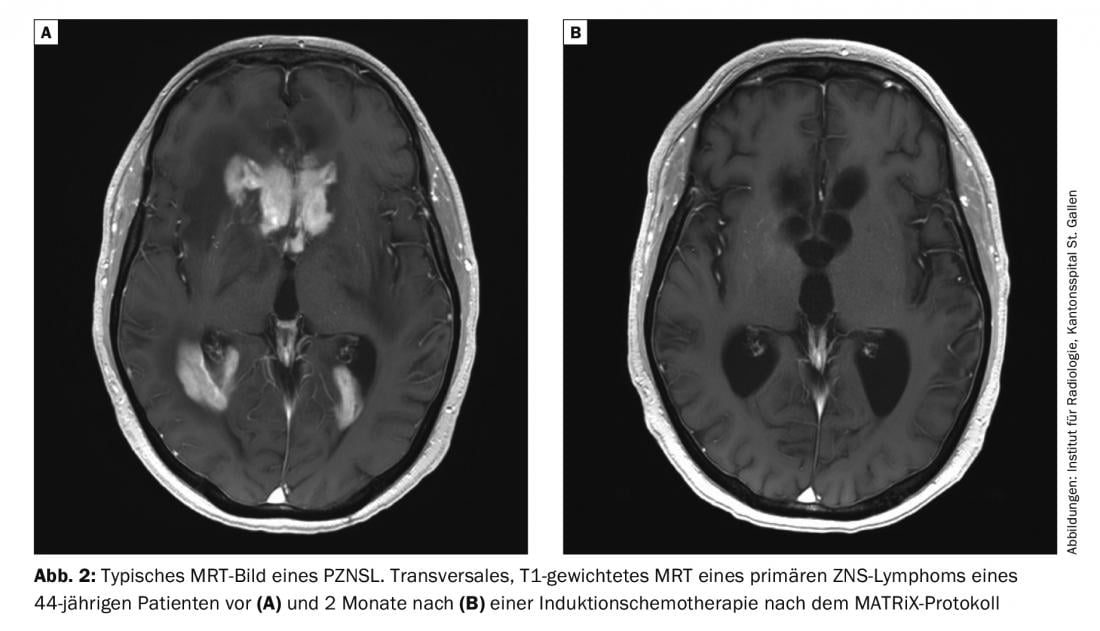
La risonanza magnetica con e senza mezzo di contrasto è l’esame di scelta per il sospetto di PZNSL. In genere, si osservano lesioni periventricolari solitarie o multifocali in posizione centrale, che sono iperintense nelle immagini pesate in T2, con assorbimento omogeneo del contrasto e restrizione della diffusione (Fig. 2). Nonostante il quadro clinico tipico e la risonanza magnetica, la diagnosi finale deve essere confermata con una biopsia cerebrale. Gli steroidi sono linfotossici e la loro somministrazione prima della biopsia può portare a una diagnosi falsamente negativa. L’interessamento leptomeningeo può verificarsi fino al 20% dei casi e deve essere eseguita una puntura lombare, a meno che non sia controindicata (pressione intracranica), per determinare la conta cellulare, il contenuto proteico, il glucosio, la citologia, la citometria a flusso e il “riarrangiamento immunoglobulinico” clonale. Anche un esame oculistico con lampada a fessura fa parte della valutazione (anche per i pazienti senza disturbi visivi). Se il PZNSL è confermato istologicamente, deve essere eseguita una stadiazione con PET su tutto il corpo. Tuttavia, se non è possibile eseguire una PET, è necessario richiedere almeno una tomografia computerizzata dei polmoni, del collo e dell’addome, nonché un’ecografia testicolare. Inoltre, dovrebbe essere effettuata una biopsia del midollo osseo. Anche l’emocromo, compreso l’emocromo differenziale, l’LDH sierico e lo screening dell’HIV fanno parte della stadiazione.
PZNSL di nuova diagnosi
Il trattamento moderno di un PZNSL dipende dall’età, dalle malattie precedenti e dalle condizioni generali. In genere, la terapia di induzione viene iniziata per ottenere una remissione completa. Segue la terapia di consolidamento, che ha lo scopo di eliminare la malattia microscopica residua e garantire una remissione di lunga durata. A causa della mancanza di studi di fase III che confrontino i diversi regimi di trattamento, in tutto il mondo vengono utilizzate diverse terapie di induzione e di mantenimento. Ciò che tutti hanno in comune, tuttavia, è la proporzione obbligatoria di metotrexato (MTX). Altri agenti chemioterapici, nonché il ruolo e la tempistica della radioterapia sono talvolta discussi in modo molto controverso. La MTX in dosi >1,5 g/m2 e in un tempo di infusione breve attraversa anche la barriera emato-encefalica intatta (MTX ad alte dosi; HD-MTX). Poiché queste dosi sono molto tossiche per gli altri organi, è necessario somministrare anche la leucovorina. La leucovorina inattiva la MTX a livello sistemico, ma non può attraversare la barriera emato-encefalica e quindi garantisce un’elevata concentrazione di MTX nel SNC. La MTX come monoterapia (8 g/m2) mostra tassi di risposta globale (ORR) del 74% [2]. Il beneficio della polichemioterapia è stato dimostrato da Ferreri et al. in uno studio randomizzato, dove l’aggiunta di citarabina a MTX ha determinato una sopravvivenza libera da progressione (PFS) più lunga di 18 mesi rispetto a tre mesi e un ORR del 69% rispetto al 40% rispetto al braccio standard [3].
È comune integrare l’anticorpo anti-CD20 rituximab nella polichemioterapia con MTX, anche se questa molecola anticorpale di grandi dimensioni può probabilmente attraversare la barriera emato-encefalica danneggiata solo nelle lesioni che ricevono il contrasto ed esercitare il suo effetto di deplezione delle cellule B in quel punto. Uno studio randomizzato su 227 pazienti (IELSG32) ha dimostrato che l’ORR migliore si osserva quando i pazienti vengono trattati con rituximab/tiotepa/HD-MTX/citarabina (regime MATRiX; ORR 86%). Per confronto, le combinazioni di rituximab/HD-MTX/citarabina o HD-MTX/citarabina hanno ottenuto un ORR del 73% e del 53%, rispettivamente [4].
La scelta della terapia di induzione varia a seconda della regione e del medico. Le terapie tipiche consistono in rituximab/HD-MTX/procarbazina/vincristina (R-MVP), rituximab/HD-MTX, temozolomide/HD-MTX, MATRiX (vedere sopra) e rituximab/HD-MTX/teniposide/carmustina/metilprednisolone (R-MVBP).
Questi regimi di trattamento sono generalmente ben tollerati e anche i pazienti anziani possono essere trattati con essi, purché la funzione renale sia ben mantenuta. Epatite, insufficienza midollare e renale sono possibili effetti collaterali. La tossicità neurologica del MTX è descritta, in particolare come encefalopatie acute o subacute e leucoencefalopatie multifocali che si sviluppano da mesi ad anni dopo la somministrazione di MTX.
Il ruolo della radioterapia cerebrale completa (WBRT) rimane controverso: uno studio di fase III ha dimostrato che la WBRT consolidativa ha prolungato la PFS da 12 a 18 mesi, ma senza migliorare la sopravvivenza (32,4 vs. 37 mesi). Tuttavia, è stata osservata anche una maggiore neurotossicità dovuta all’irradiazione [5]. Tuttavia, diversi gruppi di ricerca continuano a lavorare con regimi terapeutici che includono la WBRT modificata e, soprattutto, a dose ridotta. La WBRT viene sempre più sostituita da regimi di consolidamento con chemioterapia, a causa della sua neurotossicità nota e irreversibile, nella misura in cui le funzioni degli organi e le condizioni generali del paziente lo consentono. Uno studio multicentrico su 202 pazienti ha mostrato tassi di successo simili per i pazienti trattati con etoposide/citarabina ad alte dosi dopo la terapia di induzione con R-MTX rispetto alla WBRT [6]. La chemioterapia mieloablativa più aggressiva con trapianto di cellule staminali autologhe (HCD-ASCT) può essere eseguita nei pazienti più giovani e in buona salute generale. Due studi che hanno utilizzato R-MVP o HD-MTX/tiotepa/citarabina come regimi di induzione hanno mostrato alti tassi di risposta (>90%) e PFS di >74 mesi con HCD-ASCT [7,8].
Diversi studi retrospettivi non hanno mostrato alcun beneficio per l’aggiunta della chemioterapia intratecale [9]. Si presume che le dosi di MTX >3 g/m2 raggiungano già concentrazioni citotossiche nel liquor che rendono superflua la somministrazione intratecale e non giustificano più il maggior dispendio di terapia attraverso ripetute punture lombari e il conseguente rischio di infezione.
Monitoraggio dopo la terapia
Poiché il rischio di recidiva dopo la terapia di prima linea è elevato, i pazienti devono essere monitorati regolarmente durante il decorso. Oltre all’esame clinico e neurologico, la risonanza magnetica cerebrale deve essere eseguita ogni tre mesi per i primi due anni e successivamente ogni sei mesi. Dopo cinque anni, le ispezioni possono avvenire annualmente.
Pazienti anziani
La gestione ottimale dei pazienti anziani con PZNSL rimane controversa. Questi pazienti presentano problemi specifici, soprattutto a causa delle loro comorbidità, della salute generale più scarsa, dell’aumento dei tassi di complicanze e del fatto che in genere rispondono meno bene alle terapie. Uno studio francese ha confrontato due metodi di terapia in pazienti di età superiore ai 70 anni. Questo studio ha dimostrato che la terapia HD-MTX/procarbazina/vincristina/citarabina è stata ben tollerata quanto la terapia meno aggressiva con HD-MTX e temozolomide. Tuttavia, l’ORR (82% vs. 71%) e la sopravvivenza globale (31 vs. 14 mesi) erano migliori nel primo gruppo [10].
Terapia del PZNSL recidivato o refrattario
Sebbene i tassi di risposta dopo la terapia di induzione siano piuttosto notevoli, il 10-15% dei pazienti rimane refrattario alla terapia di induzione. Inoltre, il 50% dei pazienti che hanno risposto al trattamento iniziale sviluppa una ricaduta nel corso della terapia. Il tempo mediano alla recidiva è di 10-18 mesi [11]. In caso di recidiva, la prognosi ulteriore è molto scarsa. Al momento della recidiva, è necessario eseguire una nuova stadiazione clinica con imaging dell’intero asse del SNC, un esame oftalmologico e una PET su tutto il corpo. Va notato che fino al 10% dei pazienti con PZNSL presenta una ricaduta sistemica.
Ad oggi, non esiste una terapia standard per questa situazione. La scelta della terapia si basa sull’età del paziente, sul suo performance status, sulla considerazione delle terapie precedenti e della loro risposta e sull’inclusione delle comorbidità. La riesposizione alla MTX può essere un’opzione ragionevole, soprattutto nei pazienti che hanno mostrato una risposta iniziale a lungo termine a un regime di induzione contenente MTX. Questo trattamento ha prodotto ORR dell’85-91% e una sopravvivenza mediana di 41-62 mesi [12,13]. Gli studi prospettici con altri agenti chemioterapici, tra cui temozolomide, pemetrexed, topotecan o rituximab, hanno mostrato tassi di risposta del 31-55% con tassi mediani di PFS di 1,6-5,7 mesi. Nei pazienti più giovani in buone condizioni generali, l’HCD-ASCT può essere un’opzione [14]. La WBRT rimane un’alternativa per i pazienti che non possono ricevere la chemioterapia ad alte dosi o che sono in condizioni di salute generale molto precarie. Gli studi retrospettivi con WBRT mostrano tassi di risposta del 74-79% e tempi di sopravvivenza mediana di 10-16 mesi [15]. Tuttavia, il sintomo principale dei deficit cognitivi è spesso aggravato, per cui il beneficio e il rischio della WBRT devono essere soppesati con molta attenzione. Nei pazienti con gravi danni cerebrali, è anche consigliabile prendere in considerazione la rinuncia alla terapia.
Stanno emergendo anche nuove strategie terapeutiche. Il ligando PD-1 (“morte cellulare programmata”; PDL-1) è deregolato e sovraespresso in >50% dei PZNSL. Le terapie con anticorpi monoclonali contro PD-1 o PDL-1, come nivolumab o pembrolizumab, sono quindi promettenti. Una piccola serie di quattro pazienti con PZNSL recidivato o refrattario ha mostrato una PFS di 14-17 mesi [16]. Gli studi prospettici sono attualmente in fase di reclutamento. La lenalidomide, un derivato della talidomide, combinata con il rituximab ha mostrato un effetto positivo in una presentazione al Meeting ASCO 2016 di Rubenstein et al. ha avuto anche un promettente ORR del 67%.
Ibrutinib è un inibitore della tirosin-chinasi di Bruton, una parte fondamentale della via di segnalazione del recettore delle cellule B che spesso presenta mutazioni nel PZNSL. Ibrutinib attraversa la barriera emato-encefalica e può essere misurato nel liquido cerebrospinale a dosi terapeutiche. In una piccola serie di PZNSL recidivato, ibrutinib ha mostrato un ORR del 77% con un tasso di PFS di 7,4 mesi [17]. Uno studio di fase I ha combinato la terapia iniziale con ibrutinib con un consolidamento costituito da temozolomide, etoposide, doxorubicina liposomiale, desametasone e rituximab. I pazienti di questo studio hanno mostrato un ORR del 94% dopo ibrutinib, e l’86% dei pazienti ha successivamente raggiunto la remissione completa [18]. Tuttavia, ibrutinib comporta un rischio elevato di aspergillosi polmonare e cerebrale.
Letteratura:
- Abrey LE, et al: Linfoma primario del sistema nervoso centrale: il modello prognostico del Memorial Sloan-Kettering Cancer Center. J Clin Oncol 2006; 24(36): 5711-5715.
- Batchelor T, et al: Trattamento del linfoma primario del SNC con metotrexato e radioterapia differita: un rapporto del NABTT 96-07. J Clin Oncol 2003; 21(6): 1044-1049.
- Ferreri AJ, et al: Citarabina ad alto dosaggio più metotrexato ad alto dosaggio rispetto al solo metotrexato ad alto dosaggio nei pazienti con linfoma primario del sistema nervoso centrale: uno studio randomizzato di fase 2. Lancet 2009; 374(9700): 1512-1520.
- Ferreri AJ, et al: Chemioimmunoterapia con metotrexato, citarabina, tiotepa e rituximab (regime MATRix) nei pazienti con linfoma primario del SNC: risultati della prima randomizzazione dello studio di fase 2 dell’International Extranodal Lymphoma Study Group-32 (IELSG32). Lancet Haematol 2016; 3(5): e217-227.
- Korfel A, et al: Studio randomizzato di fase III sulla radioterapia cerebrale completa per il linfoma primario del SNC. Neurologia 2015; 84(12): 1242-1248.
- Rubenstein JL, et al: Chemioterapia intensiva e immunoterapia in pazienti con linfoma primario del SNC di nuova diagnosi: CALGB 50202 (Alliance 50202). J Clin Oncol 2013; 31(25): 3061-3068
- Omuro A, et al: R-MPV seguita da chemioterapia ad alto dosaggio con TBC e trapianto autologo di cellule staminali per un linfoma primario del SNC di nuova diagnosi. Sangue 2015; 125(9): 1403-1410.
- Illerhaus G, et al: Chemioterapia ad alto dosaggio con trapianto autologo di cellule staminali emopoietiche per il linfoma primario del SNC di nuova diagnosi: uno studio prospettico, a braccio singolo, di fase 2. Lancet Haematol 2016; 3(8): e388-397.
- Sierra Del Rio M, et al: Chemioterapia profilattica intratecale nel linfoma primario del SNC. J Neurooncol 2012; 106(1): 143-146.
- Omuro A, et al: Metotrexato e temozolomide rispetto a metotrexato, procarbazina, vincristina e citarabina per il linfoma primario del SNC in una popolazione anziana: studio randomizzato di fase 2 intergruppo ANOCEF-GOELAMS. Lancet Haematol 2015; 2(6): e251-259.
- Jahnke K, et al: Recidiva del linfoma primario del sistema nervoso centrale: caratteristiche cliniche, esito e fattori prognostici. J Neurooncol 2006; 80(2): 159-165.
- Pentsova E, Deangelis LM, Omuro A: Reinserimento del metotrexato per il linfoma primario ricorrente del sistema nervoso centrale. J Neurooncol 2014; 117(1): 161-165.
- Plotkin SR, et al: Trattamento del linfoma del sistema nervoso centrale recidivato con metotrexato ad alte dosi. Clin Cancer Res 2004; 10(17): 5643-5646.
- Soussain C, et al: Chemioterapia intensiva seguita da salvataggio con cellule staminali ematopoietiche per il linfoma primario del SNC e intraoculare refrattario e ricorrente: J Clin Oncol 2008; 26(15): 2512-2518.
- Hottinger AF, et al: Radioterapia di salvataggio dell’intero cervello per il linfoma primario del SNC ricorrente o refrattario. Neurologia 2007; 69(11): 1178-1182.
- Nayak L, et al: Blocco di PD-1 con nivolumab nel linfoma primario del sistema nervoso centrale e testicolare recidivato/refrattario. Sangue 2017; 129(23): 3071-3073.
- Grommes C, et al: Ibrutinib smaschera il ruolo critico della tirosin-chinasi Bruton nel linfoma primario del SNC. Cancer Discov 2017; 7(9): 1018-1029.
- Lionakis MS, et al: Inibizione della segnalazione del recettore delle cellule B da parte di Ibrutinib nel linfoma primario del SNC. Cancer Cell 2017; 31(6): 833-843.e5.
InFo ONCOLOGIA & EMATOLOGIA 2018; 6(3): 34-38