Il microbioma cutaneo dei pazienti con dermatite atopica (AD) presenta una diversità batterica ridotta. Spesso predomina il patogeno Staphylococcus aureus (S. aureus). Questo batterio gram-positivo intensifica i processi infiammatori ed è associato agli episodi acuti di AD. Uno studio pubblicato nel 2024 su JCI Insight da Clowry et al. fornisce approfondimenti sulle firme immunitarie sistemiche e cutanee associate all’AD pediatrico infettato da S. aureus.
Per lo studio di Clowry et al. sono stati reclutati 93 pazienti con AD di età compresa tra 0 e 16 anni [6]. Di questi, 12 avevano un’infezione cutanea da S. aureusconfermata in base a criteri clinici (“ADS.aureus”) [7]. I criteri clinici includevano la trasudazione, la formazione di pustole, ascessi e/o croste, nonché risultati positivi dello striscio batterico. I restanti 46 pazienti con AD non soddisfacevano i criteri clinici per la diagnosi di infezione cutanea da S. aureus(gruppo di controllo AD). Il gruppo di controllo sano dal punto di vista cutaneo era composto da 35 partecipanti che non avevano né un’infezione cutaneaattiva da S. aureusné una storia di atopia.
L’infezione cutanea da S. aureusè stata associata a una maggiore gravità dell’AD.
Sono stati creati profili immunologici sistemici per tutti i 93 pazienti e, inoltre, sono stati creati profili immunologici cutanei locali per un sottogruppo (n=69) [6]. Questo sottogruppo comprendeva 9 pazienti “ADS.aureus”, 32 pazienti del gruppo di controllo AD e 28 controlli sani dal punto di vista cutaneo. I pazienti “AD.aureus” presentavano una gravità maggiore di AD rispetto al gruppo di controllo AD (punteggi EASI medi di 29,4-32 rispetto a 14,8-15). Inoltre, un numero maggiore di pazienti nel gruppo “ADS.aureus” era affetto da alti livelli di colonizzazione da S. aureussia nella pelle lesionale (67% e 37%, rispettivamente) che in quella non lesionale (30% e 5%, rispettivamente). Tutti i pazienti del gruppo “ADS.aureus” presentavano livelli moderati o elevati di S. aureus sulla pelle lesionale, il 60% aveva una colonizzazione della pelle non lesionale e il 66% aveva una colonizzazione nasale. Al contrario, il gruppo di controllo AD non mostrava segni clinici di infezione da S. aureus. Nel 51% di questi pazienti, S. aureus è stato identificato sulla pelle lesionata dell’AD, nel 30% sulla pelle non lesionata dell’AD e il 48% aveva una colonizzazione nasale. I pazienti con “AD.aureus” avevano meno probabilità di assumere terapie immunomodulanti (8-11% rispetto al 41-46% del gruppo di controllo AD).
| La ricerca sul microbioma aggiunge un livello importante alla conoscenza dei processi patogenetici nell’AD. Oggi è noto che il microbiota cutaneo può influenzare e modulare le risposte immunitarie nella pelle, con la S. aureus che sembra svolgere un ruolo chiave [1]. < >Mentre lo S. aureus è rilevabile sulla pelle sana solo nel 5% di tutti i tamponi, si trova nei bambini con AD nel 90% dei casi [2]. La funzione barriera della pelle, già indebolita nell’AD, può essere ulteriormente compromessa dallaS. aureus , in quanto il batterio possiede delle proteasi che riducono ulteriormente l’integrità della barriera [3]. Questo perché l’attività proteasica consente la penetrazione nell’epidermide, con conseguente stimolazione delle citochine Th2, per cui S. aureus può essere trovato non solo nell’epidermide, ma anche nel derma delle lesioni dell’AD [4]. Inoltre, lo S. aureus esprime una α-tossina – una proteina che forma un poro e che danneggia la membrana cellulare dei cheratinociti [5]. |
Profili immunologici di “ADS.aureus” rispetto al gruppo di controllo AD?
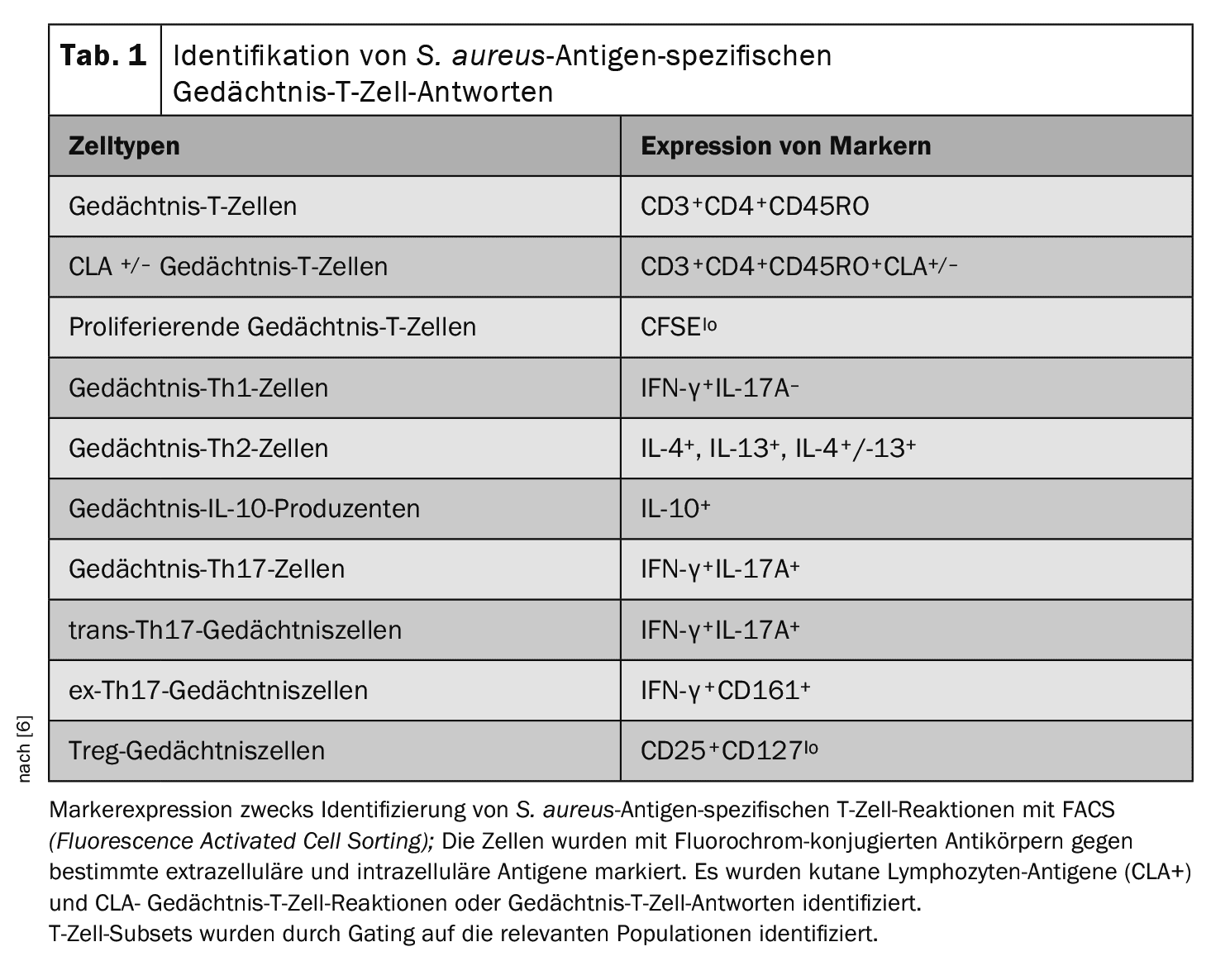
L’analisi iniziale si è concentrata sulla totalità delle risposte delle cellule T di memoria specifiche per l’antigene “AD.aureus” [6]. L’homing cutaneo selettivo delle cellule T di memoria ed effettrici è un processo immunologico importante nella fisiopatologia dell’AD. L’antigene associato ai linfociti cutanei (CLA) è un recettore di homing cutaneo che definisce un sottogruppo di cellule T di memoria circolanti Per comprendere meglio le risposte delle cellule T di memoria specifiche all’antigene AD.aureus dirette alla pelle, il pannello di colorazione è stato ampliato per includere il CLA [8].
Caratterizzazione delle cellule T circolanti e delle risposte delle cellule T antigene-specifiche di S. aureusassociate alle recidive di infezione da S. aureus: per determinare se si possono identificare diversi fenotipi di cellule T circolanti e risposte delle cellule T antigene-specifiche di S. aureus tra il gruppo di controllo “ADS. aureus ” e i controlli sani di pelle. aureus, il gruppo di controllo AD e i controlli sani, sono state raccolte cellule mononucleate del sangue periferico (PBMC) da tutti i 93 pazienti reclutati [6]. Le popolazioni leucocitarie circolanti sono state analizzate per determinare la proporzione di sottoinsiemi specifici di cellule T mediante colorazione citometrica a flusso. Per valutare le risposte sistemiche specifiche all’antigene S. aureus, le PMBC totali sono state marcate con carbossifluoresceina succinimidil estere (CFSE) e coltivate in vitro in presenza di S. aureus inattivato a caldo (ceppo AD08). Le cellule stimolate solo con il terreno o con l’enterotossina stafilococcica A (SEA) hanno rappresentato i controlli negativi e positivi, rispettivamente. Il giorno 8, le cellule sono state raccolte e colorate con una serie di anticorpi coniugati con fluorocromo contro i marcatori di superficie e intracellulari (Tabella 1). La selezione cellulare attivata dalla fluorescenza (FACS) è stata utilizzata per identificare le sottopopolazioni di cellule T specificate.
Le proporzioni delle sottopopolazioni di cellule T sistemiche circolanti e delle sottopopolazioni di cellule T di memoria specifiche per l’antigene S. aureusidentificate nei tre gruppi sono state inserite in un modello multinomiale bayesiano.
- Risultati dell’analisi: La caratteristica con la più alta probabilità di distinguere “AD.aureus” dai controlli AD è stata quella delle cellule T di memoria che producono IL-10, con una probabilità media di oltre l’80%, seguita dalle cellule Th1 circolanti con una probabilità media del 75% e dalle cellule Vδ2+ circolanti con una probabilità media del 63%. Ulteriori caratteristiche distintive erano le cellule CD8+, CD4+, Vδ1+ e Th2 circolanti, nonché le cellule di memoria ex-Th17 (un sottogruppo funzionalmente diverso di cellule Th17 che non producono più IL-17 ma IFN-γ), la cui probabilità mediana di differenziazione era compresa tra il 50% e il 60%.
- Per determinare la direzionalità dei tratti con la più alta probabilità di associazione con “AD.aureus” (>50%), sono stati utilizzati i ridge plot per confrontare l’espressione delle otto variabili più importanti in “AD.aureus” rispetto ai controlli AD. La memoria IL-10+ e le cellule Th1 circolanti sono state soppresse in “ADS.aureus” rispetto al gruppo di controllo AD, mentre le cellule Vδ2+ circolanti sono aumentate in “ADS.aureus” rispetto ai controlli AD. Inoltre, le cellule di memoria CD8+, CD4+ ed ex-Th17 circolanti sono state soppresse nel gruppo “ADS.aureus”, mentre le cellule Th2 e Vδ1+ circolanti sono aumentate.
Caratterizzazione delle risposte delle cellule T antigene-specifiche di S. aureus nella pelle e dei marcatori infiammatori locali in relazione ai focolai di infezione da S. aureus: aggiungendo CLA al pannello di colorazione, è stato possibile identificare le cellule T di memoria antigene-specifiche di S. aureusnella pelle [8]. Il CLA è una molecola di adesione specifica della pelle e rappresenta una modifica post-traduzionale della P-selectin ligand-1 (PSGL-1) [9]. [10]L’epitopo CLA si lega specificamente alla E-selectina sull’endotelio delle venule postcapillari e consente la migrazione selettiva dei linfociti T dalla circolazione periferica al derma.
| Sommario |
| Nella coorte di AD pediatrici studiata da Clowry et al. l’infezione cutanea da S. aureusera fortemente associata ad un aumento delle chemochine cutanee IP10 e TARC, che dirigono preferenzialmente le cellule Th1 e Th2 verso la pelle [6]. Le cellule T CD4+ e CD8+ sistemiche, ad eccezione delle cellule Th2, sono state soppresse nell’infezione cutanea da S. aureus, soprattutto le cellule Th1 circolanti, le cellule T di memoria IL-10+ e le cellule Th17 di memoria residenti nella pelle. Inoltre, nei pazienti con infezione cutanea da S. aureusè stata osservata un’espansione sistemica delle cellule T γδ. |
| [12] [13,14]L’aumento delle cellule Th2 circolanti nell’analisi dei soli sistemi e della risposta di memoria IL-4+IL-13+ (Th2) specifica per l’antigene S. aureusnell’analisi combinata riflette la firma Th2 che caratterizza l’AD ed è potenziata dallo S. aureus . |
| La risposta di memoria Th2 antigene-specifica di S. aureusCLA-IL-4+IL-13+ aveva una maggiore probabilità di associazione con “ADS.aureus”. Questo potrebbe essere dovuto all’homing da parte della popolazione CLA+IL-4+IL-13+. È interessante notare che solo i linfociti T a doppia produzione di IL-4 e IL-13 erano costantemente elevati nella “ADS.aureus” rispetto ai controlli AD. |
| I risultati di questo lavoro suggeriscono che l’aumento delle sottopopolazioni protettive delle cellule T è una potenziale strategia terapeutica per ridurre la dominanza dello S. aureusnella DA. |
- Risultati dell’analisi: Come in precedenza, i risultati hanno identificato le risposte immunitarie cutanee mediate dalle cellule T, sia sistemiche che localizzate, che discriminavano tra ‘AD.aureus’, controlli AD e controlli sani della pelle con il massimo potere discriminatorio. L’aggiunta delle risposte cutanee sistemiche e dei marcatori della risposta infiammatoria cutanea ha aumentato il numero di caratteristiche che discriminavano tra “AD.aureus”, controlli AD e controlli sani dal punto di vista cutaneo con un’affidabilità superiore al 50%, da 8 a 30, suggerendo che l’aggiunta di queste caratteristiche supplementari fornisce una maggiore comprensione dei profili immunitari locali associati ad “AD.aureus”.
Letteratura:
- Lee HJ, Kim M: Funzione della barriera cutanea e microbioma. Int J Mol Sci 2022 Oct 28; 23(21): 13071. doi: 10.3390/ijms232113071.
- Schöfer H, et al.: Linea guida S2k + IDA: Diagnosi e trattamento delle infezioni da Staphylococcus aureus della pelle e delle membrane mucose.
2011. https://dgpi.de/wp-content/uploads/2013/04/013-038l_S2k_ Staphyococcus_aureus_2011-09.pdf, (ultimo accesso 02/08/2024). - Fölster-Holst R: Il ruolo del microbioma cutaneo nella dermatite atopica – correlazioni e conseguenze. JDDG 2022; 20(5): 571-578.
- Nakatsuji T, et al: Lo Staphylococcus aureus sfrutta i difetti della barriera epidermica nella dermatite atopica per attivare l’espressione di citochine. J Invest Dermatol 2016; 136: 2192-2200.
- Brauweiler AM, Goleva E, Leung DYM: Le citochine Th2 aumentano la morte dei cheratinociti indotta dalla tossina alfa dello Staphylococcus aureus attraverso il segnale trasduttore e attivatore della trascrizione 6 (STAT6). J Invest Dermatol 2014; 134: 2114-2121.
- 6 Clowry J, et al: Firme distinte di cellule T sono associate all’infezione cutanea da Staphylococcus aureus nella dermatite atopica pediatrica. JCI Insight 2024 Apr 11; 9(9): e178789.
- Alexander H, et al: Il ruolo delle infezioni batteriche della pelle nella dermatite atopica: dichiarazione di esperti e revisione dell’International Eczema Council Skin Infection Group. Br J Dermatol 2020; 182(6): 1331-1342.
- de Jesús-Gil C, et al: La rilevanza traslazionale delle cellule T umane circolanti positive all’antigene associato ai linfociti cutanei di memoria nelle malattie infiammatorie della pelle. Front Immunol. 2021; 12: 652613. doi: 10.3389/fimmu.2021.652613.
- Fuhlbrigge RC, et al: L’antigene linfocitario cutaneo è una forma specializzata di PSGL-1 espressa sulle cellule T che entrano nella pelle. Nature 1997; 389(6654): 978-981.
- Czarnowicki T, et al. Le cellule T CLA+ circolanti nella dermatite atopica e il loro possibile ruolo come biomarcatori periferici. Allergia 2017; 72(3): 366-372.
- Andersson AM, et al: Valutazione dei biomarcatori nella dermatite atopica pediatrica mediante strisce di nastro adesivo e biopsie cutanee. Allergia 2022;77(5):1499-1509.
- Czarnowicki T, et al: Gli endotipi della dermatite atopica e le implicazioni per le terapie mirate. JACI 2019; 143(1): 1-11.
- Karauzum H, Datta SK: Immunità adattativa contro lo stafilococco aureo. Curr Top Microbiol Immunol 2017; 409: 419-439.
- Geoghegan JA, et al: Staphylococcus aureus e dermatite atopica: una relazione complessa e in evoluzione. Trends Microbiol 2018; 26(6): 484-497.
PRATICA DERMATOLOGICA 2024; 34(4): 26-27