Il Simposio sulla Sclerosi Multipla presso l’Inselspital di Berna ha fornito un’ampia panoramica sull’epidemiologia, l’eziologia, il decorso, la valutazione e l’attuale farmacoterapia della patologia. Ci sono risultati entusiasmanti dalla ricerca di base, che ha identificato la citochina GM-CSF come un possibile nuovo bersaglio terapeutico. L’Indagine sulla disabilità della SM sta attualmente esaminando gli strumenti elettronici che potrebbero contribuire alla standardizzazione in futuro. La farmacoterapia rimane un campo ampio – il profilo degli effetti collaterali è il fattore principale nel processo decisionale.
Christian Kamm, MD, Dipartimento Universitario di Neurologia, Inselspital di Berna, ha fornito una breve introduzione all’epidemiologia della sclerosi multipla (SM). La SM è una malattia infiammatoria cronica del sistema nervoso centrale (malattia autoimmune). Di solito consiste in una fase iniziale con reazioni infiammatorie che portano a ricadute. Poi, di solito dopo 15-20 anni, segue la seconda fase secondaria progressiva e degenerativa (in parte ancora sovrapposta a ricadute).
In media, le persone colpite hanno circa 30 anni (picco di incidenza tra i 20 e i 40 anni). La prevalenza in Europa è di 83:100.000 – è aumentata negli ultimi anni a causa della maggiore aspettativa di vita delle persone con SM e dei progressi nella diagnosi. Le donne di solito sono colpite un po’ prima (da due a cinque anni) e anche più frequentemente. “L’esatta eziologia rimane poco chiara, ma i fattori ambientali e genetici giocano un ruolo chiave”, ha detto. Le influenze ambientali si riflettono talvolta nella diversa distribuzione della malattia a seconda della latitudine: il rischio di SM diminuisce con l’aumentare della vicinanza all’equatore, il che è talvolta spiegato dal metabolismo della vitamina D [1]. L’effetto della sostituzione della vitamina D rimane poco chiaro, ma è attualmente oggetto di diversi studi (lo studio SOLAR sarà presto completato).
Anche le comorbidità vascolari (fumo, ecc.) peggiorano significativamente il decorso. Sempre più spesso, il loro numero è associato a un aumento del rischio di progressione della disabilità, di passaggio alla fase secondaria progressiva e di progressione e gravità della malattia in generale. Anche le infezioni giocano un ruolo. Un noto fattore scatenante della SM è il virus di Epstein-Barr. I bambini e gli adolescenti sono particolarmente esposti ai fattori di rischio ambientali. Chi contrae la febbre ghiandolare in tarda adolescenza ha un rischio maggiore di SM.
La componente genetica si riflette talvolta nel fatto che i parenti di un paziente hanno maggiori probabilità di sviluppare la malattia rispetto alla popolazione generale (il rischio relativo nei parenti di primo grado è di circa 9,2). Esistono correlazioni con il cosiddetto antigene leucocitario umano (HLA). Gli studi di popolazione hanno anche dimostrato che l’incidenza della malattia varia anche tra le etnie esposte a influenze ambientali comparabili.
GM-CSF come nuovo bersaglio terapeutico?
Prof. Dr. rer. nat. Burkhard Becher, Istituto di Immunologia Sperimentale dell’Università di Zurigo, ha affrontato il ruolo della citochina pro-infiammatoria GM-CSF, tra le altre cose. Questo è essenziale per lo sviluppo della SM nei topi. Per chiarire il ruolo del GM-CSF nella patogenesi della SM umana, è stato analizzato il sangue di pazienti con SM o di donatori sani, sono stati isolati i globuli bianchi e analizzate le citochine prodotte. Gli studi illustrano che il numero di cellule T che producono GM-CSF è notevolmente aumentato nei pazienti con SM. E: più grave è l’attività della malattia, più le cellule producono GM-CSF. Questo è indotto dall’interleuchina 2 (IL-2), che a sua volta rende il recettore dell’IL-2 un gene di rischio per la SM. È stato dimostrato che i donatori sani con questo gene di rischio (polimorfismo nel gene del recettore IL-2-α) hanno più cellule T produttrici di GM-CSF rispetto ai donatori con il gene non di rischio [2]. Ma come si può trasferire questa scoperta alla clinica? “Per esempio, con un anticorpo contro il GM-CSF come MOR103 [3]”, ha spiegato il Prof. Becher. “Il futuro mostrerà se abbiamo a che fare con un nuovo candidato per la terapia della SM”.
Disabilità nella SM: come misurarla?
Le disabilità nella SM sono state il tema della conferenza del Dr. med. Christian Kamm, Clinica Universitaria di Neurologia, Inselspital di Berna. La cosiddetta “assenza di evidenza di attività di malattia” (NEDA) è attualmente definita da tre parametri: assenza di ricadute, assenza di progressione EDSS, assenza di attività RM. A volte viene discussa l’integrazione dei fattori “atrofia cerebrale” e “cognizione” in questo concetto. La Expanded Disability Status Scale (EDSS) rimane il gold standard per misurare la disabilità nella SM (standardizzata elettronicamente su neurostatus.net). La gravità della disabilità viene valutata in sette sistemi funzionali (visivo, tronco encefalico, piramidale, cervelletto, sensoriale, intestinale/vescicale, funzione mentale). Inoltre, ci sono informazioni sulla capacità di camminare. La scala parte da 0 e arriva a 10. Le debolezze dell’EDSS sono: Variabilità nell’esame neurologico, nella percezione dell’esaminatore e nei limiti naturali della percezione umana. Attualmente si stanno testando strumenti di valutazione digitale (ad esempio con la telecamera Kinect®), che in futuro potrebbero essere utilizzati per valutare le funzioni motorie nella SM in modo più preciso e standardizzato (progetto ASSESS-MS).
A partire da un valore di 4,5, l’EDSS prende in considerazione quasi solo la distanza di deambulazione e quindi presenta alcune limitazioni che possono essere risolte con esami aggiuntivi. La capacità funzionale degli arti superiori, ad esempio, dovrebbe essere testata separatamente, poiché è sempre più limitata negli EDSS avanzati. Il cosiddetto Nine-Hole Peg Test (9HPT) verifica quanto tempo impiega il paziente a posizionare nove chiodi nei fori designati e poi a rimuoverli di nuovo. Secondo il relatore, questo test è affidabile, valido e sufficientemente sensibile per valutare la destrezza manuale nei pazienti con SM. Esistono dati normativi in base all’età, al sesso e alla mano destra o sinistra [4]. Mentre il 9HPT richiede ancora diversi utensili, il Coin Rotation Task (CRT) sviluppato a Berna richiede solo una moneta da 50 centesimi. In questo caso, i pazienti devono ruotare la moneta il più velocemente possibile tra il pollice, l’indice e il medio (più di 19 s per 20 mezze inversioni sono patologiche) [5]. “La CRT è paragonabile al 9HPT e all’Action Research Arm Test (ARAT), ma non è più ugualmente fattibile al di sopra di un EDSS di circa 7”, ha spiegato il dottor Kamm.
Anche la cognizione è sottorappresentata nell’EDSS, sebbene i disturbi come i deficit di memoria, attenzione o concentrazione siano tra i principali sintomi della SM (prevalenza 43-65%). Il Symbol Digit Modalities Test (SDMT) può essere considerato un supplemento pratico [6].
Stato della farmacoterapia
Una panoramica dei trattamenti terapeutici per la SM è riportata nelle tabelle 1 e 2. Secondo il Prof. Dr. med. Heinrich Mattle, Clinica Universitaria di Neurologia, Inselspital di Berna, gli studi randomizzati e controllati dimostrano che le lesioni da risonanza magnetica sono la causa principale dei deficit neurologici – quindi devono essere prevenute terapeuticamente. Nella SM recidivante-remittente, le lesioni si trovano inizialmente soprattutto nella materia bianca, e nella forma secondaria progressiva sempre più spesso anche nella materia grigia [7]. Questo è poi fondamentale per la disabilità a lungo termine, come ha chiarito il Prof. Nicola De Stefano, MD, Università di Siena, nella sua precedente conferenza [8].
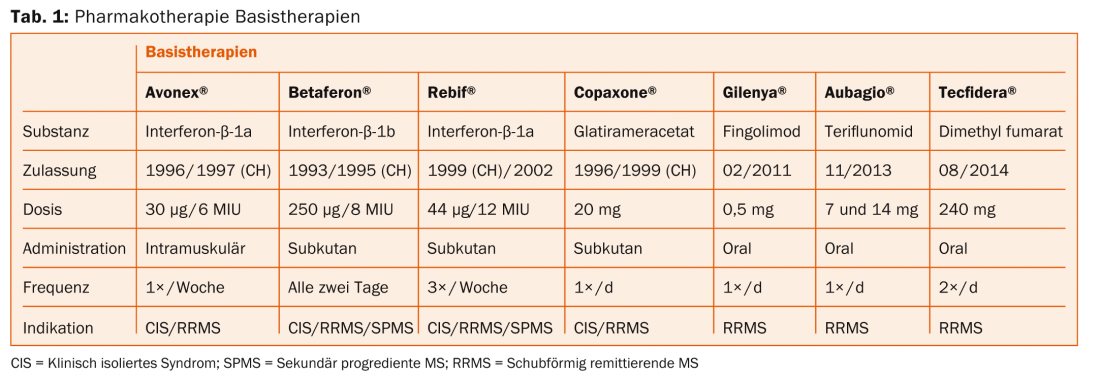
“La terapia dovrebbe quindi essere effettuata il più precocemente possibile per migliorare l’esito a lungo termine. Ma si applica anche il principio “Primum nihil nocere” (“Prima non nuocere”), ossia trovare l’equilibrio ottimale tra effetto ed effetti collaterali”, ha spiegato il Prof. Mattle.
Farmaci iniettabili (Betaferon®, Rebif®, Avonex®, Copaxone®): Ha bisogno di iniezioni regolari. I possibili effetti collaterali sono reazioni cutanee o sistemiche. Tuttavia, non ci sono effetti collaterali gravi a lungo termine. “Non conosciamo ancora gli effetti dei nuovi farmaci dopo 20 anni. È qui che gli agenti iniettabili sono meglio studiati”, ha sottolineato il Prof. Mattle. Nel prossimo futuro, arriverà sul mercato svizzero anche il β-interferone pegilato (peginterferone-β-1a) (studio ADVANCE [9]), che deve essere iniettato meno frequentemente rispetto agli altri principi attivi.
Fingolimod (Gilenya®): La somministrazione è orale, una volta al giorno. Il principio attivo può causare effetti collaterali cardiaci (è necessario un monitoraggio alla prima somministrazione). Anche l’edema maculare e le infezioni da herpes virus sono possibili, ma rare. Il farmaco è controindicato in gravidanza. Per i pazienti a rischio di tumori cutanei maligni, si consiglia cautela o un regolare monitoraggio dermatologico per essere al sicuro (anche se le preoccupazioni a questo proposito non sono chiaramente stabilite).
Teriflunomide (Aubagio®): La somministrazione è orale, una volta al giorno. Nella prima metà dell’anno, il monitoraggio degli enzimi epatici è richiesto ogni due settimane, dopodiché è sufficiente un monitoraggio di otto settimane. I possibili effetti collaterali sono nausea, diarrea e alopecia. Un metodo contraccettivo affidabile è un prerequisito per la terapia.
Dimetil fumarato (Tecfidera®): Il principio attivo viene somministrato per via orale due volte al giorno (il che può limitare l’aderenza). Gli esami del sangue devono essere eseguiti prima dell’inizio del trattamento, dopo tre e sei mesi e poi ogni sei-dodici mesi. I possibili effetti collaterali includono vampate, dolori addominali e diarrea. Anche in questo caso, la contraccezione è un prerequisito.
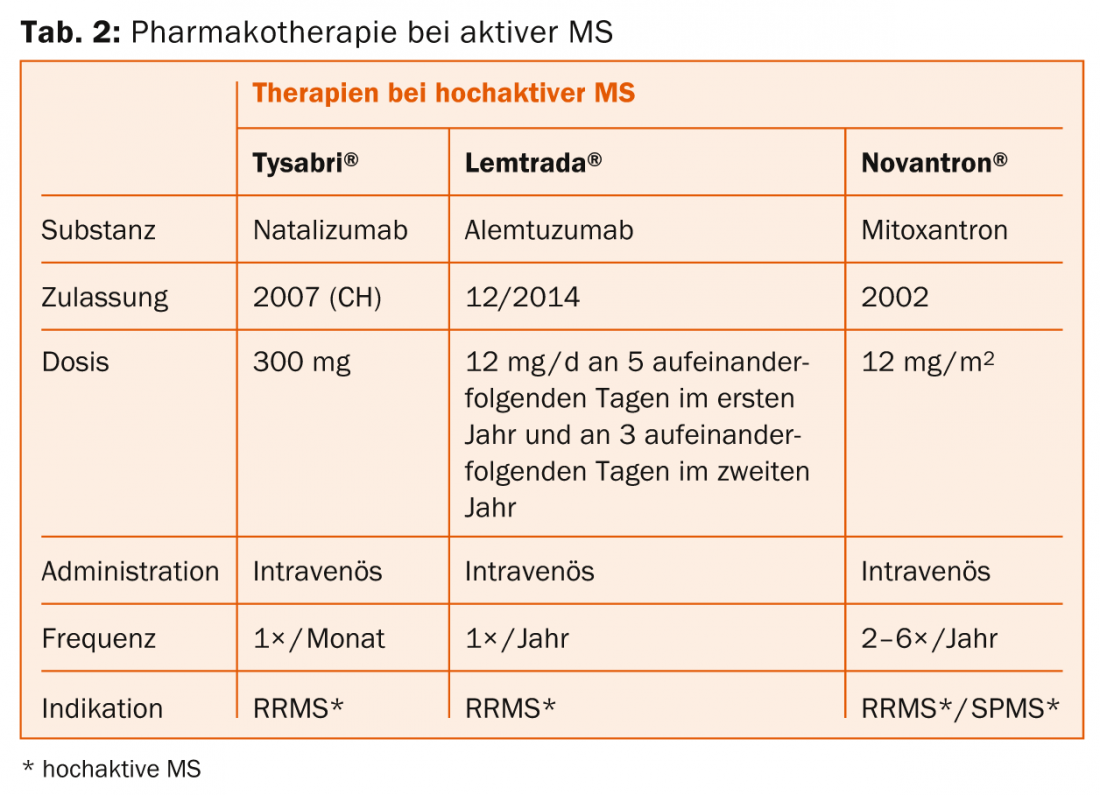
Natalizumab (Tysabri®): Il principio attivo viene comodamente somministrato una volta al mese tramite infusione. Un rischio importante è la leucoencefalopatia multifocale progressiva (PML) nei pazienti con il virus JC, motivo per cui è necessaria la rilevazione degli anticorpi.
Alemtuzumab (Lemtrada®): Il principio attivo viene somministrato comodamente due volte in due anni tramite serie di infusioni. Possono verificarsi reazioni gravi all’infusione. Vale la pena menzionare anche il rischio di sviluppare altre malattie autoimmuni (tra cui la tiroide o il rene) o la trombocitopenia immunitaria.
Applicazione nella pratica
Al momento dell’evento (gennaio 2015), Bern aveva il seguente regime terapeutico per la SM recidivante-remittente:
Prima linea: a seconda degli effetti collaterali e dell’attività della malattia, vengono utilizzati interferone-β, glatiramer acetato, teriflunomide, dimetil fumarato o fingolimod. Per la SM altamente attiva, possono essere presi in considerazione natalizumab e alemtuzumab.
Seconda linea: se esiste attività, si sceglie tra dimetil fumarato, fingolimod, natalizumab o alemtuzumab (eventualmente anche mitoxantrone).
Terza linea: Natalizumab e alemtuzumab (eventualmente anche mitoxantrone) sono inizialmente disponibili qui. I farmaci non approvati in Svizzera per questa indicazione, come rituximab o daclizumab, o il trapianto autologo di cellule staminali, sono procedure sperimentali (anche per le forme altamente attive).
Ci sono più dati per la SM secondaria progressiva che per la forma degenerativa primaria, ma nel complesso la situazione della ricerca è peggiore rispetto alla SM recidivante-remittente. Rebif® ha dimostrato di essere più efficace contro la SM secondariamente progressiva in quei pazienti che presentano ancora ricadute cliniche [10]. Betaferon® apporta benefici anche ai pazienti con attività di ricaduta e progressione significativa della disabilità (variazione EDSS >1, due anni prima dell’ingresso nello studio) più [11].
Il Sativex® può essere utilizzato per la terapia sintomatica. Viene utilizzato per il miglioramento dei sintomi nei pazienti con spasticità da moderata a grave.
Fonte: Simposio sulla sclerosi multipla, 8 gennaio 2015, Berna
Letteratura:
- Ascherio A, et al: La vitamina D come predittore precoce dell’attività e della progressione della sclerosi multipla. JAMA Neurol 2014 Mar; 71(3): 306-314.
- Hartmann FJ, et al: Il polimorfismo IL2RA associato alla sclerosi multipla controlla la produzione di GM-CSF nelle cellule TH umane. Nat Commun 2014 Oct 3; 5: 5056. doi: 10.1038/ncomms6056.
- Korolkiewicz RP, et al: Studio di fase Ib per valutare MOR103 nella sclerosi multipla. NCT01517282. Online su: https://clinicaltrials.gov/ct2/show/study/NCT01517282.
- Oxford Grice K, et al: Norme per adulti per il test del piolo a nove buchi disponibile in commercio per la destrezza delle dita. Am J Occup Ther 2003 Sep-Oct; 57(5): 570-573.
- Heldner MR, et al: Compito di rotazione delle monete: un test valido per la destrezza manuale nella sclerosi multipla. Phys Ther 2014 Nov; 94(11): 1644-1651.
- Van Schependom J, et al: Il Symbol Digit Modalities Test come test sentinella per il deterioramento cognitivo nella sclerosi multipla. Eur J Neurol 2014 Sep; 21(9): 1219-1225, e71-72.
- Kutzelnigg A, et al: Demielinizzazione corticale e lesioni diffuse della sostanza bianca nella sclerosi multipla. Brain 2005 Nov; 128(Pt 11): 2705-2712.
- Filippi M, et al: Il danno alla materia grigia predice l’accumulo di disabilità 13 anni dopo nella SM. Neurologia 2013 Nov 12; 81(20): 1759-1767.
- Calabresi PA, et al: Interferone pegilato β-1a per la sclerosi multipla recidivante-remittente (ADVANCE): uno studio randomizzato, di fase 3, in doppio cieco. Lancet Neurol 2014 Jul; 13(7): 657-665.
- Gruppo di studio SPECTRIMS (Secondary Progressive Efficacy Clinical Trial of Recombinant Interferon-Beta-1a in MS): Studio controllato randomizzato sull’interferone beta-1a nella SM secondaria progressiva: risultati clinici. Neurologia 2001 Jun 12; 56(11): 1496-1504.
- Kappos L, et al: Interferone beta-1b nella SM secondaria progressiva: un’analisi combinata dei due studi. Neurologia 2004 Nov 23; 63(10): 1779-1787.
InFo NEUROLOGIA & PSICHIATRIA 2015; 13(2): 36-39