La malattia renale cronica (CKD) è classificata in base al tipo di malattia di base, alla velocità di filtrazione e all’entità della proteinuria. I pazienti con CKD sono pazienti a rischio cardiovascolare. La morbilità cardiovascolare aumenta con l’aumento della proteinuria e con la diminuzione del tasso di filtrazione. La base terapeutica per rallentare la progressione dell’insufficienza renale rimane la terapia antiproteinurica attraverso l’inibizione del RAS. Per quanto riguarda l’ipertensione arteriosa e renovascolare: un controllo troppo intensivo della pressione arteriosa tende ad essere sconsigliabile. L’ipertensione renale è la causa più comune di ipertensione secondaria nei pazienti di età superiore ai 50 anni con ipertensione resistente ed è associata a una maggiore mortalità cardiovascolare e a una più rapida perdita della funzione renale. La denervazione renale non deve essere utilizzata come metodo standard di trattamento dei pazienti con ipertensione “refrattaria”.
La prima parte di questo articolo si concentra sull’insufficienza renale cronica. Qual è il decorso della diagnosi e cosa si può dire sul rischio di progressione?
La malattia renale cronica (CKD) è definita da una velocità di filtrazione (eGFR) ≤60 ml/min/1.73 m2 o da segni di danno renale (nelle urine, nel siero o tramite imaging) nell’arco di tre mesi, secondo le linee guida KDIGO 2012 [1]. La classificazione della CKD deve essere effettuata in base al tipo di malattia di base, alla velocità di filtrazione e all’entità della proteinuria [1], in quanto questi parametri sono rilevanti non solo per la progressione (tab. 1), ma anche per stimare la morbilità e la mortalità cardiovascolare.
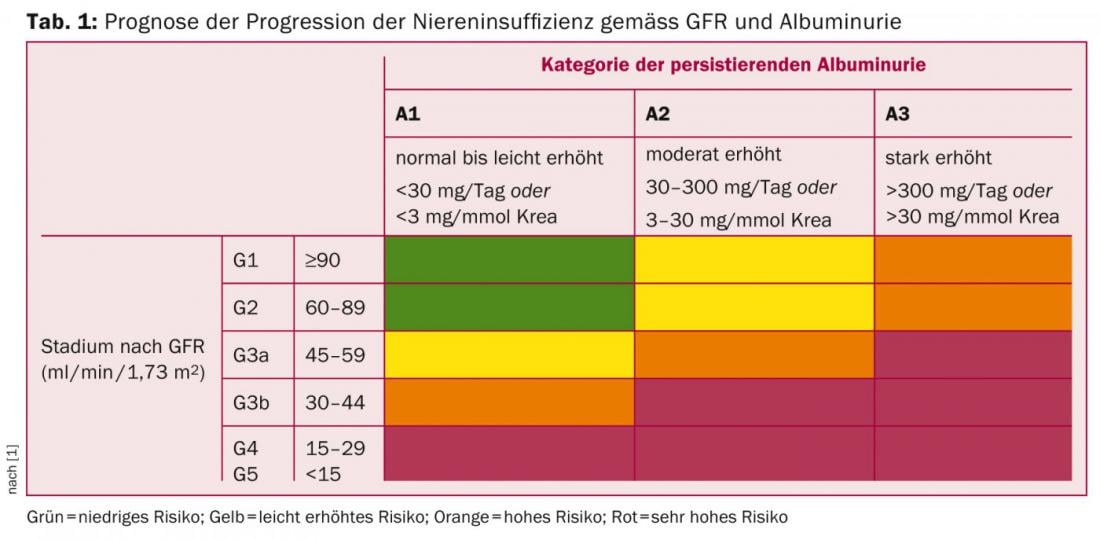
La stima dell’eGFR dovrebbe avvenire nella vita quotidiana attraverso la formula 2009-CKD-EPI [1]. La cistatina C insieme alla creatinina sierica per la determinazione dell’eGFR (formula creatinina-cistatina C 2012-CKD-EPI) deve essere utilizzata in situazioni speciali [2]. Questo è particolarmente vero quando la creatinina sierica non è correlata con l’eGFR (ad esempio, perdita di massa muscolare, cirrosi epatica, gravidanza, uso di trimetoprina) e quando non ci sono altre prove di malattia renale, se non una diminuzione del GFR stimato dalla creatinina sierica [1]. Entrambe le formule sono disponibili su internet all’indirizzo www.mdrd.com.
La presenza di microalbuminuria è un fattore di rischio cardiovascolare non correlato [3], sebbene non sia sempre associata alla progressione della malattia renale, in quanto la microalbuminuria può anche essere regressiva nel corso della malattia [4]. La diminuzione del tasso di filtrazione nei pazienti anziani fino alla CKD 3a (eGFR 45 ml/min/1.73 m2) può essere considerata un normale processo di invecchiamento se l’eGFR è stabile e la proteinuria è assente [1].
Complicazioni cardiovascolari (prevenzione)
I pazienti con CKD sono pazienti a rischio cardiovascolare. La morbilità cardiovascolare aumenta con l’aumento della proteinuria e con la diminuzione del tasso di filtrazione. L’effetto sembra essere additivo [5]. I fattori di rischio possono essere suddivisi in tradizionali (età, colesterolo LDL, ipertensione, sesso, ecc.) e non tradizionali (albuminuria, anemia, carico di volume, disturbo dell’equilibrio minerale-osseo). Le nuove linee guida KDIGO raccomandano una moderata riduzione del colesterolo LDL con una dose fissa di statina dopo una singola misurazione del colesterolo nei pazienti di età superiore ai 50 anni che non necessitano di dialisi, senza ulteriori controlli del profilo lipidico secondo la strategia “fire and forget” [6]. Nei pazienti di età inferiore ai 50 anni, la terapia farmacologica non è raccomandata fino a quando non sono presenti malattia coronarica, diabete mellito, ictus o un rischio calcolato di eventi coronarici a dieci anni >10%. In questo caso, si applicano i valori target della malattia di base [6].
Rallentamento della progressione dell’insufficienza renale
La terapia antiproteinurica attraverso l’inibizione del sistema renina-angiotensina-aldosterone (RAS) rimane la pietra miliare per rallentare la progressione dell’insufficienza renale. Poiché è disponibile più di una classe di composti per inibire il RAS, si sta studiando in che misura il doppio blocco del RAS abbia dei benefici in termini di mortalità cardiovascolare e di progressione verso l’insufficienza renale.
Lo studio ONTARGET è il più grande studio che ha analizzato la combinazione di un ACE inibitore con un sartano rispetto al solo trattamento con ACE inibitore o sartano nei pazienti ad alto rischio. La terapia combinata non ha mostrato alcun beneficio nella mortalità cardiovascolare. Per quanto riguarda gli endpoint renali, la terapia combinata ha persino mostrato un esito peggiore [7]. Uno dei principali svantaggi di ONTARGET è che sono stati inclusi solo pochi pazienti con proteinuria. Lo studio ALTITUDE [8] (combinazione dell’inibitore della renina aliskiren con ACE-I o ARB) e, più recentemente, lo studio NEPHRON-D [9] (combinazione di losartan con lisinopril rispetto a losartan da solo) in pazienti con diabete di tipo 2 e proteinuria, hanno mostrato che gli effetti collaterali gravi (iperkaliemia, insufficienza renale acuta) si sono verificati più frequentemente con la terapia combinata, tanto che gli studi sono stati interrotti prematuramente. Il doppio blocco del RAS non è più raccomandato nei pazienti con diabete e proteinuria. Non è ancora chiaro se i pazienti con nefropatia proteinurica dovuta a glomerulonefrite traggano beneficio dal doppio blocco del RAS.
Equilibrio calcio-fosfato e disturbi dell’equilibrio minerale osseo
La fisiopatologia degli squilibri minerali e ossei è classicamente percepita come lo sviluppo di un iperparatiroidismo secondario dovuto alla progressiva carenza di calcitriolo e alla ritenzione di fosfato. Le nuove scoperte sul sistema FGF-23/Klotho hanno cambiato questa percezione.
Già nelle fasi iniziali, si verifica un aumento di FGF-23, che inibisce contemporaneamente la sintesi di calcitriolo e di ormone paratiroideo [10]. È possibile che nelle prime fasi dell’insufficienza renale, FGF-23 regoli un bilancio positivo del fosfato, invisibile nel siero. Allo stesso tempo, FGF-23 serve a mantenere stabile il bilancio del calcio. Con l’ulteriore perdita di potenza del rene, l’effetto del co-recettore di FGF-23 Klotho diminuisce. L’ormone paratiroideo e l’FGF-23 aumentano in parallelo. Tuttavia, l’esatta fisiopatologia rimane poco chiara.
Secondo le linee guida KDIGO, i livelli normali di fosfato sierico e di ormone paratiroideo dovrebbero essere ricercati nei pazienti non in dialisi [11]. L’uso di leganti del fosfato nei pazienti non in dialisi con insufficienza renale avanzata è stato recentemente messo in discussione [12,13]. Sulla base delle informazioni di cui sopra, l’attenzione nella pratica clinica dovrebbe essere rivolta a ridurre l’assunzione di fosfato il più presto possibile – l’importanza della consulenza nutrizionale con l’obiettivo di ridurre il fosfato è in aumento [1]. Tuttavia, bisogna evitare di ottenere la riduzione dei fosfati attraverso la restrizione proteica e la malnutrizione [1]. In caso di carenza di vitamina D (25[OH]vitamina D <50 nmol/l), spesso presente nei pazienti con CKD [14], si raccomanda la sostituzione.
Ipertensione arteriosa e renovascolare
La seconda parte di questo articolo riguarda l’ipertensione arteriosa e renovascolare: quali sono gli attuali obiettivi pressori? E quali sono le novità in questo settore?
Le linee guida per il trattamento dell’ipertensione arteriosa sono cambiate negli ultimi anni. Nel 2012 sono state pubblicate le linee guida KDIGO, che affrontano in modo specifico il controllo della pressione arteriosa nei pazienti non in dialisi con insufficienza renale cronica. I valori target della pressione arteriosa sono stati aumentati per i pazienti senza albuminuria (<30 mg/giorno) con pressione arteriosa target <140/90 mmHg. Tuttavia, per i pazienti con albuminuria, gli obiettivi aggressivi vengono mantenuti senza prove concrete [15].
Nel 2013, le linee guida ESH/ESC sono state aggiornate (Tab. 2 e 3), raccomandando la riduzione della pressione arteriosa sistolica a <140 mmHg in tutti i pazienti ad alto rischio cardiovascolare, compresi quelli con proteinuria manifesta (con e senza diabete) [16].

La pressione arteriosa diastolica durante la terapia deve essere inferiore a 90 mmHg. Solo nei pazienti con diabete si raccomanda un’ulteriore riduzione a 85 mmHg [16]. La tendenza attuale è quella di sconsigliare una riduzione troppo intensa della pressione arteriosa. Ciò è dovuto in particolare agli studi condotti su diabetici di tipo 2 ad alto rischio cardiovascolare, che hanno registrato una mortalità cardiovascolare più elevata a seguito di un controllo intensivo della pressione arteriosa [17,18].

Ipertensione renale
L’ipertensione renale è la causa più comune di ipertensione secondaria nei pazienti di età superiore ai 50 anni con ipertensione resistente (fino al 45%). La prevalenza dell’ipertensione renovascolare è dell’1-5% dei pazienti con ipertensione [19] ed è associata a una maggiore mortalità cardiovascolare e a una più rapida perdita della funzione renale. Grandi studi randomizzati (STAR e ASTRAL) non hanno dimostrato un beneficio terapeutico dello stenting dell’arteria renale [20,21]. Questi risultati sono stati ora confermati dallo studio CORAL, il più grande studio randomizzato nel campo fino ad oggi [22]. Nell’analisi del sottogruppo di pazienti con stenosi di grado superiore (>80%), funzione renale compromessa (eGFR <45 ml/min/1,73 m2), diabete mellito, stenosi bilaterale o pressione arteriosa elevata al basale (>160 mmHg), anche l’impianto di stent non ha mostrato alcun beneficio. CORAL è stato il primo studio in cui molti pazienti trattati nel braccio conservativo hanno ricevuto una combinazione di aspirina, ACE-inibitori o ARB e statine. Una critica allo studio CORAL è che la rilevanza emodinamica della stenosi è stata determinata solo dall’angiografia e non è stata confermata dalla misurazione della pressione intra-arteriosa. Inoltre, non è stata eseguita la misurazione dell’indice di resistenza ecografica duplex, che potrebbe indicare la rilevanza della stenosi come causa dell’ipertensione [23]. La decisione di impiantare uno stent nei casi di comprovata stenosi emodinamicamente rilevante dell’arteria renale deve essere presa solo dopo una valutazione ecografica duplex e clinica completa da parte di angiologi e nefrologi.
Ipertensione resistente
Calhoun et al. ha affrontato il problema dell’ipertensione refrattaria in un grande collettivo (studio REGARDS). Dopo la modifica della terapia, l’esclusione delle cause secondarie e il controllo dell’aderenza del paziente, solo lo 0,5% aveva un’ipertensione refrattaria [24]. La denervazione renale è stata oggetto di grande dibattito negli ultimi anni, dopo i risultati positivi degli studi Simplicity 1 [25] e Simplicity 2 [26]. Lo studio di Fadl et al. (uno studio di piccole dimensioni che richiedeva un’aderenza garantita ai farmaci) ha messo in dubbio l’efficacia della denervazione renale [27]. Pertanto, i risultati dello studio Simplicity-3 (studio approvato dalla FDA) erano molto attesi (denervazione vs. puntura arteriosa sham e inserimento di un catetere senza denervazione). Lo studio non ha mostrato alcun vantaggio significativo dell’intervento rispetto al trattamento sham [28]. Pertanto, la denervazione renale non deve essere utilizzata come metodo standard per il trattamento dei pazienti con ipertensione “resistente alla terapia”.
Prof. Dr. med. Michael Dickenmann
Letteratura:
- Linea guida di pratica clinica KDIGO 2012 per la valutazione e la gestione della malattia renale cronica. Kidn Int Suppl 2013 3(1).
- Shlipak MG, et al: N Engl J Med 2013 Sep 5; 369(10): 932-943.
- Go AS, et al: N Engl J Med 2004 Sep 23; 351(13): 1296-1305.
- Glassock RJ, Winearls C: Curr Opin Nephrol Hypertens 2010 Mar; 19(2): 123-128.
- Matsushita K, et al. (Chronic Kidney Disease Prognosis Consortium): Lancet 2010 Jun 12; 375(9731): 2073-2081.
- Linea guida di pratica clinica KDIGO per la gestione dei lipidi nella CKD: sintesi delle raccomandazioni e approccio clinico al paziente. Kidney Int 2014 Feb 19. doi: 10.1038/ki.2014.31.
- Mann JF, et al: Lancet 2008 Aug 16; 372(9638): 547-553.
- Parving HH, et al: N Engl J Med 2012; 367: 2204-2213.
- Fried LF, et al: N Engl J Med 2013; 369: 1892-1903.
- Isakova T, et al: Kidney Int 2011 Jun; 79(12): 1370-1378.
- Linea guida di pratica clinica KDIGO per la diagnosi, la valutazione, la prevenzione e il trattamento della malattia renale cronica-disturbo minerale e osseo (CKD-MBD). Kidney Int Suppl 2009 Aug; 113: 1-130.
- Hill KM, et al: Kidney Int 2013 maggio; 83(5): 959-966.
- Block GA, et al: J Am Soc Nephrol 2012 Aug; 23(8): 1407-1415.
- LaClair RE, et al: Am J Kidney Dis 2005; 45: 1026-1033.
- Linea guida di pratica clinica KDIGO per la gestione della pressione arteriosa nella malattia renale cronica. Kidney International Supplements 2012; 2.
- Mancia G, et al: Journal of Hypertension 2013, 31: 1281-1357.
- Cooper-DeHoff RM, et al: JAMA 2010 Jul 7; 304(1): 61-68.
- Cushman WC, et al: N Engl J Med 2010 Apr 29; 362(17): 1575-1585.
- Dworkin LD, Cooper CJ: N Engl J Med 2009 Nov 12; 361(20): 1972-1978.
- Wheatley K, et al. (Investigatori ASTRAL): N Engl J Med 2009; 361: 1953-1962.
- Bax L, et al: J Nephrol 2003; 16: 807-812.
- Cooper CJ, et al: N Engl J Med 2014; 370: 13-22.
- Radermacher J, et al: N Engl J Med 2001 344: 410-417.
- Calhoun DA, et al: Hypertension 2014 Mar; 63(3): 451-458.
- Investigatori Symplicity HTN-1: Hypertension 2011 May; 57(5): 911-917.
- Esler MD, et al: Circulation 2012 Dec 18; 126(25): 2976-2982.
- Fadl Elmula FE, et al: Hypertension 2014 May; 63(5): 991-999.
- Bhatt DL, et al. (Investigatori SYMPLICITY HTN-3): N Engl J Med 2014 Apr 10; 370(15): 1393-1401.
CARDIOVASC 2014; 13(4): 16-20