I farmaci con un range terapeutico ristretto, come spesso vengono utilizzati in oncologia, richiedono una conoscenza di base delle possibili interazioni con altri preparati. La farmacodinamica e la farmacocinetica non devono essere parole sconosciute.
L’uso sicuro dei farmaci comprende la conoscenza delle interazioni farmacologiche potenzialmente gravi. Soprattutto in oncologia, vengono spesso utilizzate sostanze con un range terapeutico ristretto. Vanno evitate con cura sia le concentrazioni subterapeutiche, con il rischio di fallimento del trattamento, sia le concentrazioni sovraterapeutiche, con potenziali effetti avversi. Una conoscenza di base della farmacodinamica e della farmacocinetica dei farmaci più frequentemente utilizzati – soprattutto in relazione ai farmaci oncologici orali somministrati quotidianamente, come gli inibitori della tirosin-chinasi o del checkpoint – è un prerequisito per anticipare o riconoscere le interazioni clinicamente rilevanti e indesiderate. La gestione delle interazioni farmacologiche comprende la riduzione della dose, la somministrazione ritardata o l’interruzione di almeno uno dei partner dell’interazione, a seconda della valutazione del rischio-beneficio. In questo articolo di formazione, viene illustrata una panoramica delle interazioni farmacologiche rilevanti, con casi clinici selezionati e un’attenzione particolare alle sostanze oncologiche.
Background farmacologico
L’uso sicuro dei farmaci comprende la conoscenza delle interazioni farmacologiche potenzialmente gravi. Soprattutto in oncologia, vengono spesso utilizzate sostanze con un profilo farmacologico complesso, una curva dose-risposta/tossicità ripida, differenze farmacocinetiche e farmacodinamiche a seconda della popolazione (variabilità interpaziente) e una bassa ampiezza terapeutica. Tutto ciò significa che il margine tra le concentrazioni terapeutiche e i livelli di farmaci potenzialmente tossici è spesso ridotto.
Uno “di troppo” può già portare a gravi effetti negativi. Sono presenti gli stessi effetti dell’intossicazione. Non è la dose, ma la concentrazione nel corpo a fare il veleno! Tutti i processi che portano a un aumento corrispondente possono quindi provocare anche i sintomi dell’effetto aumentato – analogamente all’avvelenamento. Le interazioni avverse possono persino avere conseguenze fatali, come ad esempio ha dimostrato la combinazione di sostanze antivirali come la sorivudina con analoghi orali del fluorouracile (ad esempio la capecitabina).
Un “troppo poco” può significare una perdita di attività, che può essere associata a una prognosi peggiore. Soprattutto in questo caso, i fattori di influenza sono clinicamente difficili da cogliere – diagnosi differenziale: non-responder! Un paziente muore prima a causa della sua malattia oncologica rispetto alla media statistica. Tuttavia, un induttore somministrato porta anche a una riduzione degli effetti collaterali associati alla chemio, che sono principalmente dipendenti dalla dose.
I pazienti multimorbidi e in trattamento polifarmacologico mostrano già una maggiore vulnerabilità alle interazioni farmacologiche. Altri fattori di rischio sono la disfunzione d’organo, soprattutto l’insufficienza renale, l’uso di induttori o inibitori enzimatici e le costellazioni di rischio con molti medici coinvolti. Il gruppo dei pazienti geriatrici è particolarmente suscettibile alle interazioni a causa di alcune peculiarità, in termini di farmacocinetica (alterata biodisponibilità, riduzione della clearance e delle funzioni degli organi, ipalbuminemia, riduzione del volume extracellulare, aumento della frazione di tessuto adiposo), polifarmacia e compliance farmacologica. Soprattutto nei pazienti anziani, la funzione renale basata sulla velocità di filtrazione glomerulare calcolata (eGFR) può apparire migliore di quanto non sia se l’immobilità e la massa muscolare ridotta portano a basse concentrazioni di creatinina nel sangue. Soprattutto nel caso di sostanze eliminate per via renale, si raccomanda una riduzione della dose.
In linea di principio, le interazioni farmacologiche possono essere suddivise in interazioni farmacocinetiche o farmacodinamiche.
La farmacocinetica descrive l’effetto dell’organismo sulla sostanza – in relazione all’assorbimento, alla distribuzione, al metabolismo e all’escrezione di un farmaco.
Le interazioni farmacocinetiche possono verificarsi a qualsiasi livello dell’ADME (assorbimento, distribuzione, metabolismo, eliminazione), ad es.
Assorbimento: interferenza delle sostanze nel tratto intestinale con complessazione e assorbimento consecutivamente ridotto.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Interazioni con farmaci antiacidi (inibitori della pompa protonica, antagonisti H2, antiacidi): Ex. Inibitori della tirosin-chinasi: crizotinib, dasatinib, erlotinib, gefitinib, lapatinib, pazopanib. Queste combinazioni sono da evitare o da utilizzare a intervalli.
- Distribuzione: interferenza dovuta allo spostamento dal legame con le proteine plasmatiche con aumento del volume di distribuzione con rilevanza clinica discutibile. La frazione libera e non legata di un farmaco è considerata la parte farmacologicamente attiva.
- Metabolismo: interferenza nel metabolismo con induzione o inibizione degli enzimi corrispondenti con conseguente accelerazione o inibizione del metabolismo.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Un esempio di substrati del citocromo (CYP) è la classe degli inibitori della tirosin-chinasi (TKI), che sono tutti metabolizzati in qualche misura attraverso il CYP3A4. Interazioni con potenti inibitori del CYP3A4 (ad esempio ketoconazolo, voriconazolo, itraconazolo) e potenti induttori del CYP3A4 (ad esempio rifampicina, enzalutamide). Rifampicina, enzalutamide) e TKI: axitinib, crizotinib, dasatinib, erlotinib, gefitinib, imatinib, lapatinib, nilotinib, pazopanib, regorafenib, ruxolitinib, sunitinib, vemurafenib. L’uso concomitante deve essere evitato o accompagnato da aggiustamenti della dose dei substrati (TKIs).
- Eliminazione: interferenza nell’eliminazione con la competizione per i meccanismi di trasporto, con conseguente ritardo nell’escrezione e possibile accumulo nell’organismo.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Esempi di sostanze oncologiche eliminate per via renale sono la bendamustina, la bleomucina, il carboplatino, il cisplatino, l’oxaliplatino, la ciclofosfamide, il metotrexato, il pemetrexed e il topotecan. I salicilati, il probenecid o le sulfonamidi possono competere per la secrezione tubulare renale se usati in concomitanza con il metotrexato, con conseguente riduzione dell’eliminazione e quindi aumento della concentrazione di metotrexato.
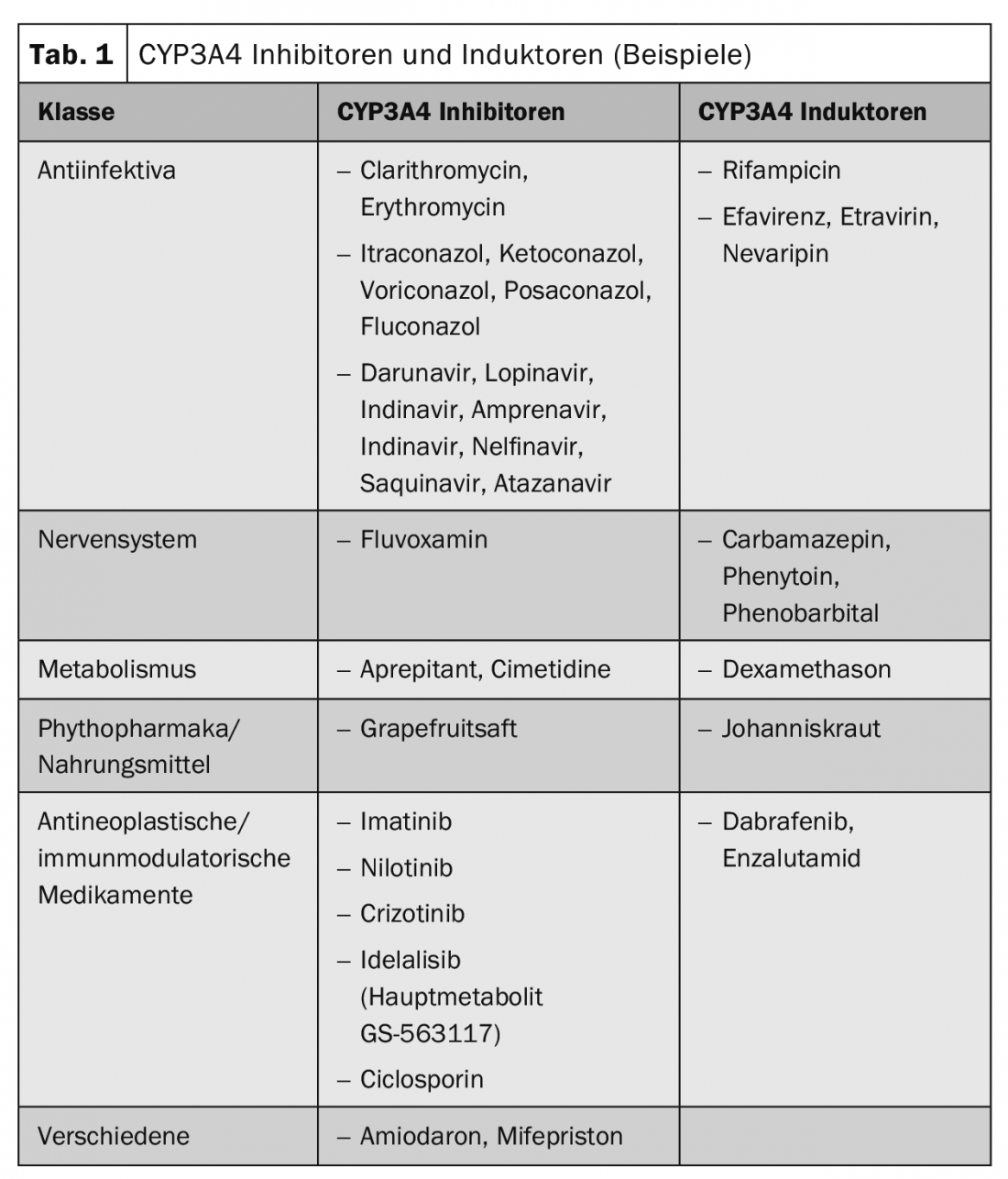
Le interazioni farmacocinetiche portano a una variazione del livello plasmatico delle sostanze, che può comportare un effetto ridotto o aumentato. Spesso sono coinvolti i rappresentanti della famiglia enzimatica del citocromo P450, i trasportatori di farmaci come la P-glicoproteina o i trasportatori di ioni organici. La Tabella 1 mostra esempi di sostanze di induttori e inibitori del CYP3A4 frequentemente utilizzati.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Il tamoxifene è a sua volta un farmaco che viene attivato tramite il CYP2D6. Pertanto, è necessaria una particolare cautela con gli inibitori di questo isoenzima. Il tamoxifene viene metabolizzato nel suo metabolita attivo endoxifene con il coinvolgimento del CYP2D6. Inoltre, il CYP3A4 e, in misura minore, il CYP2C9 e il CYP2C19 sono coinvolti nel metabolismo del tamoxifene. Gli inibitori del CYP2D6 possono quindi influenzare il metabolismo del tamoxifene in modo clinicamente rilevante e quindi portare a un’efficacia ridotta o alla perdita di efficacia del tamoxifene. La somministrazione contemporanea di inibitori del CYP2D6, come la paroxetina, ha portato a una riduzione delle concentrazioni plasmatiche del metabolita attivo endoxifene fino al 75% negli studi pubblicati. L’uso contemporaneo di inibitori del CYP2D6 (come paroxetina, fluoxetina) insieme al tamoxifene deve quindi essere evitato. L’antidepressivo venlafaxina, invece, non è un inibitore del CYP2D6.
Al contrario, gli stessi farmaci oncologici possono non solo essere substrati degli enzimi CYP, ma anche inibitori o induttori degli isoenzimi.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Idelalisib, un inibitore della fosfatidilinositolo 3-chinasi, viene convertito nel metabolita principale GS-563117, che è un forte inibitore del CYP3A. La reazione del marcatore CYP3A4 con midazolam ha mostrato un aumento della Cmax di midazolam del 140% e dell’AUC del 440%. C’è quindi anche la possibilità di interazione con altri farmaci che vengono metabolizzati tramite il CYP3A4, ad es. Ciclosporina, sirolimus, tacrolimus, amlodipina, carbamazepina, colchicina, diltiazem, felodipina, fentanil, ketoconazolo, itraconazolo, posaconazolo, voriconazolo, lidocaina, metadone, nifedipina, nicardipina, trazodone, warfarin, fenprocoumon, boceprevir, telaprevir, claritromicina, telitromicina, atorvastatina, tadalafil, buspirone, clorazepato, diazepam, estazolam, flurazepam, zolpidem o inibitori della tirosin-chinasi come erlotinib. Una combinazione con idelalisib, ad esempio, richiede una riduzione della dose di erlotinib, che deve essere diminuita a scaglioni di 50 mg, secondo le informazioni degli esperti. La dose raccomandata di erlotinib è solitamente di 150 mg una volta al giorno, almeno un’ora prima o due ore dopo aver mangiato.
Sono noti anche altri percorsi di degradazione o conversione indipendenti dal citocromo P450. Anche in questo caso, sono possibili alcune interazioni clinicamente rilevanti.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Il fluorouracile viene metabolizzato principalmente nel fegato in prodotti inattivi, tra cui anidride carbonica, urea e α-fluoroβ-alanina (FBAL). L’enzima diidropirimidina deidrogenasi (DPD), per il quale è noto un polimorfismo genetico, è coinvolto nel metabolismo. La metabolizzazione del fluorouracile è rallentata nei pazienti con insufficienza della diidropirimidina deidrogenasi (DPD). Questo è anche l’oggetto di una procedura in corso dell’Agenzia Europea dei Medicinali (EMA), in cui si stanno esaminando i metodi di screening esistenti per la carenza di DPD. Ma alcune sostanze possono anche inibire irreversibilmente la DPD. I medicinali che contengono fluorouracile, come ad esempio La capecitabina o il tegafur (prodromi del 5-FU) non devono essere utilizzati insieme alla brivudina o a sostanze chimicamente correlate come la sorivudina. L’inibizione enzimatica può portare ad un aumento della tossicità dei prodotti a base di 5-FU, che può essere potenzialmente fatale. Si deve osservare un intervallo di almeno 4 settimane tra il trattamento con brivudina, sorivudina o analoghi e l’inizio della terapia con prodotti a base di 5-FU.
La farmacodinamica, invece, descrive l’effetto della sostanza sull’organismo.
In questo tipo di interazione, l’attività farmacologica della rispettiva sostanza viene influenzata, senza modificare la concentrazione nel sito d’azione, dalla combinazione con una sostanza con un effetto simile o opposto, con conseguente potenziamento o attenuazione dell’effetto terapeutico. Questo non cambia le concentrazioni nel sangue. Il monitoraggio terapeutico dei farmaci (TDM) con determinazioni dei livelli plasmatici non fornisce quindi alcuna informazione aggiuntiva. Ad esempio, diverse sostanze, così come le classiche sostanze oncologiche (ad esempio le antracicline) possono prolungare il tempo QTc. Queste alterazioni dell’ECG sono comunemente segnalate anche per gli inibitori della tirosin-chinasi. Il potenziale dipende dalla struttura chimica e dalla concentrazione plasmatica della sostanza. Pertanto, il prolungamento del QTc può essere ulteriormente aumentato in combinazione con gli inibitori del CYP, ma anche con l’uso simultaneo di diversi farmaci che influenzano il tempo QTc.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Esempi di inibitori della tirosin-chinasi che interagiscono con le sostanze che allungano il QTc: Crizotinib, gefitinib, lapatrinib, nilotinib, pazopanib, sorafenib, sunitinib, vandetanib, vemurafenib. Se le combinazioni speciali sono clinicamente necessarie, i controlli ECG sono raccomandati già prima dell’inizio della terapia e poi nel corso successivo.
Le interazioni farmaco-farmaco sono di particolare importanza, in quanto possono essere previste da precedenti rapporti di casi, studi clinici o dalla comprensione dei principi farmacologici. Le interazioni farmacologiche avverse possono avere conseguenze fino al pericolo di vita, che possono portare al ritiro dal mercato di sostanze consolidate.
Le interazioni farmaceutiche, in quanto incompatibilità fisico-chimiche di due sostanze all’esterno del corpo, possono portare alla complessazione, alla degradazione o alla precipitazione. Tuttavia, non sono oggetto di questa panoramica.
Oltre alle interazioni farmaco-farmaco, esistono anche interazioni farmaco-erbe (ad esempio con ginkgo, ginseng, aglio), interazioni farmaco-cibo (ad esempio con latte, succo di pompelmo), interazioni farmaco-alcool (ad esempio con benzodiazepine e molte altre sostanze sedanti), o interazioni farmaco-malattia (ad esempio metoclopramide e malattia di Parkinson). Sono possibili anche interazioni con altre sostanze e con sostanze esogene come il tabacco. Gli ingredienti del tabacco provocano l’induzione di CYP1A1 e CYP1A2 nei fumatori.
Focus speciale – sostanze oncologiche e gruppi di sostanze: Caso di studio tabacco ed erlotinib: ad esempio, l’erlotinib viene metabolizzato nel fegato attraverso gli isoenzimi CYP3A4 e CYP1A2 e nei polmoni forse attraverso il CYP1A1. Ciò comporta una riduzione del 50-60% dell’esposizione a erlotinib nei fumatori. In uno studio farmacocinetico, l’esposizione era da metà a un terzo di quella riscontrata nei non fumatori o negli ex fumatori, come risultato dell’induzione del CYP1A1 nel polmone e del CYP1A2 nel fegato. Per questo motivo, la cessazione del fumo dovrebbe essere raccomandata anche ai fumatori.
D’altra parte, anche le interazioni, soprattutto in oncologia con molte terapie combinate, sono auspicabili. Tuttavia, a seconda dello studio, le interazioni farmacologiche sono anche responsabili del 20-30% delle reazioni avverse ai farmaci, la maggior parte delle quali diventa clinicamente rilevante. Con l’aumento del numero di farmaci somministrati, aumenta anche il potenziale di interazioni farmacologiche avverse. Sono associate a un aumento della morbilità e della mortalità, a un’ospedalizzazione prolungata dei pazienti affetti e a un aumento dei costi sanitari. Sebbene alcune reazioni avverse ai farmaci ed effetti collaterali non possano essere previste, molte possono essere anticipate e prevenute.
Casi dalla pratica
Interazione farmacocinetica: chemioterapia e terapia antiretrovirale: Un uomo di 63 anni con infezione da HIV di lunga data con terapia antiretrovirale appropriata e malattia coronarica a 3 vasi si presenta con masse recentemente indistinte nella testa del pancreas. Nei casi di sospetto carcinoma della testa del pancreas, la chemioterapia con gemcitabina e nab-paclitaxel deve essere testata per verificare le interazioni con la terapia esistente (scheda 2).
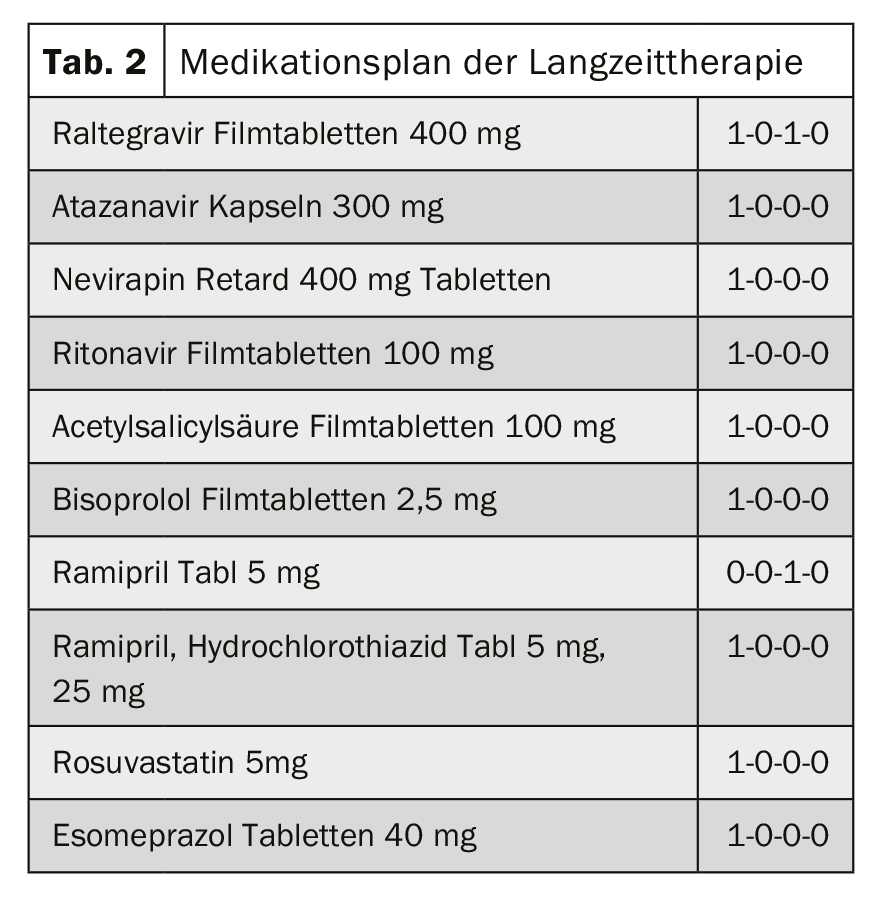
Valutazione e contesto: Il nab-paclitaxel è un agente antimicrotubulare. Il nab-paclitaxel viene metabolizzato attraverso il CYP2C8 e il CYP3A4. I farmaci che inducono o inibiscono il sistema enzimatico CYP (CYP2C8 e/o CYP3A4) possono quindi influenzare i livelli plasmatici di nab-paclitaxel e quindi la sua efficacia.
- Interazione Nab-paclitaxel e ritonavir: Ritonavir è un forte inibitore del CYP2C8 e del CYP3A4. La forte inibizione di questi enzimi può anche portare ad un aumento dei livelli plasmatici di nab-paclitaxel.
- Interazione paclitaxel e atazanavir: Atazanivir è un forte inibitore del CYP3A4 e un debole inibitore del CYP2C8. Una forte inibizione del CYP3A4 può portare ad un aumento dei livelli plasmatici di nab-paclitaxel. La debole inibizione del CYP2C8 probabilmente svolge un ruolo minore – ma potrebbe sommarsi ad altre interazioni. Sebbene queste interazioni non siano state formalmente dimostrate da studi di farmacocinetica, si può ipotizzare un aumento dell’effetto e del rischio dose-dipendente di effetti collaterali sulla base di derivazioni teoriche.
Sulla base di derivazioni teoriche, le interazioni farmacocinetiche di atazanavir e ritonavir con nab-paclitaxel portano ad un aumento dei livelli plasmatici dell’agente antimicrotubulare. Nella terapia combinata, si prevedono effetti farmacologici avversi concentrazione-dipendenti di nab-paclitaxel, come depressione del midollo osseo, mucosite e neuropatia periferica. A causa del ristretto range terapeutico della chemioterapia, della mielotossicità come complicanza potenzialmente pericolosa per la vita e di diversi percorsi di degradazione del paclitaxel che verrebbero inibiti, si raccomanda il passaggio dei partner della combinazione atazanavir/ritonavir e nab-paclitaxel.
L’interazione farmacodinamica: inibitore del checkpoint e “immunomodulatori”/immunosoppressori [7]: Una paziente donna di 53 anni con una storia di trapianto di fegato 36 mesi fa per un carcinoma epatocellulare dovuto a cirrosi epatica con infezione cronica da epatite C sta ricevendo prednisone, micofenolato ed everolimus come terapia immunosoppressiva. A causa della recidiva di HCC con metastasi due anni dopo il trapianto, viene somministrato sorafenib. A causa degli effetti collaterali e della progressione della malattia di base, il trattamento viene nuovamente interrotto dopo due mesi. Viene iniziato il trattamento con Nivolumab alla dose di 200 mg (3 mg/kg di peso corporeo). In seguito, i parametri di funzionalità epatica aumentano dopo una settimana. Viene eseguita una biopsia epatica che mostra segni di rigetto cellulare acuto. Il paziente viene quindi trattato con tacrolimus e metilprednisone 500 mg/giorno. C’è un ulteriore deterioramento della funzione epatica, delle condizioni cliniche, della depressione del SNC nell’emorragia intracerebrale con cure mediche intensive e infine esito fatale.
Valutazione e contesto: Gli inibitori del checkpoint immunitario, come nivolumab, hanno rivoluzionato il trattamento di diverse patologie tumorali. Nivolumab (Opdivo®) è un anticorpo monoclonale umano IgG4 che blocca i recettori PD-1 sulle cellule T attivate, sulle cellule B e sulle cellule T natural killer, sui monociti e sulle cellule dentritiche. I recettori PD-1 hanno 2 ligandi, PD-L1 e PD-L2, che sono espressi sulle cellule tumorali e sulle cellule che presentano l’antigene. Il legame del recettore con i ligandi porta a una regolazione negativa delle cellule T e alla prevenzione della risposta delle cellule T. La prevenzione del legame porta a una risposta delle cellule T e a un effetto antitumorale. D’altra parte, la tolleranza immunitaria nel trapianto di organi è essenziale per questo paziente. La trasduzione del segnale PD-1 e CTLA-4 porta alla tolleranza immunitaria. Pertanto, l’inibizione può innescare un’insufficienza immunomediata degli organi in questi pazienti.
Secondo l’RCP svizzero, “il trattamento con nivolumab o nivolumab in combinazione con ipilimumab non deve essere ripreso mentre il paziente sta ricevendo dosi di corticosteroidi immunosoppressivi o altra terapia immunosoppressiva”. Inoltre, “l’uso di corticosteroidi sistemici e altri immunosoppressori deve essere evitato prima di iniziare il trattamento con nivolumab, a causa della loro possibile interferenza con l’attività farmacodinamica”. Sulla base di considerazioni farmacodinamiche, questa interazione può diventare rilevante in entrambe le direzioni: Una riduzione dell’effetto immunosoppressivo degli importanti farmaci post-trapianto, ma anche una riduzione dell’effetto antitumorale degli inibitori del checkpoint.
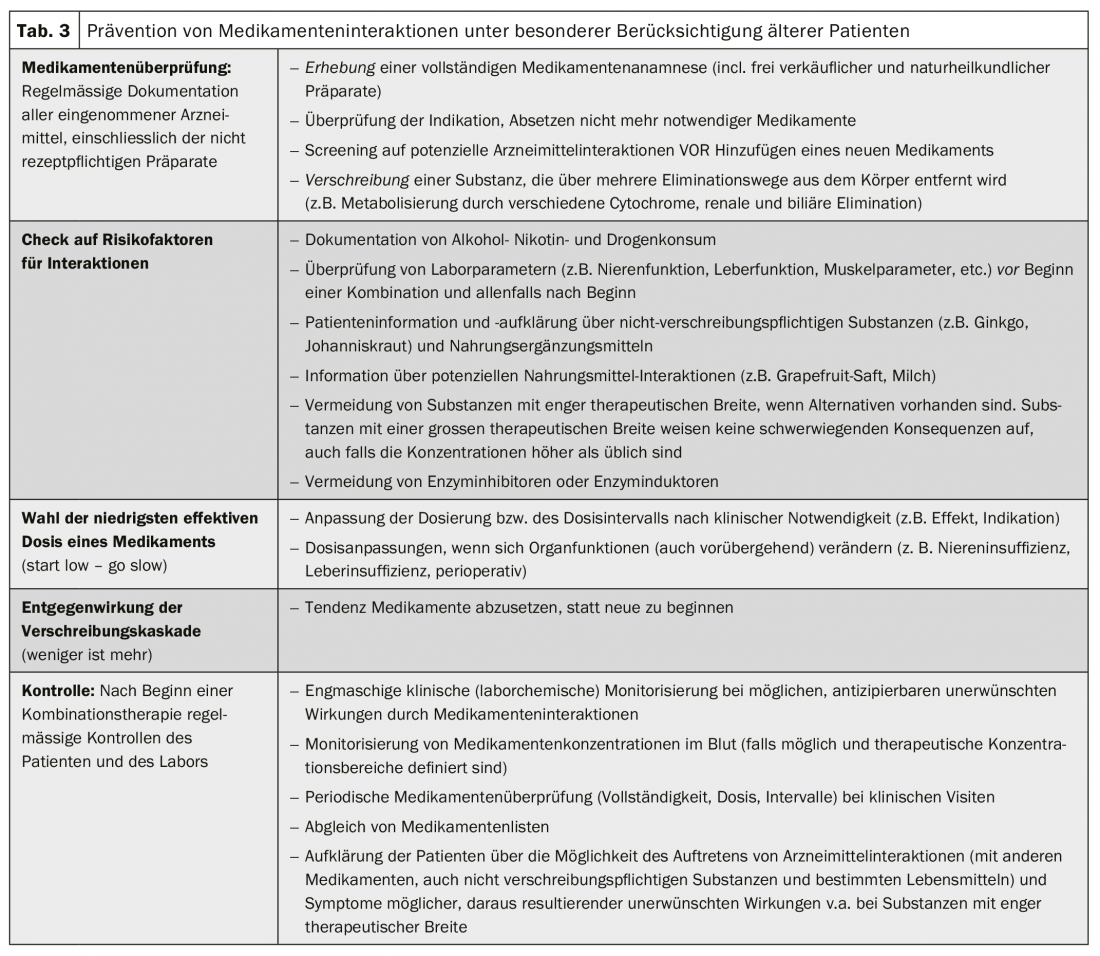
Approccio clinico alle interazioni farmacologiche
Le interazioni tra farmaci possono causare problemi clinici di vario grado. Idealmente, questi aspetti vengono anticipati prima che si verifichino. Soprattutto in caso di politerapia, è necessario osservare alcune regole (tab. 3). Le interazioni e gli effetti collaterali non riconosciuti possono anche sfociare in una cosiddetta cascata di prescrizioni: Gli effetti collaterali non vengono riconosciuti come tali e le nuove terapie vengono somministrate contro i nuovi “sintomi”, invece di riconoscere l’innesco farmacologico. Quando si verificano interazioni con effetti avversi, la gestione consiste nell’interruzione o nella riduzione della dose della/e sostanza/e sospetta/e, nel monitoraggio continuo, nei controlli clinici o nelle misurazioni del livello terapeutico. (Tab. 4). L’individuazione e la prevenzione di interazioni farmacologiche indesiderate e clinicamente rilevanti è un lavoro di squadra e coinvolge non solo il paziente, ma anche tutti i medici, gli infermieri e i farmacisti interessati.

Si potrebbe dimostrare che i ricoveri legati all’interazione potrebbero essere evitati grazie a controlli adeguati e alla selezione razionale del farmaco più appropriato alla situazione. L’assistenza per le interazioni farmacologiche è fornita dai libri di testo attuali, dai programmi di interazione o dai siti web di interazione (riquadro). Tuttavia, i programmi informatici progettati per aiutare a rilevare le combinazioni pericolose falliscono fino a un terzo delle interazioni, mentre d’altra parte spesso avvertono inutilmente di interazioni banali e clinicamente irrilevanti. Pertanto, spesso è utile consultare più di un database di interazioni.
|
Pagine web per il controllo dell’interazione
|
Le considerazioni di principio sulla potenziale interazione forniscono un ulteriore supporto:
- L’elenco dei farmaci è completo, compreso. preparati a base di erbe?
- Ci sono sostanze che sono particolarmente suscettibili di interazione?
- Esistono potenziali alternative a queste sostanze?
- Come si possono monitorare gli effetti?
- Si tratta di un’interazione farmacocinetica per la quale potrebbe essere utile il monitoraggio terapeutico con determinazione dei livelli?
- Qual è la gravità dell’effetto avverso? Quanto è grande la rilevanza clinica della terapia? (valutazione dei rischi e dei benefici)
- L’interazione è dipendente dalla dose o dalla concentrazione? Ci si può aspettare un miglioramento dei sintomi con una riduzione della dose?
- Ci sono altri fattori specifici del paziente che favoriscono la reazione avversa (ad esempio, l’insufficienza renale)? Possono essere ottimizzati?
Sommario
In sintesi, è importante pensare innanzitutto alle potenziali interazioni farmacologiche. Questo è particolarmente importante quando un nuovo farmaco viene aggiunto a un regime terapeutico già complesso. Le nuove sostanze oncologiche, come le terapie mirate, vengono spesso assunte quotidianamente. L’ampiezza terapeutica è spesso limitata. I pazienti oncologici anziani e con una ridotta capacità di eliminazione – come la disfunzione renale – sono particolarmente suscettibili agli effetti avversi dovuti alle interazioni farmacologiche.
Messaggi da portare a casa
- Soprattutto in oncologia, vengono utilizzate prevalentemente sostanze con un range terapeutico ristretto.
- Prima di aggiungere una nuova sostanza (farmaco ma anche fitofarmaco) a un piano terapeutico già esistente, occorre verificare le potenziali interazioni.
- Per il controllo delle interazioni farmacologiche sono disponibili programmi speciali di interazione, siti web di interazione con precisione variabile.
- Le opzioni per le interazioni farmacologiche avverse variano a seconda del tipo e della gravità o del rapporto rischio/beneficio. Potrebbe essere necessaria una riduzione della dose, una modifica del tempo di applicazione o addirittura l’interruzione della/e sostanza/e sospetta/e.
- Se si sospettano o non si possono evitare le interazioni farmacologiche, si consiglia un attento monitoraggio clinico o di laboratorio e, se necessario, la misurazione delle concentrazioni di farmaco nel sangue (in caso di interazioni farmacocinetiche).
Letteratura:
- Wilkinson GR: Metabolismo dei farmaci e variabilità tra i pazienti nella risposta ai farmaci. N Engl J Med 2005; 352: 2211-2221.
- van Leeuwen RW, et al: Interazioni farmaco-farmaco con gli inibitori della tirosin-chinasi: una prospettiva clinica. Lancet Oncol 2014; 15: e315-e326.
- van Leeuwen RW, et al: Prevalenza di potenziali interazioni farmaco-farmaco nei pazienti oncologici trattati con farmaci antitumorali orali. Br J Cancer 2013; 108: 1071-1078.
- Mallet L, Spinewine A, Huang A: La sfida della gestione delle interazioni farmacologiche negli anziani. Lancet. 2007 Jul 14;370(9582): 185-191.
- Beijnen JH, Schellens JHM: Interazioni tra farmaci in oncologia. Lancet Oncol. 2004 agosto; 5(8): 489-496.
- Van Meerten E, Verweij J, Schellens JHM: Agenti antineoplastici: interazioni farmacologiche di rilevanza clinica. Sicurezza dei farmaci 1995; 12: 168-182.
- Gassmann D, et al: Insufficienza dell’allotrapianto di fegato dopo il trattamento con Nivolumab – un caso clinico con ricerca sistematica della letteratura. Trapianto diretto. 2018 Jul 20;4(8): e376.
- Weiler S, et al. Suggerimenti per la pratica: interazioni avverse ai farmaci clinicamente rilevanti. Switzerland Med Forum 2015. 15: 152-156.
InFo ONcOLOGIA & EMATOLOGIA 2019; 7(2-3): 5-10.