Quali benefici possono aspettarsi i pazienti con sclerosi multipla recidivante-remittente (RMS) dal trattamento di prima linea con ofatumumab (KESIMPTA®)? La risposta a questa domanda è stata fornita da un’analisi di sottogruppo dei dati dei pazienti naïve al trattamento dei due studi ASCLEPIOS. Qui è stato dimostrato che i pazienti che assumevano ofatumumab avevano un’attività di malattia più bassa e una progressione più lenta rispetto a teriflunomide. La tollerabilità è stata paragonabile a quella dell’intera popolazione dello studio e l’aderenza è stata di conseguenza elevata.
Sempre più dati suggeriscono che l’uso precoce di una terapia ad alta efficacia (TOS) ha un impatto più positivo sulla progressione della malattia, rispetto all’iniziare con un’opzione moderatamente efficace e all’intensificare la terapia quando la malattia peggiora. Per esempio, un’analisi di 592 pazienti britannici ha rilevato che l’uso precoce della TOS ha portato a risultati migliori in termini di tasso di ricaduta annuale, punteggio EDSS (Expanded Disability Status Scale) e accumulo di disabilità sostenuta per un periodo di cinque anni, rispetto alla terapia di escalation.1 Gli anticorpi monoclonali sono stati considerati come TOS, a tutte le altre terapie modificanti la malattia è stata assegnata un’efficacia moderata. Inoltre, in un’analisi retrospettiva, 213 pazienti con TOS precoce (iniziata entro 2 anni dall’esordio della malattia) sono state confrontate con un gruppo corrispondente di 253 pazienti che hanno iniziato la TOS solo da 4 a 6 anni dopo l’esordio della malattia.2 Questo ha mostrato che le pazienti che hanno iniziato precocemente la TOS avevano un punteggio EDSS medio significativamente più basso dopo 6-10 anni rispetto alle pazienti che hanno iniziato la TOS più tardi (2,3 vs. 3,5 dopo 10 anni; p < 0,0001). Tuttavia, queste opzioni precoci dovrebbero anche avere un buon profilo di sicurezza e non appesantire i pazienti e la loro aderenza con frequenti appuntamenti per il trattamento e il follow-up e con qualsiasi pre-trattamento necessario.
ASCLEPIOS I e II: analisi di sottogruppo dei pazienti naïve alla terapia
L’anticorpo anti-CD20 completamente umano ofatumumab è una nuova opzione altamente efficace per il trattamento di prima linea dell’RMS.3,4 L’efficacia e la sicurezza di ofatumumab nel trattamento dei pazienti con RMS sono state analizzate in due studi multicentrici, in doppio cieco, attivi, controllati, a doppia manica e a gruppi paralleli, progettati in modo identico, ASCLEPIOS I (n = 927) e ASCLEPIOS II (n = 955).5 Teriflunomide è stato scelto come comparatore. I pazienti inclusi nel braccio ofatumumab hanno ricevuto una dose iniziale di 20 mg di ofatumumab per via sottocutanea (s.c.) nei giorni 0, 7 e 14, seguita da una dose mensile di mantenimento (sempre di 20 mg) e da placebo per via orale. La terapia di mantenimento potrebbe essere applicata dai pazienti stessi a casa. Il gruppo di confronto è stato trattato con 14 mg di teriflunomide al giorno e placebo s.c.. La durata dello studio era flessibile ed era di un massimo di 30 mesi.
In un’analisi di sottogruppo, il profilo beneficio-rischio del trattamento con ofatumumab è stato studiato nei pazienti con malattia in fase iniziale (≤ 3 anni dalla diagnosi).6 Si tratta di circa un terzo della popolazione totale di ASCLEPIOS (314 pazienti con ofatumumab, 301 pazienti con teriflunomide). L’età mediana di questi pazienti era di 36 anni e il tempo mediano dalla diagnosi era di 0,35 anni.
Pazienti naïve alla terapia: I risultati sono coerenti con la popolazione totale di ASCLEPIOS.
L’analisi dei dati dei pazienti naïve al trattamento ha mostrato che il trattamento con ofatumumab ha portato a una riduzione significativa del tasso di ricaduta annualizzato (ARR) del 50,3% rispetto alla teriflu- nomide (p < 0,001).6 Inoltre, il peggioramento confermato della disabilità (CDW) nell’arco di 6 mesi è stato ridotto del 46% con ofatumumab rispetto a teriflunomide (p=0,044). Questo risultato, così come quello della CDW a 3 mesi (riduzione del rischio del 38%; p=0,065), era coerente con quello della popolazione generale. L’analisi di vari parametri di imaging ha confermato la superiorità di ofatumumab (Fig. 1). Quindi, il numero di lesioni T1 positive al gadolinio (Gd) per scansione è stato ridotto significativamente del 95,4% da ofatumumab rispetto a teriflunomide (p <0,001). Anche il numero di lesioni T2 nuove/ingrandenti è diminuito significativamente dell’82,0% all’anno (p < 0,001). Nel secondo anno di trattamento, è stata osservata una riduzione del 97,1% delle lesioni T2 con ofatumumab rispetto a teriflunomide (p < 0,001).
 Fig. 1. ofatumumab ha ottenuto risultati significativamente migliori nei pazienti con SM naïve alla terapia rispetto a teriflunomide in vari parametri di imaging.6
Fig. 1. ofatumumab ha ottenuto risultati significativamente migliori nei pazienti con SM naïve alla terapia rispetto a teriflunomide in vari parametri di imaging.6
Uno degli obiettivi di un trattamento di successo della SM è il NEDA (Nessuna evidenza di attività della malattia).7 Il NEDA-3 è definito dall’assenza di ricadute (1), di progressione della disabilità (2) e di attività radiologica (3). Come si è visto, la possibilità di raggiungere il NEDA-3 con il trattamento con ofatumumab era più di 3 volte superiore a quella con teriflunomide nel primo anno di trattamento e addirittura più di 14 volte superiore nel secondo anno di trattamento per i pazienti naïve al trattamento nei due studi ASCLEPIOS (Fig. 2).6
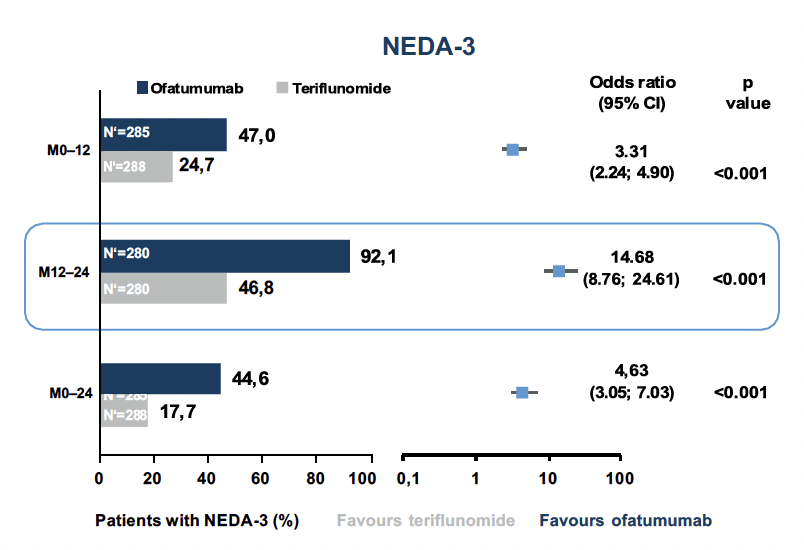 Fig. 2 La possibilità di raggiungere la NEDA-3 era significativamente più alta con ofatumumab che con teriflunomide.6
Fig. 2 La possibilità di raggiungere la NEDA-3 era significativamente più alta con ofatumumab che con teriflunomide.6
Profilo di effetti collaterali favorevole
L’analisi degli effetti collaterali ha chiarito che la buona efficacia di ofatumumab non va a scapito della tollerabilità. Nella popolazione complessiva dei due studi ASCLEPIOS, gli eventi avversi si sono verificati nell’83,6% dei pazienti che hanno ricevuto ofatumumab e nell’84,2% dei pazienti che hanno ricevuto teriflunomide.5 Gli eventi gravi sono stati registrati nel 9,1% e nel 7,9% dei pazienti, rispettivamente. Le reazioni associate all’iniezione sono state le più comuni. Si sono verificati nel 20,2% dei pazienti nel gruppo ofatumumab e nel 15,0% dei pazienti nel gruppo teriflunomide. Le reazioni sistemiche all’iniezione sono state lievi o moderate in oltre il 99% dei casi. Si sono verificati soprattutto dopo la prima iniezione e sono diminuiti in modo significativo con le applicazioni successive. Le infezioni sono state registrate nel 51,6% dei pazienti trattati con Ofa- tumumab e nel 52,7% dei pazienti trattati con teriflunomide. Le più comuni sono state la na- sofaringite (18% di ofatumumab, 16,7% di teriflunomide), le infezioni del tratto respiratorio superiore (10,3% vs. 12,8%) e le infezioni del tratto urinario (10,3% vs. 8,3%).
L’analisi del gruppo di pazienti naïve al trattamento ha mostrato un’incidenza equilibrata di eventi avversi tra i due gruppi di trattamento.6 Il tasso di eventi avversi gravi è stato inferiore nel gruppo naïve al trattamento rispetto alla popolazione generale, ma è rimasto paragonabile tra i gruppi di ofatumumab e teriflunomide. Non sono stati registrati casi di infezioni opportunistiche come la PML (leucoencefalopatia multifocale progressiva) o la riattivazione dell’epatite B. L’aderenza a ofatumumab nei pazienti trattati è stata elevata, pari al 98,8% e quasi identica all’aderenza nella popolazione complessiva di ASCLEPIOS (98,3%).
Conclusione
Sempre più dati suggeriscono che l’uso precoce di una terapia altamente efficace ha un impatto più positivo sul decorso della malattia rispetto all’escalation della terapia quando la malattia peggiora. Tuttavia, le terapie altamente efficaci sono spesso associate a un profilo di sicurezza limitato. Come hanno dimostrato i due studi ASCLEPIOS, ofatumumab si è dimostrato altamente efficace non solo nella popolazione generale, ma soprattutto nei pazienti non trattati in precedenza e in una fase iniziale della malattia. Inoltre, il profilo degli effetti collaterali nei pazienti naïve alla terapia era comparabilmente favorevole come nei pazienti già pretrattati. Dopo aver iniziato la terapia sotto la supervisione del medico curante, i pazienti possono facilmente autosomministrarsi KESIMPTA® (ofatumumab), una volta al mese con una penna autoiniettore sottocutanea. Inoltre, durante l’applicazione non è necessaria alcuna premedicazione, nessuna degenza ospedaliera e nessuna fase di osservazione successiva. L’aderenza dei pazienti naïve al trattamento e della popolazione totale è stata superiore al 95% negli studi ASCLEPIOS.
Questo articolo è stato prodotto da Novartis Pharma Schweiz AG, Suurstoffi 14, 6343 Rotkreuz, Svizzera.
NO55104/04.2021