In passato, il dolore neuropatico veniva classificato in base all’eziologia sottostante. Tuttavia, data l’eterogeneità dei meccanismi del dolore, altri schemi di classificazione potrebbero essere più appropriati. In questo caso, il profilo somatosensoriale individuale può fornire alcuni indizi sui disturbi fisiopatologici dell’elaborazione afferente. Inoltre, i sintomi riferiti dal paziente possono anche descrivere le qualità sensoriali.
I pazienti con dolore neuropatico sono eterogenei in termini di eziologia, fisiopatologia e presentazione clinica. Presentano una varietà di sintomi e segni sensoriali legati al dolore, il cosiddetto profilo sensoriale. Profili sensoriali diversi possono indicare classi diverse di meccanismi neurobiologici, per cui i sottogruppi con profili sensoriali diversi possono rispondere in modo diverso al trattamento.
Principio d’ordine basato sul meccanismo e sui profili sensoriali
Utilizzando metodi statistici privi di ipotesi nel database di tre reti di ricerca multinazionali (German Neuropathic Pain Research Network (DFNS), IMI-Europain e Neuropain), uno studio ha analizzato l’identificazione di sottogruppi in un ampio campione di pazienti con dolore neuropatico. I test sensoriali quantitativi standardizzati sono stati eseguiti in 902 (coorte di test) e 233 (coorte di validazione) pazienti con dolore neuropatico periferico di diversa eziologia. Per formare i sottogruppi, è stata effettuata un’analisi dei cluster utilizzando 13 parametri quantitativi del test sensoriale. Sono stati identificati e replicati tre diversi sottogruppi con profili sensoriali caratteristici [2].
Il cluster 1 (perdita sensoriale, 42%) è stato caratterizzato dalla perdita della funzione delle fibre piccole e grandi e dalla presenza della sensazione di calore paradossale (PHS). Questi pazienti non hanno sofferto di potenziamento sensoriale, ad eccezione di una lieve allodinia meccanica dinamica (DMA) in alcuni pazienti. Circa il 52% dei pazienti con polineuropatie rientrava in questa categoria, indicando una degenerazione in diminuzione di quasi tutte le classi di fibre. È interessante notare che il 43% dei pazienti con radicolopatia dolorosa (RAD) presentava questo schema sensoriale, indicando una grave degenerazione delle fibre sensoriali all’interno della radice nervosa interessata. Le sensazioni di calore paradossali sono state le più comuni, suggerendo che sono innescate da una perdita di input afferente, anche se apparentemente un segno sensoriale positivo, forse legato a un processo di disinibizione centrale. Il profilo sensoriale è simile a quello di un blocco nervoso compressivo. Probabilmente rappresenta i sottogruppi di “deafferentazione” o “ipoestesia dolorosa” descritti da altri. Il dolore spontaneo è probabilmente dovuto a potenziali d’azione ectopici generati nei siti prossimali dei nocicettori lesi, ad esempio nel ganglio della radice dorsale o nei neuroni nocicettivi centrali deafferenti [2].
Il cluster 2 era caratterizzato da funzioni sensoriali relativamente conservate delle fibre grandi e piccole, in combinazione con iperalgesia da caldo e freddo e DMA di bassa intensità. Questo modello (iperalgesia termica) si è verificato nel 33% di tutti i pazienti con dolore neuropatico periferico, indipendentemente dall’eziologia. Il fatto che la funzione sensoriale cutanea fosse relativamente ben conservata in un terzo di tutti i pazienti, nonostante il danno nervoso documentato, suggerisce che il dolore neuropatico periferico può essere associato a un’efficace rigenerazione cutanea e a nocicettori sensibilizzati. Il profilo sensoriale assomiglia a quello di una lesione da ustione da UV-B ed è probabilmente dovuto alla sensibilizzazione periferica. Rappresenta i sottogruppi di “nocicettori irritabili” descritti da altri. I nocicettori sensibilizzati sono associati a una sovraespressione di canali e recettori che portano a scariche spontanee patologiche e a un abbassamento della soglia di attivazione per gli stimoli termici (calore e freddo) e meccanici. L’iperattività persistente dei nocicettori superstiti può essere responsabile del dolore persistente e può portare a una certa sensibilizzazione centrale nel corno del midollo spinale, in modo che gli stimoli tattili trasmessi attraverso le fibre A possano attivare i neuroni nocicettivi centrali. Di conseguenza, gli stimoli meccanici inducono una maggiore percezione del dolore, cioè iperalgesia da puntura di spillo e DMA. Poiché questi tipi di iperalgesia meccanica si sono verificati solo in circa il 20% dei pazienti, la spinta dei nocicettori periferici ovviamente non induce sempre una sensibilizzazione centrale [2].
Il cluster 3 (iperalgesia meccanica, 24%) è stato caratterizzato da una perdita predominante di piccole fibre sensibili al freddo e al calore, in combinazione con iperalgesia da pressione smussata, iperalgesia da puntura di spillo e DMA marcata e più frequente. La qualità del dolore bruciante era più pronunciata in questo gruppo rispetto agli altri gruppi, il che è coerente con i risultati nella sindrome di Guillain-Barré, dove il dolore bruciante era associato a deficit di piccole fibre, e con il concetto di calore sintetico piuttosto che di sensibilizzazione periferica al calore. Il profilo era più comune nei pazienti con nevralgia post-erpetica (PHN) (47%). Assomiglia al profilo suscitato dalla stimolazione elettrica ad alta frequenza della pelle in grado di indurre il potenziamento spinale a lungo termine e probabilmente corrisponde ai sottogruppi di “iperalgesia neurogenica” o “sensibilizzazione centrale” descritti da altri. La sensibilizzazione centrale è pronunciata con gli stimoli meccanici, ma non con quelli termici. La dissociazione dell’iperalgesia termica e meccanica può essere spiegata dalle differenze nella segnalazione neuronale del dolore termico e meccanico, che inizia con la codifica periferica in diverse sottopopolazioni di nocicettori. Il dolore persistente in questo sottogruppo indica ancora una volta un’attività spontanea del sistema nocicettivo, che può avere origine nel sistema nervoso periferico e/o centrale [2].
Trattamento basato sul profilo – i sottogruppi rispondono meglio!
Sulla base di questo algoritmo, i pazienti sono stati classificati in base a cluster simili in ulteriori studi clinici e testati per la diversa efficacia del farmaco in un’analisi secondaria pianificata. Per esempio, uno studio proof-of-concept randomizzato, controllato con placebo, ha valutato la sicurezza e l’efficacia della somministrazione per 28 giorni di ISC 17536, un nuovo inibitore, disponibile per via orale, del recettore del dolore ampiamente utilizzato. Potenziale recettore transitorio Ankyrin 1, che media la segnalazione nocicettiva nelle piccole fibre nervose periferiche, è stato studiato in 138 pazienti con neuropatia periferica diabetica cronica e dolorosa, utilizzando test sensoriali quantitativi per caratterizzare il fenotipo di base dei pazienti. L’endpoint primario era la variazione del punteggio medio di intensità del dolore nelle 24 ore, basato su una scala numerica di valutazione dell’intensità del dolore a 11 voci, dal basale alla fine del trattamento. Nello studio, l’endpoint primario non è stato raggiunto nell’intera popolazione di pazienti. Tuttavia, in una sottopopolazione esplorativa e generatrice di ipotesi di pazienti con funzione conservata delle piccole fibre nervose, definita dal test sensoriale quantitativo, è stato riscontrato un miglioramento statisticamente significativo e clinicamente significativo del dolore con ISC 17536 [3].
Un altro studio randomizzato, in doppio cieco, controllato con placebo e fenotipicamente stratificato ha analizzato l’efficacia dell’oxcarbazepina (1800-2400 mg) e del placebo in due periodi di trattamento di 6 settimane. La misura di efficacia primaria era la variazione dell’intensità del dolore mediano tra il basale e l’ultima settimana di trattamento, misurata su una scala di valutazione numerica a 11 punti, e l’obiettivo primario era quello di confrontare l’effetto dell’oxcarbazepina nei pazienti con e senza un fenotipo di nocicettore irritabile, definito da ipersensibilità e funzione conservata delle piccole fibre nervose, come determinato da test sensoriali quantitativi dettagliati. Sono stati randomizzati 97 pazienti con dolore neuropatico periferico dovuto a polineuropatia, lesione nervosa chirurgica o traumatica o nevralgia post-erpetica. La popolazione intention-to-treat comprendeva 83 pazienti: 31 con il fenotipo irritabile e 52 con il fenotipo non irritabile dei nocicettori. Nel campione totale, l’oxcarbazepina ha alleviato il dolore di 0,7 punti (su una scala di valutazione numerica da 0 a 10; intervallo di confidenza al 95% [CI] 0,4-1,4) in più rispetto al placebo (p=0,015), e c’è stata un’interazione significativa tra trattamento e fenotipo di 0,7 (95% CI 0,01-1,4, p=0,047). Il numero di pazienti che hanno richiesto un trattamento per ottenere un sollievo dal dolore superiore al 50% è stato di 6,9 (95% CI 4,2-22) nel campione totale, 3,9 (95% CI 2,3-12) nel gruppo irritabile e 13 (95% CI 5,3-∞) nel gruppo dei nocicettori non irritabili. I risultati mostrano che l’oxcarbazepina è più efficace nell’alleviare il dolore neuropatico periferico nei pazienti con fenotipo nocicettore irritabile rispetto a quello non irritabile [4].
Un altro studio ha utilizzato modelli di misure ripetute a effetti misti per valutare l’efficacia di pregabalin rispetto al placebo in sottogruppi con fenotipi di dolore indotto (cioè iperalgesia o allodinia), utilizzando i dati di un recente studio clinico randomizzato multinazionale (n=539) in cui i sottogruppi fenotipici sono stati identificati attraverso l’uso di un esame clinico strutturato. La differenza nel punteggio medio del dolore tra il gruppo attivo e il gruppo placebo (cioè il delta) dopo 15 settimane di trattamento era di -0,76 (p=0,001) per il sottogruppo con iperalgesia, rispetto a 0,19 (p=0,47) per il sottogruppo che non presentava iperalgesia. L’interazione tra trattamento e fenotipo, che verifica se i sottogruppi rispondono in modo statisticamente diverso al trattamento, era significativa (p=0,0067). Il delta per il sottogruppo con allodinia era di -0,31 (p=0,22), rispetto a -0,30 (p=0,22) per il sottogruppo senza allodinia (interazione trattamento-fenotipo p=0,98). Questi risultati suggeriscono che l’iperalgesia, ma non l’allodinia, predice la risposta al pregabalin nei pazienti con dolore neuropatico cronico post-traumatico [5].
Il sottogruppo identifica i rispondenti
In questi e altri studi sul dolore neuropatico, il profilo sensoriale QST* è stato utilizzato per identificare i predittori della risposta al trattamento che possono essere provvisoriamente assegnati ai tre cluster. Per esempio, i pazienti con un profilo di esito QST che assomiglia al cluster 2 (“iperalgesia da calore”) hanno mostrato una maggiore efficacia in uno studio prospettico, randomizzato e controllato con placebo di oxcarbazepina, in un’analisi pre-pianificata di uno studio controllato con placebo di tossina botulinica e in un’analisi retrospettiva di uno studio di cerotti di capsaicina topica senza un braccio placebo. Un’analisi retrospettiva di uno studio controllato con placebo con lidocaina topica ha mostrato una minore efficacia. I pazienti con un profilo di esito QST che assomiglia al cluster 1 (“perdita sensoriale”) hanno avuto una maggiore efficacia in un’analisi retrospettiva di uno studio controllato con placebo sugli oppioidi orali. Uno studio prospettico randomizzato controllato con placebo di oxcarbazepina ha mostrato una minore efficacia. I pazienti con un profilo di esito QST simile al cluster 3 (“iperalgesia meccanica”) hanno mostrato una maggiore efficacia nelle analisi retrospettive degli studi controllati con placebo con pregabalin orale, lidocaina topica, lamotrigina o lidocaina endovenosa.
* QST=protocollo standardizzato per il test sensoriale quantitativo
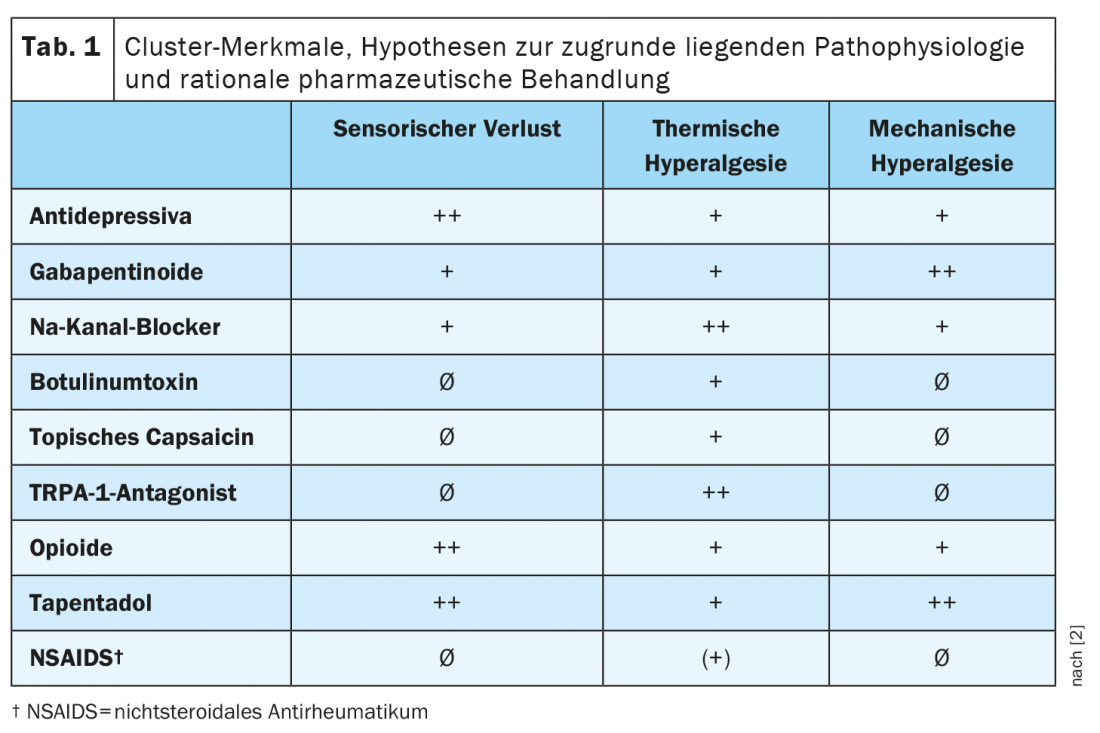
I diversi profili farmacologici sottolineano la rilevanza clinica dei cluster. Una previsione dell’efficacia differenziale dei principali farmaci per il dolore neuropatico nei diversi cluster è riassunta nella Tabella 1 [2]. Il Prof. Dr. Ralf Baron, Responsabile della Sezione Ricerca e Terapia del Dolore Neurologico presso l’Ospedale Universitario Schleswig-Holstein di Kiel, sottolinea a questo punto che l’entità della differenza di risposta al trattamento tra i cluster deve ancora essere dimostrata in futuri studi prospettici, tuttavia [1].
Sintomi sensoriali rilevati dai risultati riferiti dal paziente (PRO)
Oltre al profilo sensoriale QST, esistono anche sintomi riferiti dal paziente che descrivono le qualità sensoriali. Un risultato riferito dal paziente (PRO) descrive le informazioni valutate e riferite direttamente dalla persona su come si sente in merito alla sua salute o al suo trattamento, o al suo funzionamento, senza interpretazioni o modifiche da parte di altri, compresi i medici e i ricercatori. Per i pazienti affetti da dolore neuropatico o cronico, esistono alcuni questionari convalidati che chiedono specificamente i diversi sintomi sensoriali (Tabella 2) [6–8].
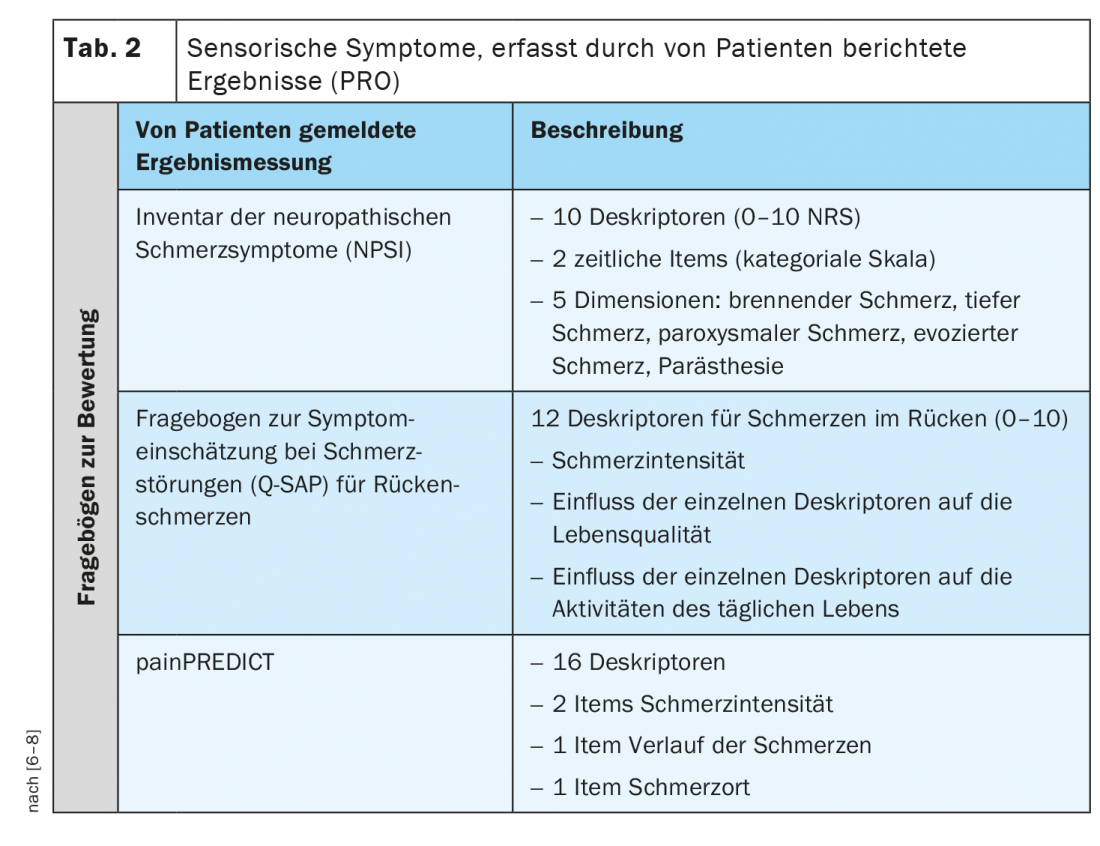
Il Neuropathic Pain Symptom Inventory (NPSI), per esempio, è un auto-questionario specificamente progettato per valutare i vari sintomi del dolore neuropatico. La versione finale dell’NPSI comprende dieci descrittori (più due voci temporali) che consentono la discriminazione e la quantificazione di cinque diverse dimensioni clinicamente rilevanti delle sindromi di dolore neuropatico che sono sensibili al trattamento. Le proprietà psicometriche dell’NPSI suggeriscono che potrebbe essere utilizzato per caratterizzare sottogruppi di pazienti con dolore neuropatico e per verificare se rispondono in modo diverso a diversi agenti farmacologici o ad altri interventi terapeutici [6].
Il Q-SAP è un auto-questionario specifico che registra i classici sintomi del dolore nocicettivo e neuropatico dei pazienti con lombalgia cronica in relazione alla loro distribuzione locale. Inoltre, il questionario cattura l’intensità di questi sintomi e il loro impatto sulla qualità della vita e sulla funzionalità e può essere utilizzato per valutare il trattamento. L’auto-questionario è composto da due parti (per i sintomi della schiena e, se applicabile, delle gambe) ed è stato testato su 152 pazienti con dolore lombare cronico con e senza radicolopatia. A differenza di altri questionari, il Q-SAP Back/Leg valuta non solo l’intensità dei sintomi, ma anche il loro impatto sulla qualità di vita e sulla funzionalità del paziente. Inoltre, questo questionario chiede i sintomi in base alla loro distribuzione anatomica [7].
painPREDICT è un questionario che utilizza un’ampia gamma di descrittori riferiti dal paziente che possono essere associati ai meccanismi del dolore neuropatico e nocicettivo e per esaminare i modelli dei sintomi sensoriali. Il questionario finale comprendeva 20 voci che coprivano i seguenti domini: Intensità del dolore, localizzazione del dolore, progressione del dolore e sintomi sensoriali. Il clustering ibrido dei dati del nuovo questionario ha rivelato tre diversi profili di sintomi sensoriali caratteristici nei pazienti con dolore neuropatico (NeP): “Nocicettori irritabili”, “Dolore da deafferentazione” e “Attacchi di dolore con componente nocicettiva”. Sebbene siano state riscontrate alcune differenze nella distribuzione dei profili sensoriali, tutti i profili erano rappresentati in tutti i gruppi di eziologia NeP [8].
Messaggi da portare a casa
- Esistono sottogruppi meccanici nei pazienti con dolore
- Alcuni sottogruppi rispondono particolarmente bene agli oppioidi
- Gli strumenti di valutazione sono:
– Profili sensoriali QST
– Profili PRO-sensoriali
Congresso: Congresso tedesco sul dolore 2022
Letteratura:
- Prof. Dr. Ralf Baron: Valutazione del dolore – la base per una terapia individuale. Congresso tedesco sul dolore 2022, Simposio dell’industria; 21.10.2022.
- Baron R, et al: Dolore neuropatico periferico: un principio organizzativo legato al meccanismo e basato sui profili sensoriali. Pain 2017; doi: 10.1097/j.pain.0000000000000753.
- Jain M, et al: Studio randomizzato, in doppio cieco, controllato con placebo di ISC 17536, un inibitore orale del potenziale recettore transiente ankyrin 1, in pazienti con neuropatia periferica diabetica dolorosa: impatto della funzione conservata delle piccole fibre nervose. Pain 2022; doi: 10.1097/j.pain.0000000000002470.
- Demant DT, et al: L’effetto dell’oxcarbazepina nel dolore neuropatico periferico dipende dal fenotipo del dolore: uno studio randomizzato, in doppio cieco, controllato con placebo e stratificato per fenotipo. Pain 2014; doi: https://doi.org/10.1016/j.pain.2014.08.014.
- Gewandter JS, et al: Previsione della risposta al trattamento con la fenotipizzazione sensoriale nel dolore neuropatico post-traumatico. Pain 2022; doi: 10.1093/pm/pnac045.
- Bouhassira D, et al: Sviluppo e validazione del Neuropathic Pain Symptom Inventory. Pain 2004; doi: 10.1016/j.pain.2003.12.024.
- Otto JC, et al: Validazione del Questionario per la valutazione dei sintomi nei disturbi del dolore per i pazienti affetti da mal di schiena (Q-SAP). Eur J Pain 2020; doi: 10.1002/ejp.1690.
- Tölle TR, et al: painPREDICT: primi dati provvisori dallo sviluppo di un nuovo questionario sul dolore riferito dal paziente per prevedere la risposta al trattamento utilizzando i profili dei sintomi sensoriali. Curr Med Res Opin 2019; doi: 10.1080/03007995.2018.1562687.











