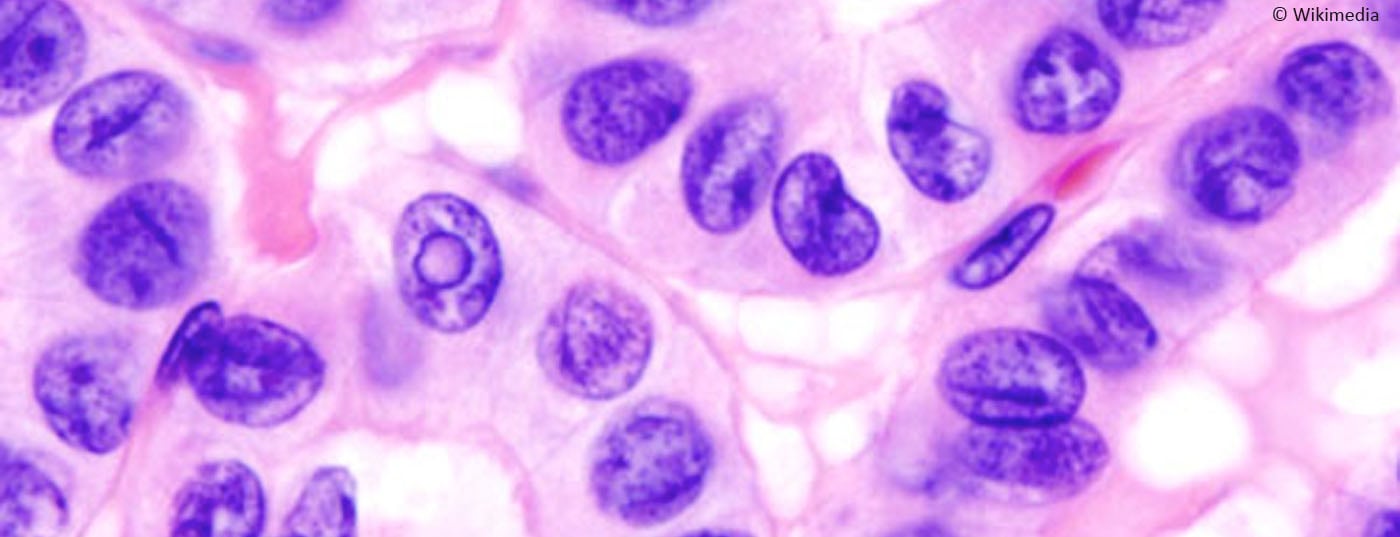
I noduli tiroidei sono un fenomeno ben noto, il carcinoma midollare della tiroide fortunatamente no. Si tratta di una degenerazione maligna delle cellule C della ghiandola tiroidea, che si trovano a livello parafollicolare e non possono immagazzinare lo iodio. Poiché secerne calcitonina, questa può essere utilizzata come marcatore tumorale.
I noduli tiroidei sono frequentemente diagnosticati nella pratica, ma fortunatamente il carcinoma midollare della tiroide viene diagnosticato raramente. Solo il 3% circa di tutti i carcinomi tiroidei riguarda il carcinoma midollare della tiroide (MTC), che presenta alcune caratteristiche particolari: Si tratta di una degenerazione maligna delle cellule C della ghiandola tiroidea, che si trovano a livello parafollicolare e non sono in grado di immagazzinare lo iodio; secerne calcitonina (Ctn) e CEA, che vengono utilizzati come marcatori tumorali; un quarto dei casi si verifica a livello familiare nel contesto della neoplasia endocrina multipla di tipo 2 (MEN2). L’unica opzione per una possibile cura dell’MTC è la diagnosi precoce e un intervento chirurgico adeguato. Ciò è reso possibile dall’uso coerente della determinazione della Ctn nella chiarificazione dello struma nodoso e nella variante familiare del test genetico molecolare del protooncogene RET come parte dello screening familiare. Anche in coloro che non guariscono, l’MTC ha una prognosi relativamente favorevole, con una qualità di vita relativamente buona grazie alla sua crescita lenta. Una strategia di follow-up di “sorveglianza attiva” adattata al rischio è possibile in molti casi. L’MTC allo stadio di metastasi a distanza sintomatica e progressiva può oggi essere trattato con gli inibitori della tirosin-chinasi (TKI) [1,2].
Clinica e diagnostica del carcinoma midollare della tiroide (MTC)
Clinicamente, l’MTC midollare non differisce in modo significativo dagli altri carcinomi tiroidei: nodulo in crescita nella tiroide, disturbi non specifici nel collo, sviluppo di gonfiore dei linfonodi cervicali e nello stadio metastatico avanzato, può verificarsi una diarrea pronunciata indotta dal tumore. Oggi, la MTC viene diagnosticata come reperto incidentale nell’istologia di un campione di chirurgia tiroidea o durante l’esame preoperatorio come parte del work-up di un nodulo tiroideo. (Fig.1). Gli indicatori sono un nodulo sospetto all’ecografia tiroidea (eco-povero, microcalcificazioni, margini sfumati, estensione più profonda che ampia), linfonodi cervicali sospetti, un ago aspirato sospetto e un livello elevato di Ctn. Un livello di Ctn superiore a 100 pg/ml è il risultato più sensibile e specifico. Sono colpiti i pazienti della 4. e 5° decennio di vita. Nei pazienti più giovani, deve essere presa in considerazione la variante familiare (MEN2), che può occasionalmente manifestarsi attraverso condizioni concomitanti come il feocromocitoma e l’iperparatiroidismo primario. Il raro MTC deve essere considerato anche nel contesto del chiarimento di un innalzamento del CEA.
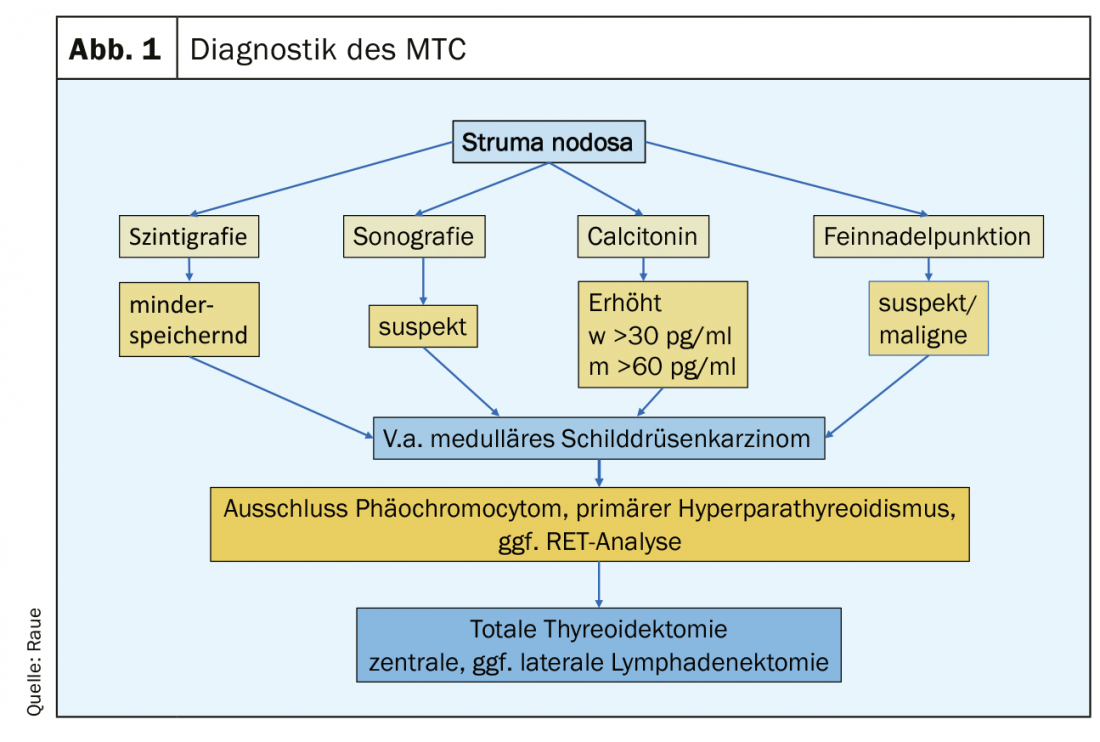
Screening della calcitonina nella chiarificazione dello struma nodoso
La Ctn è correlata alla massa tumorale ed è un marcatore tumorale sensibile e specifico per la diagnosi precoce e il follow-up dell’MTC. La determinazione di routine della Ctn nel work-up dello struma nodoso rende possibile una diagnosi precoce [3]. Livelli leggermente elevati di Ctn si riscontrano nell’iperplasia delle cellule C, che può essere un precursore della MTC ereditaria, ma si osserva anche come fenomeno concomitante “benigno” in altre malattie della tiroide [4]. Con lo sviluppo di nuovi test di misurazione sensibili e specifici completamente automatizzati per la Ctn (immunodosaggi chemiluminescenti con una sensibilità di 0,5 pg/ml e valori di riferimento superiori specifici per il sesso) [5,6], i livelli basali di Ctn sono diventati più importanti per lo screening nello struma nodosa.
Con livelli di Ctn preoperatori superiori a 100 pg/ml, l’MTC è presente in quasi il 100% dei casi, mentre con livelli di Ctn compresi tra 10-20 pg/ml, il tasso di riscontro di MTC è inferiore al 5% [7]. Tenendo conto della sensibilità e della specificità, i valori di cut-off del Ctn basale specifici per sesso per la raccomandazione di intervento chirurgico di un sospetto MTC risultano essere circa 30 pg/ml per le donne e circa 60 pg/ml per gli uomini. La gamma grigia di Ctn per le donne è 20-30 pg/ml, per gli uomini 30-60 pg/ml, in cui il 6-13% di piccoli MTC sono stati mancati [8]. L’aumento dei livelli di Ctn è più indicativo di un MTC, nel qual caso si consiglia un intervento chirurgico. Le misure chirurgiche possono curare l’MTC in quasi il 100% fino a un livello di Ctn di 100 pg/ml [9].
Mutazioni germinali del protooncogene RET nella MEN2
In circa il 25% dei pazienti con MTC, può essere rilevata una mutazione germinale nel protooncogene RET come indicazione della sindrome MEN2. Clinicamente, la MEN2A con il possibile sviluppo di un feocromocitoma e di iperparatiroidismo si distingue dalla MEN2B con un habitus tipico, una gangloneuromatosi delle membrane mucose e il possibile sviluppo di un feocromocitoma. Non tutte le famiglie possono essere catturate da un’anamnesi familiare, perché spesso le famiglie sono piccole o si tratta di una hMTC a manifestazione tardiva con una bassa penetranza. In una piccola percentuale, si osserva una mutazione “de novo” nel paziente, mentre gli altri membri della famiglia non sono affetti. In un’ampia serie, una mutazione germinale nel protooncogene RET è stata trovata nel 12% degli MTC apparentemente sporadici. Pertanto, il test genetico molecolare per le mutazioni germinali del gene RET dovrebbe essere richiesto a tutti i pazienti con MTC.
Nella forma ereditaria di MTC, le mutazioni causali sono caratterizzate in quasi tutte le famiglie, per lo più mutazioni puntiformi in 8 esoni diversi del protooncogene RET. L’individuazione genetica molecolare di queste mutazioni, insieme alla determinazione della Ctn nelle famiglie dei bambini e degli adolescenti affetti, consente una tiroidectomia precoce con cura della MTC. La tempistica ottimale della tiroidectomia nei portatori genici di una mutazione RET è oggi raccomandata in base alla classificazione del rischio della specifica mutazione RET in rischio moderato, alto e massimo per lo sviluppo precoce di MTC (penetranza precoce o tardiva) (Tab. 1) [1]. Il livello di Ctn definisce individualmente la tiroidectomia profilattica da pianificare in una fase precoce, in modo che nel caso ottimale non sia necessaria un’ulteriore linfoadenectomia.

Fino al 50% dei pazienti con MEN2 sviluppa feocromocitomi nel corso della vita, a seconda del genotipo, soprattutto dopo la manifestazione della MTC. I feocromocitomi possono essere multifocali e bilaterali [10]. Sono particolarmente colpiti i pazienti con mutazioni RET-634 e -918, meno frequentemente con mutazioni negli esoni 13-15. Fino al 10% dei pazienti con MEN2 può sviluppare un iperparatiroidismo primario, a seconda del genotipo; i pazienti con una mutazione RET-918 non ne sono affetti. Altre manifestazioni extratiroidee, come la ganglioneuromatosi nella MEN2B o la lichen amyloidosis interscapolare, sono anch’esse dipendenti dal genotipo.
Nel tessuto tumorale dell’MTC sporadico, è frequentemente rilevabile una mutazione somatica nel gene RET, per lo più RET-M918T, interessantemente meno frequente nei tumori più piccoli, più frequente in quelli più grandi e più frequentemente nelle filiazioni linfonodali e nelle metastasi a distanza, suggerendo che questa mutazione non è l’evento primario nella tumorigenesi. Nel tessuto tumorale in cui non si trova alcuna mutazione RET, il rilevamento di una mutazione RAS ha spesso successo. Il rilevamento della mutazione somatica RET ha un significato prognostico ed è un prerequisito per la terapia con gli inibitori selettivi della tirosin-chinasi RET (LOXO-292, BLU-667) che probabilmente saranno presto disponibili [11].
Funzionamento dell’MTC
La terapia primaria per l’MTC è chirurgica. La tiroidectomia totale è la procedura minima, integrata dalla dissezione linfonodale centrale e, se necessario, laterale unilaterale/bilaterale (LK), a seconda del Ctn misurato preoperatoriamente e dello stadio tumorale. Nel caso di un MTC scoperto per caso nell’istologia, il livello di Ctn postoperatorio deve decidere l’ulteriore procedura; se il Ctn non è misurabilmente basso, non è necessario un ulteriore intervento chirurgico; se il Ctn è elevato, a seconda dello stadio del tumore, si deve eseguire un’operazione completa (TX totale e dissezione LK centrale e laterale). La terapia chirurgica curativa è possibile solo se nell’istologia primaria non sono state descritte metastasi a distanza, né infiltrazioni nei tessuti molli e se nell’istologia precedente sono rilevabili meno di 5-10 LK cervicali colpiti o meno di 3 compartimenti colpiti dopo una linfoadenectomia sistematica [12]. Se è presente questa situazione favorevole, si deve tentare una terapia chirurgica curativa. Nel caso di una MTC ereditaria, la tiroidectomia totale è appropriata in ogni caso, poiché in linea di principio una MTC può svilupparsi da ogni cellula C. Il 70% dei casi di MTC diagnosticati attraverso un nodulo tiroideo palpabile ha già metastasi ai linfonodi cervicali e il 13% ha metastasi a distanza al fegato, ai polmoni o all’osso [13]. La sopravvivenza a 10 anni è di circa il 61-81% [14], a seconda dello stadio del tumore al momento della diagnosi, dell’età, del sesso, dei livelli di Ctn pre- e post-operatori. Nell’ultimo decennio, grazie a una diagnosi sempre più precoce, a stadi tumorali più favorevoli e a strategie chirurgiche migliorate, la sopravvivenza è aumentata complessivamente, ma anche negli stadi tumorali più elevati [14,15].
Nei pazienti con MEN2 individuati dallo screening familiare, la tempistica della “tiroidectomia profilattica” dipende dalla mutazione RET e dal livello di Ctn (cfr. Scheda. 1). La diagnosi precoce e l’intervento chirurgico completo hanno aumentato la sopravvivenza malattia-specifica a 5 anni di tutti gli MTC all’89% [14].
Cura successiva all’MTC
Dopo l’intervento, devono essere disponibili i seguenti risultati per pianificare un follow-up strutturato: l’istologia, se necessario l’immunoistologia Ctn del tumore, la classificazione secondo lo schema pTNM, il risultato dell’analisi RET per la classificazione nella variante ereditaria o sporadica e il livello Ctn postoperatorio. Si possono definire tre gruppi di pazienti a rischio in termini di risposta alla terapia primaria e di prognosi: eccellente (Ctn non misurabile), biochimicamente incompleto (Ctn misurabile, ma nessun tessuto tumorale rilevabile con la diagnostica per immagini) e strutturalmente incompleto (Ctn significativamente elevato, evidenza di linfonodi metastatici o metastasi a distanza). (Fig. 2). Nel corso successivo, si calcola il tempo di raddoppio del marcatore tumorale (Ctn/CEA) e si esegue la diagnostica per immagini per rilevare una possibile crescita del tumore, seguita dall’adeguamento del gruppo di rischio. [16,17]. Gli intervalli di follow-up sono adattati al rischio e vengono eseguiti ogni 3 mesi fino a una volta all’anno, a seconda delle dimensioni e della posizione del tumore residuo/metastasi e dell’entità della progressione tumorale [18]. A seconda della localizzazione delle metastasi sospette, le procedure di imaging includono l’ecografia del collo e dell’addome, la tomografia computerizzata con mezzo di contrasto, la risonanza magnetica, lo scintigramma osseo ed eventualmente la FDG-PET o la F-DOPA-PET (Fig. 1).
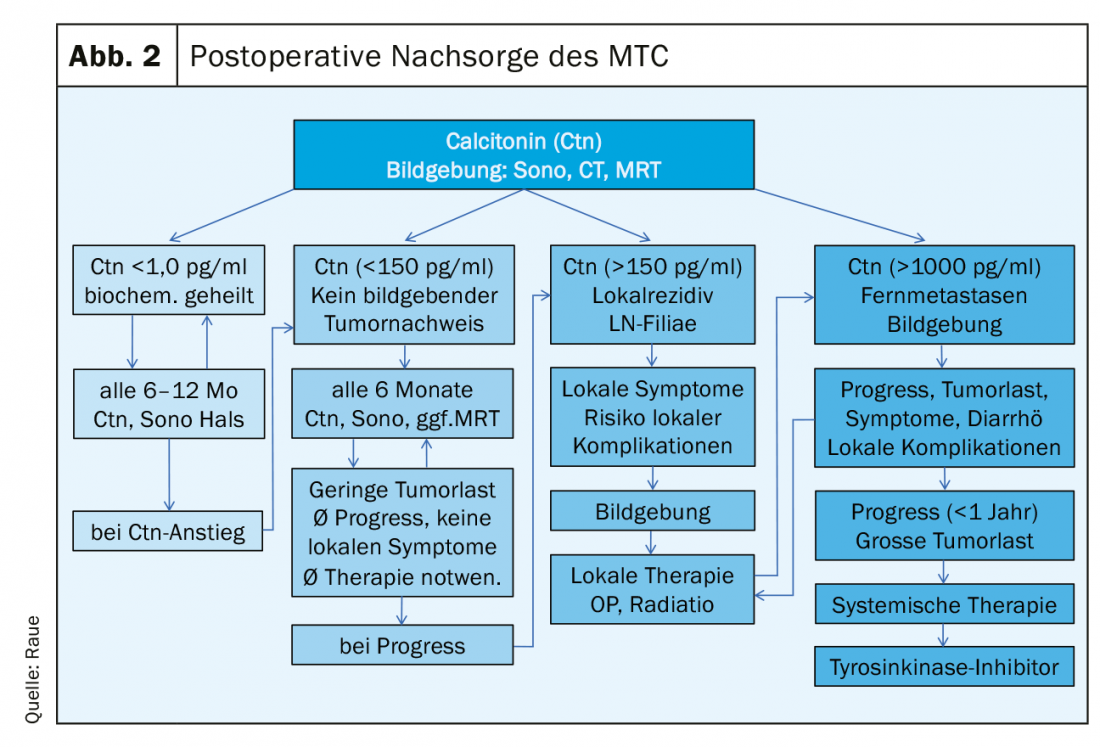
Gruppi a rischio nel follow-up
Nel caso di una risposta eccellente, il livello di Ctn non è misurabilmente basso: allora si può ritenere che il paziente sia biochimicamente guarito, a condizione che l’istologia sia corretta (immunoistologia Ctn obbligatoria). Nei primi 2 anni, sono sufficienti esami di follow-up semestrali con ecografia del collo, determinazione di Ctn e CEA, controllo del trattamento sostitutivo con tiroxina (obiettivo: TSH nell’intervallo normale) e, se necessario, in caso di ipoparatiroidismo postoperatorio, la somministrazione di calcio e calcitriolo (obiettivo: calcio sierico nell’intervallo limite inferiore 2,0-2,3 mmol/l) [19]. Successivamente, se non si è verificato un aumento del Ctn, è possibile passare alle ispezioni annuali. La prognosi è eccellente e non è diversa da quella della popolazione normale.
In caso di risposta biochimica incompleta, il livello di Ctn di solito rimane da leggermente a moderatamente elevato (di solito inferiore a 1000 pg/ml). Il tessuto tumorale rimanente deve essere assunto. Se l’intervento precedente non era adeguato, si procede a uno “staging” seguito da un intervento complementare adeguato. Tuttavia, se questi limiti (vedere la sezione Funzionamento dell’MTC) vengono superati, un approccio curativo non è più possibile, pertanto tutte le ulteriori misure terapeutiche devono essere valutate criticamente, tenendo conto del rischio di morbilità e della qualità di vita, solitamente buona. Spesso, nonostante una ricerca intensiva, non si trova una correlazione tumorale certa, con un Ctn solo moderatamente elevato, fino a 150 pg/ml. La progressione della malattia tumorale nel decorso successivo può essere molto diversa e può essere stimata relativamente bene sulla base del tempo di raddoppio di Ctn e CEA [20]. Il prerequisito per una buona dichiarazione sono almeno 4 valori Ctn nell’arco di 2 anni. I pazienti con tempi di raddoppiamento dei marcatori tumorali inferiori a 24 mesi avevano anche una progressione morfologica dell’immagine nel 94%. Quando i tempi di raddoppiamento dei marcatori tumorali sono durati 24 mesi, l’86% dei pazienti non ha avuto una crescita tumorale rilevabile [21]. Nel corso successivo, i controlli semestrali dei progressi sono di solito sufficienti. La frequenza della diagnostica per immagini può essere pianificata in base ai risultati primari, alla crescita durante la progressione (criteri RECIST) e al tempo di raddoppio del marcatore tumorale. Una diagnosi massima ravvicinata senza conseguenze terapeutiche non è utile, ad esempio l’ecografia ogni 6 mesi, la tomografia computerizzata/MRI ogni 12 mesi sono spesso sufficienti.
In caso di risposta strutturalmente incompleta, il livello di Ctn è significativamente elevato (di solito più di 1000 pg/ml): In questo caso, si deve presumere la presenza di tessuto tumorale infiltrante locale, metastasi ai linfonodi cervicali o metastasi a distanza, per lo più al polmone, al fegato e/o all’osso. Un approccio curativo non è più possibile, le misure palliative sono in primo piano [22].
La rioperazione di una recidiva locoregionale con un approccio palliativo è particolarmente utile nei casi di recidiva locale progressiva o di filiazioni linfonodali dolorose nella regione centrale del collo (vicinanza/infiltrazione della trachea o dell’esofago), al fine di ridurre le complicanze locali. Non ha senso sottoporre ogni nuova metastasi rilevabile a livello cervicale a un intervento chirurgico immediato, perché questo porta a numerosi interventi che non raggiungono il loro obiettivo. Non ci sono prove che questi interventi abbiano un effetto positivo sul decorso generale, sono spesso associati a effetti collaterali come paresi ricorrente, ipoparatiroidismo e paralisi dei muscoli del braccio. La radioterapia è utile per le recidive locali o mediastiniche progressive non operabili. Poiché l’intervento chirurgico è più difficile dopo la radioterapia, l’operabilità dovrebbe sempre essere esaminata prima da un punto di vista palliativo.
Le metastasi epatiche sono comuni, di solito causano pochi sintomi e raramente sono un’indicazione per l’intervento chirurgico. Le metastasi epatiche significativamente progressive e dolorose devono essere trattate. Nella maggior parte dei casi, le metastasi sono multiple e diffuse. La terapia locale mediante (chemio)embolizzazione o radioterapia interna selettiva (SIRT) ha un’efficacia limitata. La terapia sistemica con inibitori della tirosin-chinasi è utile nei casi di progressione rapida.
Le metastasi ossee sono raramente osteolitiche, soggette a fratture o dolorose. La radioterapia esterna è appropriata per le metastasi ossee dolorose e la radioterapia esterna o l’intervento chirurgico per il rischio di frattura. La terapia con bifosfonato/denosumab può essere utilizzata in aggiunta su base individuale, soprattutto nei casi di dolore o rischio di frattura, in particolare nelle metastasi osteolitiche [23].
La chemioterapia è solo leggermente efficace nell’MTC metastatico. Gli inibitori della tirosin-chinasi sono stati testati negli studi per l’MTC metastatico avanzato da circa 10 anni. Da maggio 2012, l’inibitore della tirosin-chinasi vandetanib è disponibile in Svizzera per il trattamento dell’MTC aggressivo e sintomatico; in alcuni Paesi, tra cui la Germania, cabozantinib è stato approvato anche per l’MTC progressivo e dal 2017 è indicato in questo Paese per il trattamento del carcinoma a cellule renali avanzato. Poiché mancano chiaramente prove di beneficio nella malattia in fase iniziale, l’indicazione per la terapia con i TKI è attualmente vista in caso di carico tumorale elevato e di malattia progressiva (criteri RECIST, breve tempo di raddoppio del marcatore tumorale) e marcatamente sintomatica, quando le misure terapeutiche locali sono state esaurite. Il prolungamento della sopravvivenza non è stato ancora dimostrato con nessun TKI nell’MTC metastatico [11].
Nonostante le metastasi a distanza, molti pazienti hanno una buona qualità di vita per anni, perché la crescita del tumore è spesso molto lenta. È possibile una strategia di “sorveglianza attiva”. Il trattamento dell’MTC metastatico è marcatamente orientato ai sintomi, compreso un trattamento antidiarroico coerente nello stadio avanzato del tumore con loperamide e/o tinctura opii, che spesso viene trascurato o dosato con troppa attenzione a scapito della qualità di vita.
Assistenza di follow-up per la MEN2
Oltre al follow-up della MTC, la diagnosi annuale del feocromocitoma viene eseguita a partire dall’11° anno di vita per le mutazioni RET ad alto e altissimo rischio e a partire dal 16° anno di vita per le mutazioni RET a rischio moderato, attraverso la determinazione della metanefrina e delle catecolamine e, se necessario, la risonanza magnetica per immagini. Per quanto riguarda l’iperparatiroidismo primario, viene effettuato un controllo annuale con determinazione del calcio sierico e del paratormone, in modo analogo all’età nei gruppi di rischio di mutazione corrispondenti (tab. 1).
Messaggi da portare a casa
- Il marcatore tumorale del carcinoma midollare della tiroide (MTC) è la calcitonina.
- Lo screening della calcitonina nello struma nodoso consente la diagnosi precoce di MTC.
- Tutti i pazienti con MTC dovrebbero essere sottoposti a un’analisi genetica molecolare del protooncogene RET al momento della diagnosi.
- Di norma, il trattamento di scelta è la tiroidectomia totale con linfoadenectomia centrale.
- Nel follow-up, si distingue tra guarigione biochimica (Ctn non misuratamente bassa), biochimica incompleta (Ctn aumentata senza evidenza tumorale nella diagnostica per immagini) ed evidenza tumorale strutturale (metastasi nella diagnostica per immagini).
- In molti casi con metastasi, è possibile una “sorveglianza attiva”; in caso di progressione e sintomi, si applica quanto segue: locale (chirurgia palliativa, radiazioni) prima che sistemica (inibitori della tirosin-chinasi).
Letteratura:
- Wells SA Jr, et al: Linee guida rivedute dell’American Thyroid Association per la gestione del carcinoma midollare della tiroide. Tiroide 2015; 25(6): 567-610.
- Ceolin L, et al: Il carcinoma midollare della tiroide oltre la chirurgia: progressi, sfide e prospettive. Endocr Relat Cancer 2019; 26(9): R499-R518.
- Raue F, Frank-Raue K: Screening della calcitonina nel gozzo nodulare – limiti superiori. Dtsch Arztebl Int 2018; 115(13): 221.
- Costante G, et al.: Determinazione dei livelli di calcitonina nella malattia delle cellule C: interesse clinico e potenziali insidie. Nat Clin Pract Endocrinol Metab 2009; 5(1): 35-44.
- Kratzsch J, Petzold A, Raue F, et al.: Calcitonina basale e stimolata e procalcitonina mediante vari test in pazienti con e senza cancro midollare della tiroide. Clin Chem 2011; 57(3): 467-474.
- Kahaly GJ, Algeciras-Schimnich A, Davis TE, et al: Studio prospettico multicentrico statunitense ed europeo per le prestazioni analitiche e la convalida clinica di un nuovo immunodosaggio sensibile completamente automatizzato per la calcitonina. Clin Chem 2017; 63(9): 1489-1496.
- Mian C, Perrino M, Colombo C, et al: Affinamento del test del calcio per la diagnosi del carcinoma midollare della tiroide: cutoff, procedure e sicurezza. J Clin Endocrinol Metab 2014; 99(5): 1656-1664.
- Frank-Raue K, Schott M, Raue F. A nome della Sezione Tiroide del DGE. [Recommendation for Calcitonin Screening in Nodular Goiter]. Dtsch Med Wochenschr 2018; 143(15): 1065-1069.
- Machens A, Dralle H. Stratificazione del rischio basata su biomarcatori per il carcinoma midollare della tiroide non trattato in precedenza. J Clin Endocrinol Metab 2010; 95(6): 2655-2663.
- Mucha L, Leidig-Bruckner G, Frank-Raue K, et al: Feocromocitoma nella neoplasia endocrina multipla di tipo 2: penetranza specifica del codone RET e cambiamenti nella gestione negli ultimi quattro decenni. Clin Endocrinol (Oxf) 2017; 87(4): 320-326.
- Cabanillas ME, Ryder M, Jimenez C: Terapia mirata per il cancro avanzato della tiroide: inibitori della chinasi e oltre. Endocr Rev 2019; 40(6): 1573-1604.
- Machens A, Gimm O, Ukkat J, et al.: Migliore previsione della normalizzazione della calcitonina nei pazienti con carcinoma midollare della tiroide, grazie all’analisi quantitativa dei linfonodi. Cancro 2000; 88(8): 1909-1915.
- Roman S, Lin R, Sosa JA: Prognosi del carcinoma midollare della tiroide: predittori demografici, clinici e patologici di sopravvivenza in 1252 casi. Cancro 2006; 107(9): 2134-2142.
- Randle RW, Balentine CJ, Leverson GE et al: Tendenze nella presentazione, nel trattamento e nella sopravvivenza dei pazienti con cancro midollare della tiroide negli ultimi 30 anni. Chirurgia 2017; 161(1): 137-146.
- Opsahl EM, Akslen LA, Schlichting E, et al: Tendenze nella diagnostica, nel trattamento chirurgico e nei fattori prognostici di esito nel carcinoma midollare della tiroide in Norvegia: uno studio basato sulla popolazione nazionale. Eur Thyroid J 2019; 8(1): 31-40.
- Lindsey SC, Ganly I, Palmer F, et al: La risposta alla terapia iniziale predice gli esiti clinici nel carcinoma midollare della tiroide. Tiroide 2015; 25(2): 242-249.
- Yang JH, Lindsey SC, Camacho CP, et al: L’integrazione di una misurazione della calcitonina post-operatoria in un sistema di stadiazione anatomica migliora la stratificazione iniziale del rischio nel carcinoma midollare della tiroide. Clin Endocrinol (Oxf) 2015; 83(6): 938-942.
- Raue F, Frank-Raue K: Follow-up a lungo termine nel carcinoma midollare della tiroide. Risultati recenti Cancer Res 2015; 204: 207-225.
- Leidig-Bruckner G, Bruckner T, Raue F, et al: Follow-up a lungo termine e trattamento dell’ipoparatiroidismo permanente postoperatorio nei pazienti con carcinoma midollare della tiroide: differenze nella malattia completa e parziale. Horm Metab Res 2016.
- www.thyroid.org/professionals/calculators/thyroid-cancer-carcinoma
- Laure Giraudet A, Al Ghulzan A, Auperin A, et al.: Progressione del carcinoma midollare della tiroide: valutazione con i tempi di raddoppio della calcitonina e dell’antigene carcinoembrionale. Eur J Endocrinol 2008; 158(2): 239-246.
- Hadoux J, Pacini F, Tuttle RM, et al: Gestione del carcinoma midollare della tiroide in fase avanzata. Lancet Diabetes Endocrinol 2016; 4(1): 64-71.
- Vogel T, Wendler J, Frank-Raue K, et al: Metastasi ossee nel carcinoma midollare della tiroide: alta morbilità e cattiva prognosi associate alla morfologia osteolitica. J Clin Endocrinol Metab 2020; 105(6).
InFo ONCOLOGIA & EMATOLOGIA 2020; 8(3): 6-10