Una rapida chiarificazione microbiologica con una diagnostica sensibile e specifica è importante a causa dell’aumento della resistenza agli antibiotici, soprattutto per i gonococchi. Questo articolo di revisione fornisce conoscenze sugli aspetti epidemiologici e diagnostici delle infezioni da Chlamydia trachomatis e Neisseria gonorrhoeae.
In Svizzera e in altri Paesi europei, negli ultimi anni si è registrato un rapido aumento delle malattie sessualmente trasmissibili. Una rapida chiarificazione microbiologica con una diagnostica sensibile e specifica è importante a causa dell’aumento della resistenza agli antibiotici, soprattutto per i gonococchi. Questo articolo di revisione mira a fornire conoscenze sugli aspetti epidemiologici e diagnostici delle infezioni da Chlamydia trachomatis e Neisseria gonorrhoeae.
Epidemiologia
Il numero di infezioni da Chlamydia trachomatis, Neisseria gonorrhoeae e Treponema pallidum è aumentato significativamente in termini assoluti e relativi in Svizzera e in molti Paesi europei negli ultimi anni [1,2]. In Svizzera, questi tre patogeni batterici e i virus a trasmissione sessuale, come l’HIV e il virus dell’epatite B, devono essere segnalati dal laboratorio di diagnosi per legge. La segnalazione obbligatoria di queste malattie consente la sorveglianza epidemiologica (www.bag.admin.ch) e l’identificazione dei fattori di rischio e delle popolazioni.
Nei cantoni di Basilea Città, Zurigo, Ginevra e Vaud, l’aumento delle malattie sessualmente trasmissibili è significativo, mentre nelle aree rurali sono stati documentati numeri inferiori [1]. Sebbene sia probabile che il grande sviluppo della diagnostica molecolare negli ultimi anni e la maggiore copertura diagnostica nei centri urbani spieghino parte di questo aumento, è anche molto probabile che il comportamento sessuale imprudente sia in parte responsabile, anche se gli studi fondati su questo argomento sono rari. Si può ipotizzare che la possibilità di una profilassi pre-esposizione specifica all’HIV abbia ridotto in modo significativo la paura dell’infezione da HIV. Questo accetta un rischio sessualmente più elevato per altre infezioni. Per alcune popolazioni a rischio con infezioni batteriche ricorrenti, si discute quindi della profilassi contro la clamidia e i gonococchi [3,4]. Tuttavia, finora mancano studi randomizzati in quest’area, anche nel contesto della resistenza agli antibiotici.
Neisseria gonorrhoeae: nel 2015, in Svizzera sono state segnalate 1895 infezioni confermate di N. gonorrhoeae, circa il 23% in più rispetto all’anno precedente con 1545 segnalazioni (Fig. 1A, www.bag.admin.ch). La maggior parte dei casi ha colpito gli uomini (circa l’80%). Tuttavia, dal 2000 si è registrato un aumento significativo in entrambi i sessi. L’incidenza in Svizzera nel 2015 era di 9 su 100.000 abitanti per le donne e 37 su 100.000 abitanti per gli uomini [5]. La maggior parte dei casi si verifica nei centri urbani. La percentuale maggiore di donne è stata riscontrata nella fascia d’età 15-24 anni, mentre tra gli uomini è particolarmente colpita la fascia d’età 25-34 anni. Un aumento particolarmente forte è stato riscontrato nel gruppo di uomini che hanno contatti sessuali con altri uomini (MSM). Si stima che solo il 3% della popolazione sessualmente attiva sia costituita da MSM, ma secondo gli studi dell’UFSP essi presentano una media del 38% di infezioni da gonorrea [5].
Chlamydia trachomatis: Nel 2015, in Svizzera sono state segnalate 10.157 infezioni confermate di C. trachomatis, ovvero circa il 5% in più rispetto all’anno precedente con 9677 segnalazioni (Fig. 1B, www.bag.admin.ch). In generale, il numero di casi è più che raddoppiato negli ultimi dieci anni. L’incidenza in Svizzera nel 2015 era di 161 su 100.000 abitanti per le donne e di 80 su 100.000 abitanti per gli uomini [6]. Questo potrebbe essere in parte uno pseudo-aumento, poiché la percentuale di test positivi in tutti i test eseguiti è rimasta relativamente stabile [7]. Certamente, vengono diagnosticate anche più infezioni asintomatiche, il che ha a che fare con la disponibilità di una diagnostica molecolare sensibile e di uno screening più frequente. Circa il 70% delle infezioni si verifica nelle donne, la metà delle quali ha un’età compresa tra i 15 e i 24 anni. Nel 70-90% delle donne, l’infezione è asintomatica.

Diagnosi di N. gonorrhoeae – Raccolta di campioni
La corretta raccolta dei campioni è fondamentale per la rilevazione culturale di N. gonorrhoeae. I gonococchi tendono all’autolisi e sono sensibili all’essiccazione e alle sostanze tossiche di alcuni lubrificanti [8].
Al giorno d’oggi, i mezzi di trasporto universali liquidi sono utilizzati come mezzi di raccolta e trasporto di prima scelta, che consentono di effettuare sia la coltura batterica che le analisi diagnostiche molecolari (PCR) (ad esempio, eSwab di Copan). Questi supporti di trasporto contengono nuovi tamponi con fibre di nylon flock che aumentano la resa di raccolta dei campioni rispetto ai tamponi convenzionali [9–11]. Tuttavia, poiché esistono anche laboratori diagnostici che richiedono contenitori di trasporto diversi per la PCR e la coltura del gonococco, consigliamo di consultare il rispettivo laboratorio d’esame prima di prelevare il campione.
Il sito di prelievo deve essere scelto in base all’anamnesi sessuale [12]. Negli uomini, i tamponi uretrali e l’urina di primo getto sono considerati il materiale d’esame di scelta. Entrambi i campioni devono essere prelevati almeno un’ora dopo l’ultima minzione. Lo striscio cervicale deve essere considerato il materiale d’esame preferito dalle donne. I campioni di urina delle donne di solito non dovrebbero essere utilizzati, perché sono meno sensibili degli strisci cervicali [13]. Nelle ragazze in età pre-puberale, le infezioni da gonococchi devono essere ricercate per via vaginale e non cervicale [14]. In questa fascia d’età, le ragazze e i ragazzi dovrebbero ovviamente consultare un pediatra.
I tamponi rettali devono essere ottenuti con un rettoscopio. L’uso di lubrificanti deve essere evitato, perché a volte contengono sostanze tossiche per N. gonorrhoeae e riducono la sensibilità della rilevazione culturale. La tecnica di raccolta deve coprire un’area di tamponamento più ampia possibile [15]. Uno studio ha dimostrato che nel caso di infezione orofaringea, l’area più ampia possibile con una pressione aggiuntiva durante il tampone ha quasi raddoppiato il tasso di rilevamento [15]. Per una guida dettagliata sulla raccolta ottimale dei campioni per la diagnosi di gonorrea, faccia riferimento alle raccomandazioni della Commissione federale per la salute sessuale e della Società svizzera di infettivologia [13]. Se si desidera una coltura gonococcica, il campione deve essere prelevato prima della somministrazione degli antibiotici. Il trasporto dei campioni al laboratorio deve essere il più rapido possibile e la coltivazione culturale deve avvenire preferibilmente entro ventiquattro ore [16]. Il campione può essere spedito nel mezzo di trasporto a temperatura ambiente.
Microscopia
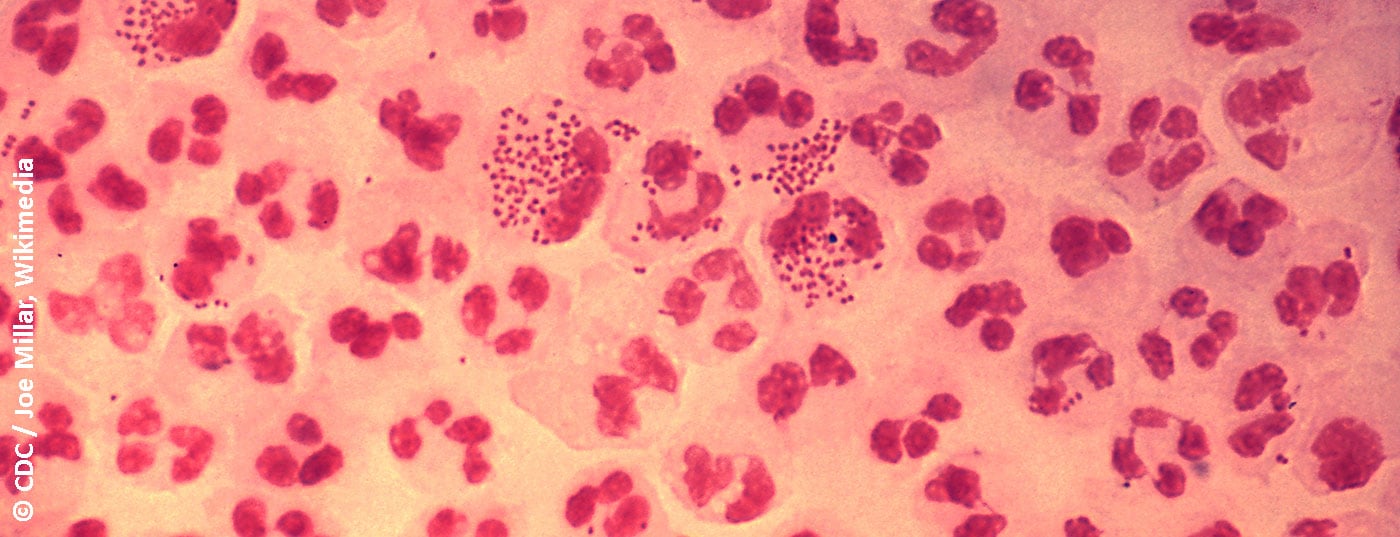
Negli uomini sintomatici, il rilevamento è possibile con una preparazione Gram da un tampone uretrale. Il rilevamento di diplococchi Gram-negativi, a forma di seme o di chicco di caffè, nei leucociti polinucleari è fondamentale per la gonorrea [17]. La sensibilità e la specificità di questo esame sono >90% [14]. Nelle donne, la sensibilità dell’analisi microscopica di uno striscio cervicale è più bassa, 50-70%, ma la specificità è >90% [14]. Naturalmente, l’affidabilità della microscopia dipende dalla qualità del campione e dall’esperienza dell’esaminatore [14]. La microscopia non è utile per diagnosticare un’infezione orofaringea, perché la Neisseria spp. apatogena come componente della flora orale non consente una differenziazione affidabile dalla N. gonorrhoeae patogena.
Metodi biologici molecolari
Oggi sono disponibili diversi sistemi commerciali che consentono di rilevare N. gonorrhoeae e C. trachomatis dallo stesso campione mediante l’amplificazione del DNA (PCR) – le cosiddette PCR duplex. La sensibilità e la specificità di questi sistemi sono eccellenti, ciascuna al >95% [18–21], e per questo motivo sono ora standard per il rilevamento delle infezioni da N. gonorrhoeae e C. trachomatis [22].
Recentemente, esistono anche PCR multiplex che consentono una più ampia chiarificazione con altri patogeni come Mycoplasma hominis, M. genitalium, Ureaplasma urealyticum e U. parvum [23,24]. I test molecolari con sistemi (semi)automatizzati sono meno costosi dei metodi di coltura e consentono un elevato throughput di campioni clinici, soprattutto per uno screening rapido. Il tempo che intercorre tra il ricevimento del campione in laboratorio e il risultato (il cosiddetto turn-around time) è di solito di poche ore e i risultati sono spesso disponibili nello stesso giorno, a seconda dell’ora di ricevimento del campione. I metodi di PCR non dovrebbero essere utilizzati per documentare il successo del trattamento a breve termine, in quanto il DNA di N. gonorrhoeae può ancora essere determinato diverse settimane dopo il successo del trattamento, utilizzando metodi di rilevamento sensibili [14]. Anche le reinfezioni o gli isolati resistenti possono essere responsabili [25]. In questo caso, è necessario riprendere l’anamnesi e seguire una rilevazione culturale con test di resistenza agli antibiotici.
Altri metodi di rilevamento
I test point-of-care (POC) per il rilevamento dell’esterasi leucocitaria e i test immunocromatografici mostrano una bassa sensibilità nelle infezioni da N. gonorrohoeae, con solo il 23-85% e il 60-94%, rispettivamente [26]. Al momento, i metodi basati sulla PCR sono quindi chiaramente superiori.
Coltura batterica
La rilevazione culturale dei gonococchi vitali è necessaria per individuare un eventuale fallimento del trattamento e per raccogliere dati affidabili sulla situazione e sugli sviluppi della resistenza. I gonococchi vengono solitamente coltivati su terreni selettivi. I terreni contengono antibiotici e antifungini per inibire la flora batterica e fungina che li accompagna. Un terreno tipico, utilizzato anche nel nostro laboratorio, è l’agar Martin-Lewis, basato sull’agar sangue da cucina. Le piastre innoculate vengono controllate ogni giorno per verificare la crescita e incubate per 48 ore a 36°C in un’atmosfera al 5% di CO2. I gonococchi crescono come colonie piccole, lisce e grigie il primo o il secondo giorno. Pertanto, un rilevamento culturale di batteri vivi richiede solitamente da due a tre giorni, a differenza della PCR, ma offre maggiori possibilità diagnostiche.
In passato, l’identificazione accurata delle colonie sospette sulla piastra di coltura veniva effettuata testando varie reazioni biochimiche, che richiedevano diverse ore per stabilire un profilo biochimico. Al giorno d’oggi, l’identificazione di un isolato batterico viene eseguita in pochi minuti utilizzando la spettrometria di massa con desorbimento laser a matrice – tempo di volo (MALDI-TOF). La spettrometria di massa MALDI-TOF è diventata lo standard di identificazione per un’ampia varietà di batteri e funghi nei laboratori di microbiologia [27]. Tuttavia, il fattore che limita il tempo rimane la coltivazione dei batteri su una piastra di agar.
Posizione di resistenza
L’Organizzazione Mondiale della Sanità (OMS) ha recentemente stilato un elenco di germi resistenti per i quali è urgente sviluppare nuovi antibiotici efficaci: tra questi, la N. gonorrhoeae resistente alle cefalosporine e al fluorochinolone (www.who.int). Il test di resistenza dopo il rilevamento culturale di N. gonorrhoeae è importante [13,28]. Nonostante l’urgenza, la sorveglianza della resistenza antimicrobica non è standardizzata o sufficientemente consolidata in molti Paesi [29]. I seguenti antibiotici vengono solitamente testati per la N. gonorrhoeae: Cefixime, ceftriaxone, fluorochinoloni (ad esempio ciprofloxacina) e azitromicina. Il test di resistenza richiede altri due giorni dopo l’identificazione.
Il trattamento della N. gonorrhoeae è complicato dallo sviluppo della resistenza agli antibiotici. Mentre la penicillina era ancora considerata il trattamento di scelta negli anni ’70, l’aumento delle penicillinasi mediate da plasmidi (enzimi che eliminano la penicillina) e la resistenza cromosomica alla penicillina hanno messo fine alla terapia con la penicillina [30]. Allo stesso modo, lo sviluppo della resistenza plasmidica e cromosomica alla tetraciclina ha portato all’uso di cefalosporine ad ampio spettro negli anni ’80 e successivamente all’uso di fluorochinoloni [30]. Gli anni ’90 hanno visto un aumento degli isolati resistenti ai fluorochinoloni, inizialmente nel Sud-Est asiatico, seguito da una rapida diffusione in molti Paesi. L’aumento globale di isolati resistenti alla cefixima sta progredendo ed è motivo di preoccupazione perché questo antibiotico è attualmente raccomandato come dose singola orale per il trattamento [30]. Un altro problema è l’aumento della resistenza al ceftriaxone. A causa dell’aumento di N. gonorrhoeae multiresistenti, alcune linee guida raccomandano già ora una combinazione di ceftriaxone intramuscolare e azitromicina orale come prima scelta di trattamento [30].
Per i dettagli attuali sulla terapia della gonorrea, facciamo riferimento alle attuali “Raccomandazioni della Commissione federale per la salute sessuale e della Società svizzera di infettivologia” [13].
Diagnosi di C. trachomatis – Raccolta dei campioni
Le clamidie sono batteri intracellulari obbligati, quindi è importante che il campione contenga il maggior numero possibile di cellule. Questo si ottiene strofinando il tampone durante il prelievo del campione [31].
I siti abituali per il prelievo di campioni nelle infezioni genitali sintomatiche da C. trachomatis sono l’endocervice nelle donne e l’uretra negli uomini. Oggi sono possibili anche campioni meno invasivi, come un tampone vaginale nelle donne e un tampone dell’urina a metà flusso o del meato uretrale negli uomini, aumentando così l’accettazione del test da parte dei pazienti. La sensibilità e la specificità della rilevazione PCR della C. trachomatis nei campioni raccolti in modo non invasivo sono paragonabili ai campioni raccolti direttamente dalla cervice o dall’uretra [32]. I campioni di urina delle donne sono solitamente meno adatti per la rilevazione della C. trachomatis con la PCR, in quanto mostrano una sensibilità subottimale [29]. I tamponi vaginali auto-raccolti sono descritti nelle raccomandazioni di laboratorio del CDC come campioni accurati e accettabili [33]. Per il rilevamento della clamidia con la PCR, il materiale deve essere trattato dopo 48 ore al massimo [31]. Il campione può essere trasportato a temperatura ambiente. Per una guida dettagliata sulla raccolta ottimale dei campioni, faccia riferimento alle “Raccomandazioni della Commissione federale per la salute sessuale e della Società svizzera di infettivologia” [28].
L’infezione con i sierotipi L1, L2 e L3 di C. trachomatis è associata a una maggiore patogenicità e porta al quadro clinico noto come linfogranuloma venereo (LGV). Le infezioni da LGV si verificano soprattutto nelle popolazioni a rischio, come gli MSM. Il rilevamento avviene in tamponi rettali o uretrali, pus o materiale di puntura dai linfonodi colpiti.
Metodi biologici molecolari
Come metodo di scelta, la clamidia viene oggi rilevata con metodi di amplificazione del DNA (PCR). La rilevazione può essere eseguita contemporaneamente per C. trachomatis e N. gonorrhoeae con un’eccellente sensibilità e specificità (vedere sopra). L’importanza di una diagnostica affidabile e della sorveglianza epidemiologica è illustrata dal seguente esempio: Le C. trachomatis hanno 4-8 copie di un plasmide lungo 7500 nucleotidi. Questo plasmide è quindi un bersaglio molto interessante per un metodo di rilevamento tramite PCR, in quanto si ottiene una maggiore sensibilità diagnostica grazie alle copie multiple. Tra novembre 2005 e agosto 2006, c’è stato un calo inaspettato dell’incidenza della C. trachomatis in una certa regione della Svezia [34]. La riduzione del 25% dei casi diagnosticati è stata inizialmente interpretata come il successo delle misure di prevenzione. Tuttavia, questo era in realtà il risultato di un’alterazione genetica con una delezione di 377 coppie di basi in questo suddetto plasmide [34]. Di conseguenza, i test PCR commerciali spesso utilizzati non rilevano più le clamidie nel materiale del campione. Questa variante cosiddetta “svedese” o “scandinava” di C. trachomatis è prevalente in Svezia e ora si trova anche in altri Paesi scandinavi [35]. Finora sono stati segnalati solo singoli casi in altri Paesi. I produttori di diagnostici PCR hanno reagito rapidamente, adattando e migliorando i metodi di rilevamento di conseguenza. La Chlamydia associata alla LGV può essere determinata mediante PCR per il rilevamento dei sierotipi specifici della LGV [36,37]. In un decorso più grave della malattia, ad esempio con linfonodi ingrossati, si dovrebbe ricercare la LGV – soprattutto negli MSM – e trattarla di conseguenza [38]. Come nel caso di N. gonorhoeae, il DNA dei batteri non vitali può rimanere rilevabile per molto tempo in caso di infezione da C. trachomatis – la PCR non deve quindi essere ripetuta entro tre settimane [39].
Altri metodi di rilevamento
Il rilevamento sierologico degli anticorpi o un ELISA sull’antigene della clamidia con una reazione di immunofluorescenza non sono quasi mai utilizzati nella routine.
Posizione di resistenza
Poiché la clamidia può essere coltivata solo in colture cellulari complesse e questo viene fatto solo in laboratori specializzati, di solito non viene effettuato alcun test di resistenza. Il trattamento di scelta è costituito da antibiotici con attività intracellulare, come la doxiciclina e l’azitromicina. Lo sviluppo della resistenza nella C. trachomatis non è ancora stato dimostrato [28]. Per le linee guida sul trattamento dell’infezione da C. trachomatis, facciamo riferimento alle “Raccomandazioni della Commissione federale per la salute sessuale e della Società svizzera di infettivologia” [28].
Sommario
Le malattie a trasmissione sessuale come N. gonorrhoeae e C. trachomatis stanno attualmente vivendo una rinascita – in parte spiegata dalla disponibilità e dalla sensibilità della moderna diagnostica molecolare – ma non solo. Soprattutto in tempi di crescente resistenza agli antibiotici della N. gonorrhoeae e della clamidia particolarmente virulenta (linfogranuloma venereo), è necessario effettuare una diagnosi rapida e affidabile. Oltre al rilevamento diagnostico molecolare, per la N. gonorrhoeae si raccomanda anche il test di resistenza agli antibiotici basato sulla coltura.
Messaggi da portare a casa
- Le malattie a trasmissione sessuale, come la N. gonorrhoeae e la C. trachomatis, stanno vivendo una rinascita. Questo aumento non può essere spiegato esclusivamente dalla disponibilità e dalla sensibilità della moderna diagnostica molecolare.
- La crescente resistenza agli antibiotici nella N. gonorrhoeae e il rilevamento di clamidie particolarmente virulente (linfogranuloma venereo) richiedono una diagnostica rapida e affidabile.
- Oltre al rilevamento diagnostico molecolare, per la N. gonorrhoeae si raccomanda anche il test di resistenza agli antibiotici basato sulla coltura.
Letteratura:
- Ufficio federale della sanità pubblica DÖG. HIV, sifilide, gonorrea e clamidiosi in Svizzera nel 2015: una panoramica epidemiologica. Bollettino UFSP 2016; 46: 12-13.
- (ECDC) ECfDPaC. Infezioni sessualmente trasmesse in Europa 2013. Rapporto di sorveglianza ECDC 2015: 1-124.
- Dubourg G, Raoult D: Le sfide della profilassi pre-esposizione per le infezioni batteriche a trasmissione sessuale. Microbiologia clinica e infezioni: pubblicazione ufficiale della Società Europea di Microbiologia Clinica e Malattie Infettive 2016; 22 (9): 753-756.
- Unemo M, Bradshaw CS, et al: Infezioni sessualmente trasmesse: le sfide future. Lancet Infect Dis 2017; 17 (8): e235-e279.
- Ufficio federale della sanità pubblica DÖG: Gonorrea in Svizzera nel 2015. Bollettino UFSP 2016; 46: 27-30.
- Ufficio federale della sanità pubblica DÖG: Clamidiosi in Svizzera nel 2015. Bollettino UFSP 2016; 46: 32-33.
- Schmutz C, Burki D, et al.: Test per la Chlamydia trachomatis: tendenze temporali nei tassi di positività nel Cantone di Basilea-Stadt, Svizzera. Epidemiol Infect 2013; 141 (9): 1953-1964.
- Vogel U, Forsch M: Cocchi aerobi e anaerobi facoltativi gran negativi. In: Neumeister M, Geiss HK et al. (ed.) Diagnostica microbiologica. Stoccarda, New York: Thieme; 2009.
- Coorevits L, Vanscheeuwijck C, et al: Valutazione di Copan FLOQSwab per il rilevamento molecolare di Chlamydia trachomatis mediante Abbott RealTime CT PCR. Acta clinica
- Belgica 2015; 70 (6): 398-402.
- Jun JK, Lim MC, et al. Confronto tra tamponi vaginali DRY e WET e campioni cervicali nei test Roche Cobas 4800 HPV e Abbott RealTime High Risk HPV. J Clin Virol 2016; 79: 80-84.
- Tan TY, Ng LS, et al.: Valutazione del recupero e della vitalità batterica da tre diversi sistemi di trasporto dei tamponi. Patologia 2014; 46 (3): 230-233.
- den Heijer CDJ, Hoebe C, et al: Una panoramica completa dei test e delle diagnosi di Neisseria gonorrhoeae urogenitale, ano-rettale e orofaringea tra i diversi fornitori di cure STI: uno studio trasversale. BMC Infect Dis 2017; 17 (1): 290.
- Toutous Trellu L, Oertle D, et al: Gonorrea: nuove raccomandazioni su diagnosi e trattamento. Swiss Medical Forum 2014; 14 (20): 407-409.
- Ng LK, Martin IE: La diagnosi di laboratorio della Neisseria gonorrhoeae. La rivista canadese di malattie infettive & microbiologia medica = Journal canadien des maladies infectieuses et de la microbiologie medicale / AMMI Canada 2005; 16 (1): 15-25.
- Mitchell M, Rane V, et al: La tecnica di campionamento è importante per un isolamento ottimale della gonorrea faringea. Sex Transm Infect 2013; 89 (7): 557-560.
- Wind CM, de Vries HJ, et al.: Combinazione riuscita di test diagnostici di amplificazione dell’acido nucleico e coltura mirata differita di Neisseria gonorrhoeae. Giornale di microbiologia clinica 2015; 53 (6): 1884-1890.
- Spence JM, Wright L, Clark VL: Mantenimento in laboratorio della Neisseria gonorrhoeae. Protocolli attuali in microbiologia 2008; Capitolo 4: Unità 4A 1.
- Perry MD, Jones RN, Corden SA: È necessario un test di conferma dei campioni positivi al test Roche cobas 4800 CT/NG Neisseria gonorrhoeae? Confronto del test Roche cobas 4800 CT/NG con un test duplex opa/pap per il rilevamento di N gonorrhoeae. Sex Transm Infect 2014; 90 (4): 303-308.
- Ursi D, Crucitti T, Smet H, Ieven M: Valutazione del test Bio-Rad Dx CT/NG/MG(R) per la rilevazione simultanea di Chlamydia trachomatis, Neisseria gonorrhoeae e Mycoplasma genitalium nelle urine. European journal of clinical microbiology & infectious diseases: pubblicazione ufficiale della Società Europea di Microbiologia Clinica 2016; 35 (7): 1159-1163.
- Wong KC, Ho BS, et al: Sistema Duplex PCR per il rilevamento simultaneo di Neisseria gonorrhoeae e Chlamydia trachomatis in campioni clinici. Giornale di patologia clinica 1995; 48 (2): 101-104.
- Meyer T, Klos C et al.: Valutazione delle prestazioni della
- Kit di test PelvoCheck CT/NG per il rilevamento di Chlamydia trachomatis e Neisseria gonorrhoeae. BMJ open 2016; 6 (1): e009894.
- Low N, Unemo M, et al.: Diagnostica molecolare per la gonorrea: implicazioni per la resistenza antimicrobica e la minaccia della gonorrea non curabile. PLoS medicine 2014; 11 (2): e1001598.
- Del Prete R, Ronga L et al: Rilevazione e identificazione simultanea dei patogeni delle IST mediante PCR multiplex in tempo reale in campioni del tratto genitale in un’area selezionata della Puglia, una regione dell’Italia meridionale. Infezione 2017; 45 (4): 469-477.
- Fernandez G, Martro E, et al.: Utilità di un nuovo test multiplex di PCR in tempo reale per la diagnosi delle infezioni sessualmente trasmesse. Enferm Infecc Microbiol Clin 2016; 34(8): 471-476.
- Bissessor M, Whiley DM et al: La persistenza del DNA di Neisseria gonorrhoeae dopo il trattamento della gonorrea faringea e rettale è influenzata dalla suscettibilità agli antibiotici e dalla reinfezione. Clin Infect Dis 2015; 60 (4): 557-563.
- Watchirs Smith LA, Hillman R et al: Test point-of-care per la diagnosi di infezione da Neisseria gonorrhoeae: una revisione sistematica delle caratteristiche operative e di performance. Sex Transm Infect 2013; 89 (4): 320-326.
- Dierig A, Frei R, Egli A: La via veloce per l’identificazione dei microbi: la spettrometria di massa con desorbimento laser assistito da matrice/ionizzazione a tempo di volo (MALDI-TOF MS). Pediatr Infect Dis J 2015; 34 (1): 97-99.
- Tarr P: Infezioni a trasmissione sessuale con Chlamydia trachomatis: Raccomandazioni della Commissione federale per la salute sessuale (CFSH) e della Società svizzera di infettivologia (SSI). Bollettino UFSP 2017; 35: 8-14.
- Unemo M, Shipitsyna E, Domeika M: Eastern European S, Reproductive Health Network Antimicrobial Resistance G. Sorveglianza della gonorrea, diagnosi di laboratorio e test di suscettibilità antimicrobica della Neisseria gonorrhoeae in 11 Paesi della parte orientale della regione europea dell’OMS. APMIS: acta pathologica, microbiologica, et immunologica Scandinavica 2011; 119 (9): 643-649.
- Elias J, Frosch M, Vogel U: Neisseria. In: Jorgensen JH, ed. Manuale di microbiologia clinica. 11ª ed. Washington, DC: ASM Press; 2015: 635-651.
- Jacobs E: Micoplasma e batteri intracellulari obbligati. In: Neumeister B, Geiss HK, BRaun RW, Kimmig P, eds. Diagnostica microbiologica. Stoccarda, New York: Thieme; 2009.
- Gaydos CA, Essig A, Vogel U: Chlamydaceae. In: Jorgensen JH, ed. Manuale di Mircobiologia Clinica. 11ª ed. Washington: ASM Press; 2015: 1106-1121.
- Hobbs MM, van der Pol B e altri. Dal NIH: atti di un workshop sull’importanza dei campioni vaginali auto-ottenuti per il rilevamento delle infezioni sessualmente trasmissibili. Malattie sessualmente trasmesse 2008; 35 (1): 8-13.
- Ripa T, Nilsson P: Una variante di Chlamydia trachomatis con delezione nel plasmide criptico: implicazioni per l’uso dei test diagnostici PCR. Euro surveillance: bulletin Europeen sur les maladies transmissibles = bollettino europeo delle malattie trasmissibili 2006; 11 (11): E061109 2.
- Unemo M, Clarke IN: La nuova variante svedese della Chlamydia trachomatis. Curr Opin Infect Dis 2011; 24(1): 62-9.
- de Roche M, Sawatzki M et al: Linfogranuloma venereo. Una vecchia malattia con un vestito nuovo. Der Internist 2011; 52 (5): 584-589.
- Goldenberger D, Dutly F, Gebhardt M: Analisi di 721 campioni urogenitali positivi alla Chlamydia trachomatis provenienti da uomini e donne, utilizzando il test PCR in tempo reale specifico per il linfogranuloma venereo L2. Euro surveillance: bulletin Europeen sur les maladies transmissibles = bollettino europeo delle malattie trasmissibili 2006; 11 (10): E061018 4.
- Stoner BP, Cohen SE: Linfogranuloma venereo 2015: presentazione clinica, diagnosi e trattamento. Clin Infect Dis 2015; 61 (8): S865-873.
- Gaydos CA, Crotchfelt KA, et al: Test di amplificazione molecolare per rilevare le infezioni da clamidia in campioni di urina di studentesse delle scuole superiori e per monitorare la persistenza del DNA clamidiale dopo la terapia. J Infect Dis 1998; 177 (2): 417-424.
PRATICA DERMATOLOGICA 2017; 27(6): 22-28