L’attuale situazione di studio dimostra che la trombectomia meccanica con stent retrievers è oggi la terapia standard per i pazienti con ictus con un’occlusione del vaso prossimale nella circolazione anteriore. La trombolisi sistemica e le trombectomie endovascolari sono per molti versi procedure complementari. La trombolisi sistemica sembra essere molto efficace per le occlusioni dei vasi periferici entro una finestra temporale di 4,5 ore; allo stesso tempo, la trombectomia meccanica è più difficile e rischiosa in questo caso a causa dei calibri dei vasi. Le occlusioni prossimali dei grandi vasi (ICA, MCA), invece, devono essere trattate per via endovascolare. Il ruolo della trombolisi sistemica nell’occlusione vascolare prossimale è attualmente oggetto di studi clinici. Il criterio rilevante per la selezione dei pazienti è quindi la posizione dell’occlusione del vaso, che deve essere visualizzata con l’angiografia MR o l’angiografia TC prima di iniziare la terapia. Ulteriori tecniche di imaging, come la TAC o la risonanza magnetica di perfusione, sono utili nel processo decisionale in molti casi, in particolare l’imaging del volume dell’infarto con la risonanza magnetica.
Il trattamento clinico dell’ictus ischemico acuto è cambiato radicalmente negli ultimi anni: Oltre alla trombolisi sistemica, la trombectomia meccanica si è affermata come procedura standard.
Diversi studi randomizzati condotti nel 2014 e nel 2015 hanno dimostrato un chiaro vantaggio della terapia endovascolare (trombectomia) in combinazione con la migliore terapia farmacologica (per lo più trombolisi sistemica) rispetto alla migliore terapia farmacologica da sola. Tuttavia, non tutti i pazienti con ictus sono adatti all’intervento endovascolare; gli aspetti clinici e neuroradiologici determinano la selezione dei pazienti.
Sviluppo della terapia dell’ictus
Dopo i primi tre studi randomizzati controllati (RCT) negativi sulla terapia endovascolare per l’ictus ischemico acuto nel 2012 (IMS III3, Synthesis-Expansion e MR Rescue) [1–3], sono seguiti un totale di cinque studi randomizzati positivi (MrClean, Escape, Extend IA, SWIFT Prime, Revascat, Fig. 1) nel 2014 e 2015 [4–8]. In questo caso, la popolazione di pazienti studiata ha mostrato un recupero neurologico significativamente migliore, misurato dalla Modified Rankin Scale (mRS) dopo tre mesi nel braccio di trattamento endovascolare dello studio. L’efficienza è stata eccellente. Secondo una meta-analisi dei dati dei singoli pazienti dei cinque studi randomizzati, l’NNT è 2,6. Si tratta quindi del trattamento di fase acuta più efficace per l’ictus ischemico [9].
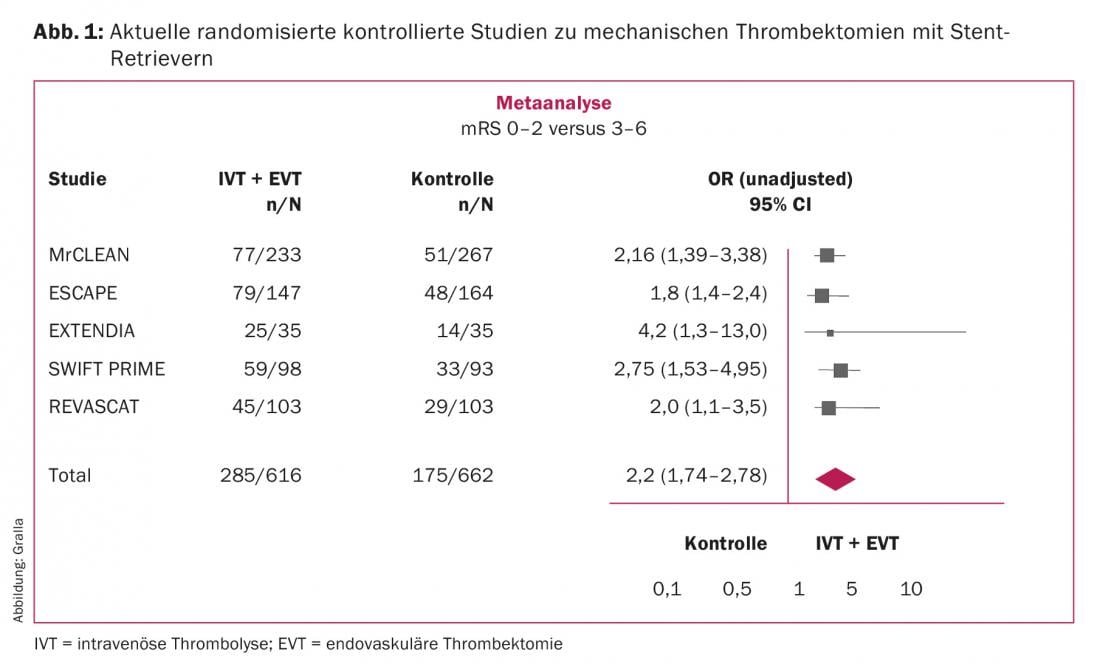
Fondamentalmente, tutti gli studi hanno esaminato gli effetti della terapia endovascolare in combinazione con la migliore terapia farmacologica per l’ictus acuto (principalmente la trombolisi sistemica) rispetto alla migliore terapia farmacologica da sola. La differenza metodologica tra gli studi negativi del 2012 e quelli positivi successivi è stata, in ultima analisi, la selezione più mirata dei pazienti nel 2014/15, nonché l’uso coerente di tecniche moderne di trombectomia con stent retrievers. Si tratta di stent retrattili che possono essere utilizzati per rimuovere i trombi dai vasi intracranici. Da allora, gli stent retrievers sono stati considerati la prima scelta per la trombectomia nell’ictus ischemico acuto; i cateteri di aspirazione sono attualmente in fase di valutazione.
Selezione dei pazienti negli studi
Negli studi precedenti, i pazienti sono stati selezionati esclusivamente in base a criteri clinici (il deficit neurologico acuto con il sospetto urgente di occlusione vascolare acuta intracranica). La diagnostica per immagini è stata ampiamente utilizzata per escludere l’emorragia intracerebrale prima della trombolisi sistemica. Gli studi citati hanno valutato solo i pazienti con ictus della circolazione anteriore (arteria cerebrale media, carotide interna).
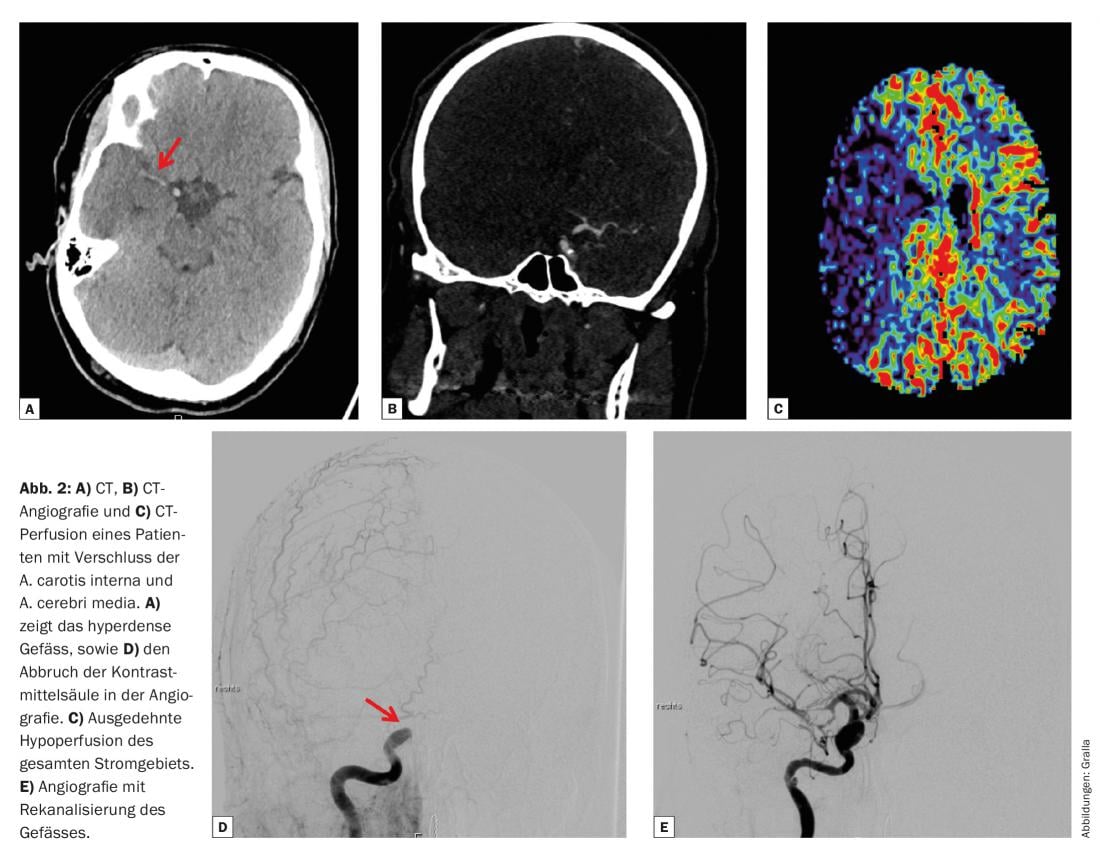
Gli studi attuali traggono chiari criteri di selezione clinici e di imaging dalla tomografia computerizzata e dalla risonanza magnetica. L’obiettivo è identificare i pazienti con occlusioni vascolari prossimali. Le occlusioni vascolari prossimali sono occlusioni dell’arteria carotide interna a livello intracranico, compreso il segmento terminale, dell’arteria cerebrale media nel tronco principale (il cosiddetto segmento M1) e dei rami dell’arteria cerebrale media vicino alla biforcazione (segmento M2) (Fig. 2).
Gli studi differivano in termini di criteri di inclusione ed esclusione clinica, ad esempio età, NIHSS (gravità dell’ictus) e finestra temporale del trattamento. Lo studio MrClean aveva criteri di inclusione molto ampi: Età superiore a 18 anni (senza limite massimo di età) e un NIHSS ≤2 basso. Altri studi, ad esempio SWIFT Prime, hanno incluso solo pazienti di età compresa tra 18 e 85 anni, e sono stati accettati solo quelli con un NIHSS tra 8 e 29 anni. Infatti, anche i pazienti di età superiore a 80 anni e con un NIHSS basso hanno beneficiato in modo significativo della terapia endovascolare negli studi.
La meta-analisi citata all’inizio [9] ha dimostrato che entrambi i sessi, tutte le categorie di età, i pazienti con sintomi di ictus gravi, i pazienti con e senza trombolisi endovenosa precedente e anche quelli nella finestra temporale dopo cinque ore beneficiano del trattamento endovascolare.
Gli attuali criteri di selezione dei pazienti nella pratica clinica quotidiana
In linea di principio, i pazienti con un ictus acuto devono ricevere una terapia adeguata il prima possibile. Oltre alla trombolisi sistemica nella finestra temporale di 4,5 ore, si è affermata la trombectomia meccanica con o senza trombolisi concomitante.
L’età, l’NIHSS o la finestra temporale dopo l’insorgenza dei sintomi sono inclusi nel processo decisionale, ma non sono gli unici criteri di esclusione. Il criterio di selezione decisivo per la terapia dell’ictus è il sito di occlusione e quindi la visualizzazione del sito di occlusione con l’angiografia TC (CTA) o l’angiografia RM (MRA). Pertanto, l’esecuzione di CTA o MRA è obbligatoria in aggiunta all’imaging nativo per escludere l’emorragia e avviare la terapia:
- Le occlusioni periferiche, di solito associate a un NIHSS basso (occlusioni distali delle arterie cerebrali medie o anteriori), di solito presentano un piccolo trombo, che ha un’alta probabilità di ricanalizzazione con la trombolisi sistemica [10]. Inoltre, le occlusioni periferiche sono difficili da raggiungere con la trombectomia meccanica e quindi è probabile che il tasso di complicanze aumenti. Nelle occlusioni vascolari periferiche che superano la finestra temporale per la trombolisi sistemica, la trombectomia meccanica non è generalmente possibile per i motivi citati; se necessario, si deve discutere la trombolisi intra-arteriosa.
- Le occlusioni dei vasi prossimali, invece, mostrano un tasso di ricanalizzazione inferiore con la trombolisi sistemica, per cui la trombectomia meccanica è solitamente indicata/necessaria per le occlusioni dell’ICA e dell’MCA anche dopo la trombolisi sistemica. In linea di principio, tuttavia, la lisi e la trombectomia meccanica sono generalmente da intendersi come complementari, a causa del loro spettro di effetto e di applicazione molto diverso. Il valore della trombolisi sistemica adiuvante prima della trombectomia meccanica per l’occlusione del vaso prossimale è attualmente oggetto di un intenso dibattito. Le probabilità di ricanalizzazione sono solo del 4-6% a seconda del sito di occlusione del vaso e dell’intervallo di tempo (dati del Bern Stroke Register, attualmente in fase di revisione). Allo stesso tempo, la trombolisi sistemica è costosa, può ritardare la trombectomia meccanica e aumenta il rischio di emorragia intracranica. Questi aspetti sono oggetto di studi futuri.
Ulteriori criteri di imaging nel processo decisionale
Il processo decisionale sulla terapia è spesso più complesso nella pratica clinica di tutti i giorni, rispetto a quanto rappresentato nella situazione di studio. I pazienti hanno comorbidità, raggiungono il centro oltre la finestra temporale della terapia classica o hanno altre limitazioni nella prognosi clinica. Sia la TAC che la risonanza magnetica suggeriscono altri possibili criteri per decidere la terapia.
Studi individuali dimostrano che anche i pazienti con un’insorgenza dei sintomi non chiara (ad esempio, ictus da svegli) o oltre la finestra temporale prevista di 8 ore possono beneficiare della trombectomia meccanica. Tuttavia, in questo caso è necessario utilizzare ulteriori criteri di imaging. In questi pazienti, la risonanza magnetica (ponderazione T2 e ponderazione FLAIR) può essere utilizzata per stimare l’età dell’infarto; se l’infarto non è demarcato, questi pazienti possono essere trasferiti alla terapia endovascolare in modo relativamente sicuro.
L’entità del danno cerebrale iniziale e l’esito neurologico possono già essere stimati in una certa misura sulla base della TAC nativa e della CTA (punteggio ASPECT, punteggio collaterale). La TC di perfusione può essere utilizzata per qualificare l’entità dell’ipoperfusione. Rispetto alla TAC, la risonanza magnetica offre alcuni vantaggi, soprattutto la buona visualizzazione del volume infartuale grazie alla ponderazione della diffusione. Così, si può presentare un vero e proprio disallineamento tra il volume dell’infarto e l’ipoperfusione critica. Gli svantaggi della risonanza magnetica sono un tempo di esame un po’ più lungo e costi più elevati.
Molti di questi parametri sono attualmente utilizzati nella discussione sulla cosiddetta “ricanalizzazione inutile”, cioè la ricanalizzazione o riperfusione del territorio senza un miglioramento clinico rilevante. Il presupposto è che i pazienti con un’area infartuale già completamente formata non traggono più benefici rilevanti dalla terapia.
Tuttavia, secondo gli autori, la validazione di questi parametri è attualmente insufficiente per negare fondamentalmente ai pazienti la terapia endovascolare altamente efficiente dell’ictus con la trombectomia meccanica.
Linee guida
Lo stato attuale degli studi e le linee guida per la pratica clinica sono state riassunte dall’American Heart Association (AHA) e dall’European Stroke Organisation (ESO) [11,12].
Letteratura:
- Ciccone A, et al.: SYNTHESIS Expansion Investigators. Trattamento endovascolare per l’ictus ischemico acuto. N Engl J Med 2013; 368(10): 904-913.
- Kidwell CS, et al: Investigatori MR RESCUE. Uno studio sulla selezione dell’imaging e sul trattamento endovascolare per l’ictus ischemico. N Engl J Med 2013; 368(10): 914-923.
- Broderick JP, et al: Investigatori Interventional Management of Stroke (IMS) III. Terapia endovascolare dopo t-PA endovenoso rispetto al solo t-PA per l’ictus. N Engl J Med 2013; 368(10): 893-903.
- Berkhemer OA, et al: Uno studio randomizzato sul trattamento intraarterioso per l’ictus ischemico acuto. N Engl J Med 2015; 372: 11-20.
- Goyal M, et al: Valutazione randomizzata del trattamento endovascolare rapido dell’ictus ischemico. N Engl J Med 2015; 372: 1019-1030.
- Campbell BC, et al: Terapia endovascolare per l’ictus ischemico con selezione di immagini di perfusione. N Engl J Med 2015; 372: 1009-1018.
- Saver JL, et al: Trombectomia Stent-Retriever dopo t-PA endovenoso vs. t-PA da solo nell’ictus. N Engl J Med 2015; 372: 2285-2295.
- Jovin TG, et al: Trombectomia entro 8 ore dall’insorgenza dei sintomi nell’ictus ischemico. N Engl J Med 2015; 372: 2296-2306.
- Goyal M, et al: Trombectomia endovascolare dopo un ictus ischemico a grandi vasi: una meta-analisi dei dati dei singoli pazienti di cinque studi randomizzati. Lancet 2016 Apr 23; 387(10029): 1723-1731.
- Riedel CH, et al: L’importanza delle dimensioni: il successo della ricanalizzazione mediante trombolisi endovenosa nell’ictus anteriore acuto dipende dalla lunghezza del trombo. Stroke 2011 Jun; 42(6): 1775-1777.
- Wahlgren N, et al: Trombectomia meccanica nell’ictus ischemico acuto: dichiarazione di consenso dell’ESO-Karolinska Stroke Update 2014/2015, supportato da ESO, ESMINT, ESNR ed EAN. Int J Stroke 2016 Jan; 11(1): 134-147.
- Powers WJ, et al: Aggiornamento focalizzato 2015 dell’American Heart Association/American Stroke Association delle Linee guida del 2013 per la gestione precoce dei pazienti con ictus ischemico acuto con trattamento endovascolare: una linea guida per gli operatori sanitari dell’American Heart Association/American Stroke Association. Stroke 2015 Oct; 46(10): 3020-3035.
CARDIOVASC 2016; 15(4): 14-17