I sintomi vasomotori (VMS), come le vampate di calore e le sudorazioni, sono tra i sintomi più comuni della menopausa. La terapia ormonale in menopausa (MHT) è la terapia più efficace. La decisione a favore o contro la MHT si basa, tra l’altro, sull’intensità dei disturbi individuali, sulle comorbidità, sul rischio individuale di determinate malattie e sull’atteggiamento personale nei confronti della menopausa e della terapia dei sintomi correlati alla menopausa. Nel 2015, le raccomandazioni della SGGG sulla MHT sono state aggiornate.
Le vampate di calore e la sudorazione (sintomi vasomotori, VMS) sono tra i disturbi più comuni durante la menopausa. La prevalenza di questi disturbi è fino al 50% nella fase riproduttiva e nella perimenopausa e fino all’80% nella postmenopausa. La durata totale mediana della sindrome premestruale frequente (cioè ≥6 giorni con sindrome premestruale nelle ultime due settimane) è di 7,4 anni, e addirittura superiore a 11,8 anni per l’insorgenza in pre- e perimenopausa precoce [1]. La sindrome di VMS è attribuita alla disfunzione termoregolatoria ipotalamica dovuta alla riduzione dell’attività oppioide centrale endogena indotta dalla menopausa e dalla carenza di estrogeni [2].
Diagnostica
La diagnostica di base per la SMV comprende l’anamnesi e il laboratorio:
- Anamnesi medica: la donna è in menopausa? (amenorrea secondaria per dodici mesi); questionario sui sintomi della menopausa, per esempio Menopause Rating Scale (MRS) II
- Laboratorio: C’è ipogonadismo ipergonadotropo? (FSH >40 IU/l con tre misurazioni a intervalli di qualche settimana; carenza di estrogeni con E2 <30 pg/ml)
Nella diagnosi differenziale della VMS, si distingue tra “vampate umide” e “vampate secche”, cioè se la sensazione di calore è accompagnata anche da sudorazione (Tab. 1) [3,4]. Di conseguenza, la diagnosi differenziale comprende:
- Diagnostica di laboratorio nel siero o nel sangue. Sangue EDTA: FSH, estradiolo, progesterone, TSH, fT3, fT4, anti-TPO, TRAK, emocromo differenziale, transaminasi, Krea-.
- tinina, potassio, glicemia a digiuno, emocolture se necessario, test HIV, test TINE, triptasi, VIP (peptide intestinale vasoattivo), calcitonina
- Diagnostica di laboratorio nella raccolta delle urine di 24 ore: 5-Hy-
- acido droxyindoleacetico (5-HIAA), catecolamine (adrenalina, noradrenalina) o metaboliti delle catecolamine (metanefrine, normetanefrine), metilistamina o acido 1,4-metilimidazoleacetico.
- Se necessario, diagnostica per immagini: radiografia del torace, TAC del torace, ecografia renale.
- Se necessario, biopsia del midollo osseo.

Terapia
Per il trattamento della sindrome premestruale sono disponibili la terapia ormonale convenzionale in menopausa (MHT), la medicina alternativa e complementare e la farmacoterapia non ormonale. Di seguito, la MHT verrà discussa in modo più dettagliato, in quanto nel 2015 la lettera di esperti sulla MHT è stata aggiornata dalla Società Svizzera di Ginecologia e Ostetricia (SGGG) [5].
Terapia ormonale in menopausa (MHT)
Indicazione, dosaggio e forma di applicazione: la MHT convenzionale consiste nell’uso di estrogeni, progestinici e, con restrizioni, di androgeni. Le indicazioni per la MHT sistemica sono la VMS. Anche altri sintomi associati alla menopausa possono essere migliorati o eliminati, come i disturbi del sonno, l’umore depresso, la riduzione delle prestazioni e della memoria, i sintomi ossei e articolari, i cambiamenti della vista, della pelle e delle mucose e la perdita di capelli.
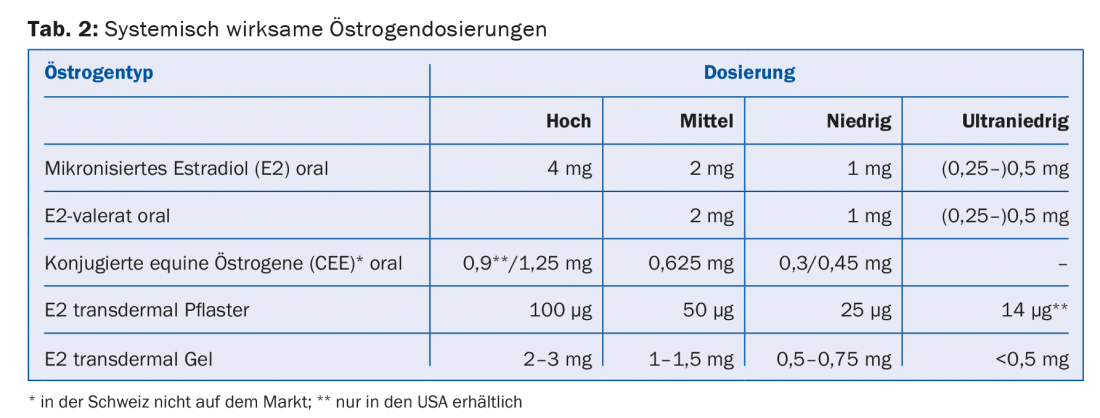
Gli estrogeni attivi a livello sistemico sono disponibili in diversi dosaggi (alto, medio, basso e bassissimo) e forme di applicazione (compresse, gel, cerotti) (tab. 2). Nelle donne con utero, è indicata la somministrazione aggiuntiva di un progestinico per la protezione dell’endometrio. In alternativa, è disponibile la somministrazione diretta di un progestinico tramite uno IUD (Mirena®). Sia la dose di estrogeno che quella di progestinico devono essere scelte il più basse possibile. Tuttavia, in caso di menopausa precoce (<40 anni di età) e di menopausa precoce (<45 anni di età), la sostituzione ormonale “reale” deve essere continuata almeno fino a 51 anni di età. Ogni MHT deve essere rivalutato annualmente. Non è necessario e ragionevole limitare arbitrariamente la durata di applicazione dell’MHT.
Controindicazioni: Le controindicazioni assolute alla MHT sono la gravidanza, il sanguinamento vaginale inspiegabile, il carcinoma mammario ed endometriale e il tromboembolismo arterioso e venoso. Le controindicazioni relative includono la malattia epatica acuta, la disfunzione epatica cronica grave, i calcoli biliari, alcuni disturbi lipometabolici, l’ipertensione e l’emicrania.
Ulteriori vantaggi dell’MHT
Prevenzione delle fratture: la MHT riduce significativamente il rischio di fratture legate all’osteoporosi in tutti i siti del 25-40%. Nelle donne con un rischio aumentato di frattura, la MHT è quindi una terapia di prima scelta anche nei casi asintomatici. Mancano dati sulla frattura per i preparati MHT a basso e bassissimo dosaggio. L’avvio della MHT al solo scopo di prevenire le fratture dopo i 60 anni non è raccomandato. Al contrario, la sola MHT personalizzata per la prevenzione delle fratture può essere proseguita oltre i 60 anni, a condizione che si considerino i potenziali benefici e rischi a lungo termine rispetto alle terapie alternative non ormonali. Il trattamento specifico è indicato per l’osteoporosi manifesta (con frattura).
Malattia coronarica (CHD): la monoterapia estrogenica a medio dosaggio riduce significativamente il rischio di CHD e di mortalità per tutte le cause nelle donne che iniziano la MHT all’età di <60 anni o entro dieci anni dalla menopausa (“finestra favorevole”). Una somministrazione combinata di estrogeno-progestinico con insorgenza all’interno della finestra favorevole mostra un effetto da neutro a positivo, a seconda del progestinico utilizzato. La sola prevenzione cardiovascolare primaria non è un’indicazione per la MHT. La MHT per la prevenzione secondaria e in presenza di CHD sintomatico è controindicata.
Rischi dell’MHT
Eventi cerebrovascolari (CVI): Il rischio aggiuntivo di ictus ischemico attribuibile alla MHT aumenta con l’età sotto la MHT orale. Non esiste una “finestra economica”. Il rischio assoluto rimane basso nelle donne <60 anni nella Women’s Health Initiative (WHI) [6] e nei grandi studi osservazionali con uno o due casi ogni 10.000 donne-anno. Dopo i 60 anni, il rischio di CVI può diventare significativo con la MHT orale. Il rischio è minore con l’MHT transdermico a dosi medio-basse. Pertanto, gli estrogeni transdermici dovrebbero essere preferiti per le donne con un rischio di CVI maggiore al basale.
Tromboembolismo venoso (TEV): non esiste una “finestra favorevole”. In base alla MHT, il rischio aggiuntivo di TEV con CEE più medrossiprogesterone acetato (MPA) nel gruppo di età 50-59 anni è di 11 e con il solo CEE di quattro casi per 10.000 anni-donna (WHI). Il rischio maggiore si riscontra nei primi mesi dopo l’inizio della terapia. Con l’MHT transdermico a dosaggio medio-basso, il rischio è minore o non aumenta. La durata dell’uso e il tipo/dosaggio del progestinico possono influenzare il rischio di TEV in combinazione con gli estrogeni. Il rischio sembra essere inferiore con il progesterone micronizzato e il didrogesterone rispetto ai progestinici sintetici.
Sistema nervoso centrale: le conseguenze a lungo termine della MHT iniziata in peri- o prima postmenopausa sulla cognizione e sulla demenza sono ancora in gran parte sconosciute. La MHT iniziata tardi (>65 anni di età) potrebbe avere un effetto sfavorevole sulla cognizione. La MHT iniziata intorno alla menopausa e continuata fino a dieci anni può essere associata a un rischio ridotto di MA.
Carcinoma mammario: per quanto riguarda il rischio di carcinoma mammario, occorre distinguere tra la monoterapia estrogenica e la terapia estrogeno-progestinica. Secondo lo studio WHI, il rischio di cancro al seno e la mortalità per cancro al seno non sono ridotti in modo significativo nelle donne isterectomizzate durante sette anni di terapia con la sola CEE. Negli studi WHI, Danish Osteoporosis Prevention Study (DOPS) [7] e Nurses’ Health Study (NHS) [8], la monoterapia con estrogeni non ha mostrato alcun aumento del rischio di incidenza e mortalità del cancro al seno fino a un periodo di osservazione cumulativo di 13, 16 e 19 anni rispettivamente. Con la monoterapia estrogenica ≥20 anni, è stato osservato un aumento del rischio di cancro al seno nelle donne normopeso ma non in quelle sovrappeso e obese.
La situazione è diversa con la terapia estro-progestinica. Con CEE + MPA, il rischio di cancro al seno non è aumentato nelle utilizzatrici per la prima volta nei primi 5,6 anni di trattamento. Dopodiché, il rischio inizia ad aumentare. Con CEE + MPA, sono stati osservati nove casi in più per 10.000 donne-anno di cancro al seno invasivo nel WHI rispetto al gruppo di controllo, dopo un periodo di osservazione cumulativo di 13 anni. Al contrario, con E2 + noretisterone acetato (NETA) in DOPS, il rischio di cancro al seno non è aumentato nel periodo di osservazione di 16 anni. Il progesterone micronizzato e il didrogesterone in combinazione con un estrogeno possono essere associati a un rischio minore rispetto ai progestinici sintetici. L’entità dell’aumento del rischio con la terapia combinata estrogeno-progestinico dipende quindi dal tipo di progestinico utilizzato e dalla durata dell’uso.
Mortalità
Le meta-analisi, gli studi randomizzati e controllati e gli studi osservazionali mostrano tutti una riduzione della mortalità per tutte le cause quando le partecipanti allo studio hanno ricevuto la monoterapia estrogenica a dosaggio intermedio prima dei 60 anni o entro i primi dieci anni di postmenopausa (“finestra favorevole”). Nel DOPS, la mortalità per tutte le cause non è diminuita in modo significativo con E2 e con E2 + NETA. Al contrario, in linea con altri studi, l’NHS mostra che l’ovariectomia bilaterale profilattica è associata a un aumento della mortalità a lungo termine nelle donne sotto i 50 anni. Dopo 13 anni (WHI) o 16 anni (DOPS) di osservazione, la mortalità cardiaca e la mortalità per cancro al seno sono state significativamente ridotte con la monoterapia estrogenica, oltre alla mortalità per tutte le cause.
Influenza su altri rischi
Nello studio WHI, come nello studio BCDDP, è stata riscontrata una riduzione significativa del cancro al colon con la somministrazione combinata orale di CEE/MPA, ma non con la monoterapia orale di CEE. L’MHT transdermico non sembra ridurre l’incidenza del cancro al colon. Non ci sono prove epidemiologiche di un cambiamento del rischio di carcinoma bronchiale o della cistifellea dovuto alla MHT. D’altra parte, l’MHT orale (ma non transdermico) aumenta il rischio di colelitiasi e colecistectomia.
Letteratura:
- Avis NE, et al: Durata dei sintomi vasomotori in menopausa durante la transizione della menopausa. JAMA Intern Med 2015; 175(4): 531-539.
- Freedman RR: Vampate di calore: trattamenti comportamentali, meccanismi e relazione con il sonno. Am J Med 2005; 118 Suppl 12B: 124-130.
- von Wolff M, Stute P: Endocrinologia ginecologica e medicina della riproduzione: il libro pratico. 1 ed. Schattauer GmbH, Stoccarda 2013.
- Fazio SB: Approccio alle vampate di calore negli adulti. Uptodate 2015.
- Birkhäuser M, et al.: Raccomandazioni attuali sulla terapia ormonale in menopausa (MHT). Lettera di esperti n. 42. Società Svizzera di Ginecologia e Ostetricia 2015.
- Manson JE, et al: Terapia ormonale in menopausa ed esiti di salute durante le fasi di intervento e di post interruzione prolungata degli studi randomizzati della Women’s Health Initiative. JAMA 2013; 310(13): 1353-1368.
- Schierbeck LL, et al: Effetto della terapia ormonale sostitutiva sugli eventi cardiovascolari nelle donne in postmenopausa recente: studio randomizzato. BMJ 2012; 345: e6409.
- Chen WY, et al: La terapia estrogenica non opposta e il rischio di cancro al seno invasivo. Arch Intern Med 2006; 166(9): 1027-1032.
PRATICA GP 2016, 11(2): 14-17