Gli anticorpi monoclonali casirivimab/imdevimab e sotrovimab hanno ricevuto l’approvazione di Swissmedic rispettivamente lo scorso dicembre e questo gennaio. Un altro farmaco promettente per il trattamento dei pazienti con Covid 19 sarà presto lanciato in Svizzera. Il molnupiravir è un antivirale somministrato per via orale che dovrebbe essere utilizzato nella fase iniziale della sintomatologia del covid 19, come dimostrano i dati di una recente sperimentazione.
La vaccinazione è lo strumento più importante per proteggersi da infezioni, corsi gravi e ricoveri ospedalieri [1]. Tuttavia, per coloro che si infettano, sono fondamentali terapie covid-19 sicure ed efficaci. I candidati farmaci promettenti contribuiscono in particolare a ridurre la necessità di ricovero in ospedale e a contrastare i decorsi gravi in ospedale. Secondo le recensioni corrispondenti, le seguenti tre categorie di farmaci soddisfano questi criteri: anticorpi monoclonali antivirali, sostanze orali antivirali e immunomodulatori [1]. Mentre i primi hanno lo scopo di impedire ai virus di entrare o moltiplicarsi nelle cellule del corpo, gli immunomodulatori vengono utilizzati nelle fasi avanzate della malattia per smorzare le reazioni di difesa dell’organismo [2]. L’UFSP scambia regolarmente informazioni con la task force scientifica sulle terapie esistenti e nuove contro il covide-19. Le domande di autorizzazione all’immissione in commercio attualmente in fase di valutazione da parte di Swissmedic sono riportate nella Tabella 1 [3,15].
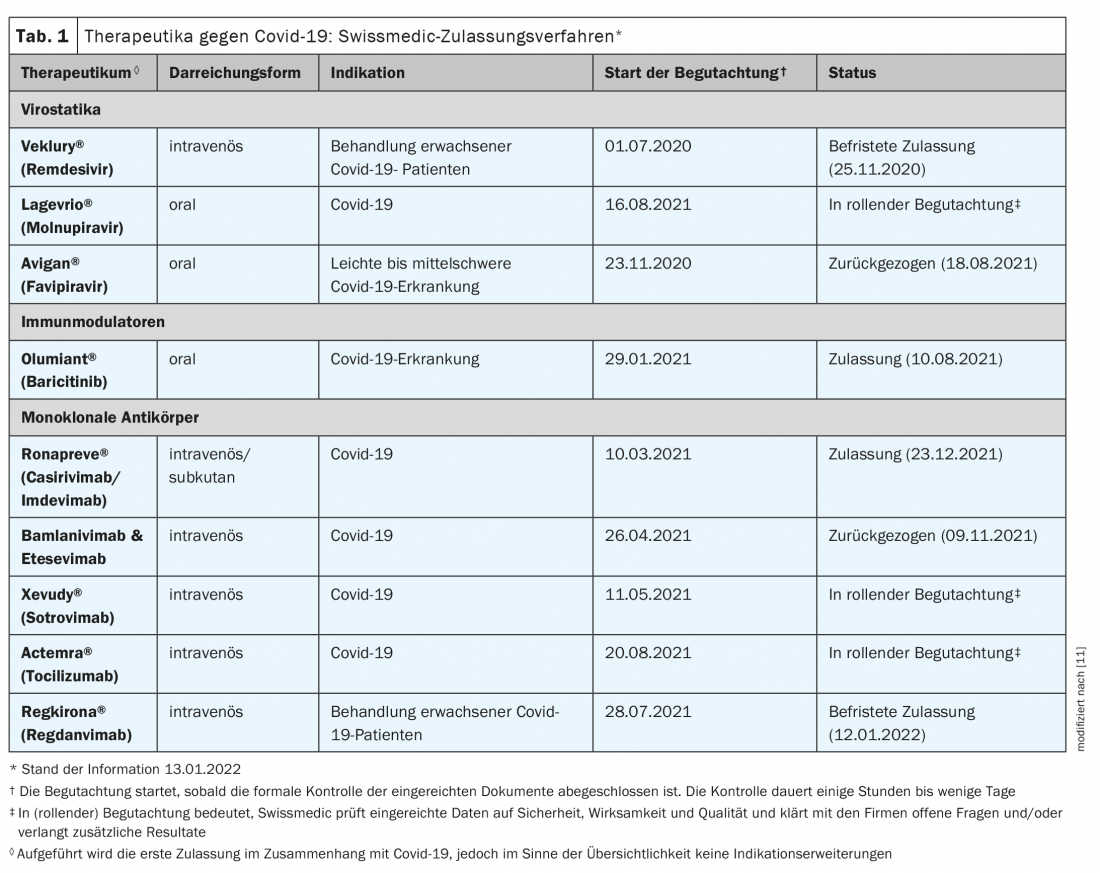
Primo medicinale orale per il trattamento di pazienti ambulatoriali
L’Ufficio Federale della Sanità Pubblica ha stipulato un contratto per la prenotazione del farmaco antivirale Molnupiravir (Lagevrio®), su raccomandazione della task force scientifica Covid 19. Il molnupiravir, disponibile in compresse, è un inibitore della RNA polimerasi ed è uno degli agenti antivirali. Il farmaco è già stato approvato nel Regno Unito dal novembre 2021, e nello stesso periodo è stata richiesta un’approvazione di emergenza negli Stati Uniti [2]. In uno studio clinico, l’efficacia è stata dimostrata nei pazienti covid-19 non ospedalizzati ad alto rischio di progressione grave della malattia, dove la finestra temporale sembra essere critica per il successo del trattamento. [4,5] (Box). Il medicinale può essere utilizzato in Svizzera già durante l’attuale procedura di autorizzazione all’immissione in commercio, dopo l’adeguamento del Regolamento Covid 19 3 (stato delle informazioni: 15.01.2022). Il Governo federale coprirà i costi dei trattamenti nel settore ambulatoriale fino a quando non saranno rimborsati dall’assicurazione sanitaria obbligatoria [3].

Sotrovimab e casirivimab/imdevimab sono ora ufficialmente approvati
Per Xevudy® (sotrovimab), l’approvazione ufficiale di Swissmedic è stata concessa il 14.1.2022 e per Ronapreve® (casirivimab e imdevimab) il 23.12.2021 [6]. Entrambi sono anticorpi monoclonali per via endovenosa, indicati per adulti e adolescenti a partire dai 12 anni di età (peso corporeo di almeno 40 kg) per il trattamento di covid-19 quando non è necessaria l’ossigenoterapia o il ricovero in ospedale e vi è un rischio elevato di sviluppare un decorso grave di covid-19. Ronapreve® è anche indicato – come unico medicinale approvato in Svizzera fino ad oggi – per la prevenzione di Covid-19 quando non è possibile ottenere una risposta immunitaria adeguata alla vaccinazione Covid-19 a causa di altre malattie o terapie. Al momento dell’approvazione, tuttavia, non erano disponibili informazioni sull’efficacia con la variante omicron [6].
Remdesivir – Cosa c’è di nuovo?
Remdesivir (Veklury®) è già disponibile in Svizzera dal 2020 per il trattamento del covid-19. C’è stato e c’è tuttora un dibattito controverso sui benefici dell’ingrediente attivo originariamente sviluppato per trattare i virus Ebola. La pubblicazione dei dati di un nuovo studio nel dicembre 2021 sul New England Journal of Medicine mostra che nei pazienti non ospedalizzati ad alto rischio di progressione a covid-19, tre giorni di trattamento con remdesivir sono associati a un minor rischio di ospedalizzazione o morte rispetto al placebo [7]. Lo studio ha incluso pazienti non ospedalizzati con covid-19 che avevano manifestato sintomi negli ultimi sette giorni e che presentavano almeno un fattore di rischio per la progressione della malattia. I pazienti sono stati assegnati in modo casuale al trattamento con remdesivir (n=279) o placebo (n=283). Remdesivir è stato somministrato per via endovenosa alla dose di 200 mg il giorno 1 e di 100 mg i giorni 2 e 3. I ricoveri o i decessi correlati a Covid-19 si sono verificati in due pazienti nel gruppo remdesivir e in 15 nel gruppo placebo (0,7% vs. 5,3%; hazard ratio: 0,13). Al giorno 28, l’1,6% e l’8,3% dei pazienti nei gruppi remdesivir e placebo, rispettivamente, ha avuto una visita medica correlata a Covid 19 (hazard ratio: 0,19). Non ci sono stati decessi fino al giorno 28. Gli eventi avversi si sono verificati nel 42,3% e nel 46,3% dei pazienti nei gruppi verum e placebo, rispettivamente.
E che dire di Paxlovid®?
Utilizzato in una fase iniziale della malattia di Covid, questo farmaco somministrato per via orale può attenuare in modo significativo il decorso della malattia, secondo i risultati attuali. Negli studi, Paxlovid® (nirmatrelvir più ritonavir) ha ridotto il rischio di ospedalizzazione e di morte dell’89% nei pazienti adulti non ospedalizzati ad alto rischio di covid 19, quando sono stati trattati con questo farmaco per cinque giorni entro tre giorni dalla comparsa dei sintomi [8]. La Food and Drug Administration (FDA) statunitense ha concesso l’approvazione d’emergenza per Paxlovid® alla fine di dicembre 2021 per l’indicazione di pazienti con corona positiva di età pari o superiore a 12 anni con sintomi da lievi a moderati e un rischio elevato di progressione grave [10]. L’Agenzia Europea per i Medicinali (EMA) sostiene l’uso di Paxlovid® per il trattamento di adulti con covite-19 che non necessitano di ossigeno supplementare e che sono ad alto rischio di progressione grave della malattia [9].
Letteratura:
- “Domande e risposte sulla lista dei dieci candidati terapeutici COVID-19”, 22.10.2021, https://ec.europa.eu (ultimo accesso 15.01.2022).
- “Farmaci terapeutici contro l’infezione da coronavirus Covid-19”, 11.01.2022, www.vfa.de/de/arzneimittel-forschung (ultimo accesso 15.01.2022).
- “Coronavirus: la Confederazione firma un contratto per prenotare un farmaco”, www.bag.admin.ch, (ultimo accesso 15.01.2022)
- Jayk Bernal A, et al; Gruppo di studio MOVe-OUT. Molnupiravir per il trattamento orale di Covid-19 nei pazienti non ospedalizzati. N Engl J Med. 2021 Dic 16: NEJMoa2116044.
- “Lo studio di fase 3 conferma l’efficacia di molnupiravir nelle persone affette da COVID-19 non ospedalizzate”, Società tedesca di neurologia, 07.01.2022, https://dgn.org/neuronews (ultimo accesso 15.01.2022).
- “Swissmedic approva “Ronapreve(R)” per i pazienti con Covid 19″. , 27.12.2021, www.swissmedic.ch (ultimo accesso 15.01.2022).
- Gottlieb RL, et al; Investigatori GS-US-540-9012 (PINETREE). Remdesivir precoce per prevenire la progressione a Covid-19 grave nei pazienti esterni. N Engl J Med. 2021 Dec 22. doi: 10.1056/NEJMoa2116846.
- “Un milione di confezioni del farmaco Covid 19 di Pfizer: il governo federale acquista Paxlovid”, www.deutsche-apotheker-zeitung.de (ultimo accesso 15.01.2022).
- “L’EMA sostiene l’uso di Paxlovid per le emergenze”, www.aerzteblatt.de/, (ultimo accesso 15.01.2022)
- “Pfizer riceve l’autorizzazione all’uso di emergenza da parte della FDA statunitense per il nuovo trattamento antivirale orale COVID-19”, www.pfizer.com/news (ultimo accesso 15 gennaio 2022).
- “Stato delle approvazioni per il controllo di Covid-19”, www.swissmedic.ch (ultimo accesso 15.01.2022)
- “BIO COVID-19 Therapeutic Development Tracker”, www.bio.org (ultimo accesso 15.01.2022).
- Whitley R: Molnupiravir – Un passo avanti verso terapie biodisponibili per via orale per Covid-19. N Engl J Med. 2021 Dic 16: NEJMe2117814.
PRATICA GP 2022; 17(1): 40-41
InFo PNEUMOLOGIA & ALLERGOLOGIA 2022; 4(1): 34-35
CARDIOVASC 2022; 21(1): 34-35












