Una diagnosi molecolare dettagliata è oggi obbligatoria per il carcinoma polmonare non a piccole cellule (NSCLC). Se è presente una mutazione driver, l’inibitore della tirosin-chinasi corrispondente deve essere utilizzato in prima linea, se possibile. In caso di progressione di questi tumori, una rebiopsia è molto importante per identificare i meccanismi di resistenza specificamente indirizzabili. Per il NSCLC senza mutazione driver, la chemioterapia citotossica con platino è ancora il trattamento di prima linea. Nella terapia di seconda linea, l’immunoterapia è chiaramente superiore ai trattamenti precedenti e può essere considerata il nuovo standard.
Nessun altro tumore miete tante vittime in tutto il mondo quanto il carcinoma del bronco [1]. Il fumo è il fattore scatenante in oltre l’80% dei pazienti. In Svizzera, l’incidenza negli uomini è diminuita leggermente negli ultimi decenni (attualmente 51/100.000/anno), ma purtroppo è stato osservato un forte aumento nelle donne a causa del comportamento del fumo (27/100.000/anno) [2]. L’incidenza del tumore al polmone a piccole cellule è diminuita costantemente negli ultimi 20 anni e rappresenta ancora il 15% di tutti i tumori al polmone. Il termine carcinoma non a piccole cellule (NSCLC) comprende l’adenocarcinoma (AC, 45%), il carcinoma a cellule squamose (PE, 30%) e il carcinoma a grandi cellule (LCC, 10%). La variazione delle frequenze dei singoli gruppi istologici è dovuta, tra l’altro, all’introduzione delle sigarette con filtro.
La maggior parte dei pazienti muore a causa della malattia, in parte perché il 38% ha già uno stadio metastatico al momento della diagnosi [3]. All’inizio degli anni ’90, il trattamento standard per il NSCLC metastatico era la “migliore terapia di supporto” (BSC) o la partecipazione a uno studio clinico. Fortunatamente, la situazione è cambiata radicalmente. Grazie soprattutto ai progressi della medicina molecolare, oggi è disponibile un’intera gamma di opzioni terapeutiche nuove e molto efficaci.
Diagnosi patologica precisa
La diagnosi istopatologica esatta è decisiva per la scelta della terapia. Il termine NSCLC non è sufficiente: da un lato, occorre distinguere tra AC, LCC e PE; dall’altro, le analisi molecolari sono obbligatorie, almeno per tutti gli AC/LCC, per cercare una cosiddetta mutazione driver. Poiché la diagnosi viene solitamente fatta durante una broncoscopia o un’altra piccola biopsia, è una sfida ottenere abbastanza materiale per tutte queste indagini. L’ASCO e altre società di oncologia hanno sviluppato algoritmi per garantire un uso ottimale del prezioso materiale bioptico [4].
In questo contesto, è importante che la diagnosi possa essere fatta anche su materiale citologico. Recentemente, l’uso del “sequenziamento di nuova generazione” (NGS) ha reso possibile un’analisi molecolare completa anche con poco materiale. La NGS è certamente la metodologia del futuro [5]. Inoltre, le nuove tecnologie consentono di determinare i cambiamenti genetici nei tumori dal DNA libero circolante nel sangue periferico (“biopsia liquida”).
Terapia del carcinoma a cellule squamose
Nella PE metastatica, la terapia di prima linea di scelta è la combinazione di un platino con gemcitabina o paclitaxel. Questa terapia consente una sopravvivenza mediana di circa 10-12 mesi, rispetto ai 4-6 mesi senza terapia o agli 8 mesi con il platino e i farmaci citostatici più vecchi [6]. È importante notare che la chemioterapia migliora anche la qualità della vita rispetto alla BSC. Con una tolleranza accettabile e una progressione del tumore almeno stabile, sono appropriati 4(-6) cicli [7]. Gli studi randomizzati hanno dimostrato che né la terapia prolungata né quella di mantenimento portano a un miglioramento della sopravvivenza globale (OS) [8]. Il cisplatino non ha mostrato un chiaro vantaggio in termini di sopravvivenza rispetto al carboplatino, meno tossico, ma causa un tasso di risposta più elevato [9].
Terapia degli adenocarcinomi senza mutazione Driver
Ci sono tre differenze importanti tra l’AC senza mutazioni e la PE:
- Un ampio studio randomizzato ha dimostrato che la terapia di combinazione con un platino e l’analogo dell’acido folico pemetrexed è la terapia più efficace, sia in termini di tasso di risposta che di OS. La superiorità del pemetrexed nell’AC rispetto alla gemcitabina e ai taxani è stata dimostrata anche in altri studi [6,10].
- Nei pazienti che mostrano un decorso o una risposta stabile dopo quattro cicli di questa terapia, si può prendere in considerazione una terapia di mantenimento con il solo pemetrexed. Questo può migliorare sia la libera da progressione (PFS) che la OS, con OS a un anno con questa terapia (13,9 mesi) [11]. Meno comune è lo “switch maintenance”, in cui al paziente viene somministrata una nuova sostanza durante la terapia di mantenimento. Le sostanze efficaci sono l’erlotinib e probabilmente anche il docetaxel [12,13].
- L’uso aggiuntivo di bevacizumab, un anticorpo monoclonale contro il fattore di crescita endoteliale vascolare (VEGF), può migliorare ulteriormente la sopravvivenza, anche se solo in misura ridotta [14].
Pazienti anziani e pazienti in condizioni generali ridotte
Per molto tempo, non era chiaro come dovessero essere trattati i pazienti anziani e/o quelli in condizioni generali ridotte (ECOG performance status 2-3). Due importanti studi randomizzati hanno aiutato in questo senso. In uno studio EORTC, la monoterapia con navelbina o gemcitabina è stata confrontata con il trattamento combinato con carboplatino e paclitaxel in pazienti di età superiore ai 70 anni in buone condizioni di salute. La terapia combinata ha causato un miglioramento significativo della OS da 6,2 a 10,3 mesi [15]. Allo stesso modo, uno studio ha confrontato la monoterapia con pemetrexed con una combinazione di carboplatino e pemetrexed nei pazienti con una salute generale scarsa (performance status ECOG di 2). Anche in questo caso, la terapia combinata è risultata significativamente migliore (OS mediana 5,3 vs. 9,3 mesi) [16]. Tenendo conto della situazione individuale di ogni paziente, si dovrebbe puntare a una terapia combinata, quando possibile.
Adenocarcinomi con mutazione Driver
Se viene rilevata una mutazione driver, la strategia terapeutica cambia radicalmente. Per questi tumori rari, esistono inibitori della tirosin-chinasi (TKI) specifici e mirati, che offrono un alto tasso di risposta (60-80%) e una lunga PFS con una tollerabilità relativamente buona. Un elenco aggiornato delle mutazioni più importanti si trova su www.mycancergenome.org. La frequenza delle singole mutazioni è illustrata nella Figura 1.

Mutazione EGFR
Le mutazioni attivanti del recettore del fattore di crescita epidermico (EGFR) si verificano principalmente nell’esone 19 e 21. Per i tumori con una delezione nell’esone 19, il TKI EGFR di scelta è afatinib, perché è stato l’unico TKI a mostrare un beneficio in termini di OS rispetto alla chemioterapia di prima linea in uno studio randomizzato, sebbene sia stato consentito il passaggio a un TKI in caso di progressione nel braccio della chemioterapia [17]. Afatinib causa spesso diarrea e tossicità cutanee. Per le mutazioni nell’esone 21 (più comunemente la mutazione puntiforme L858R), erlotinib o gefitinib sono opzioni consolidate. Le rare mutazioni nell’esone 20 sono solitamente associate alla resistenza primaria ai TKI attualmente disponibili.
Nonostante una PFS mediana di circa un anno con i TKI, tutti i pazienti sviluppano resistenza e progressione della malattia. In quasi il 50% dei casi di resistenza, la mutazione gatekeeper T790M è la causa della progressione. Il nuovo TKI osimertinib è ora disponibile contro questa mutazione con un tasso di risposta di almeno il 60% e una PFS di dieci mesi, anche dopo un precedente trattamento con un TKI standard [18]. Alcuni pazienti che diventano resistenti a osimertinib presentano un’altra mutazione gatekeeper chiamata C797S. Tuttavia, non sono ancora disponibili TKI contro questa mutazione [19].
Altri meccanismi di resistenza sono la trasformazione in carcinoma a piccole cellule, che poi deve essere trattato come tale, o il verificarsi dell’amplificazione MET. Sono disponibili anche TKI specifici per le amplificazioni MET, tra cui crizotinib, che è efficace anche contro il NSCLC ALK-positivo. Una rebiopsia dopo la progressione è assolutamente raccomandata a causa delle importanti conseguenze terapeutiche!
Quasi tutti i pazienti con una mutazione EGFR ricevono anche una chemioterapia convenzionale durante il decorso della malattia; la terapia di scelta in questo caso è anche un platino e un pemetrexed, come nell’AC senza mutazione driver.
Traslocazione ALK
Il 4-7% di tutti gli AC presenta una traslocazione del gene “activated in lymphoma kinase” (ALK). Esistono diversi TKI contro questi tumori rari. Crizotinib è approvato come terapia di prima linea: porta a un tasso di risposta del >70% e a una PFS di 10,9 mesi [20]. Gli sviluppi della resistenza sono inevitabili anche con le mutazioni ALK, ma molto più eterogenei rispetto alle mutazioni EGFR. Circa il 50% dei pazienti rimane dipendente dalla via di segnalazione ALK (tra l’altro, a causa della mutazione di resistenza di ALK); negli altri pazienti, c’è un’attivazione parziale di vie di segnalazione alternative.
Nella terapia di seconda linea, ceritinib e alectinib hanno dimostrato il loro valore con tassi di risposta intorno al 60% e una PFS di circa sette mesi negli studi di fase II [21,22]. L’effetto collaterale più importante di ceritinib è la nausea. Alectinib mostra un’ottima efficacia nel sistema nervoso centrale, dove le metastasi sono più frequentemente localizzate nell’AC ALK-positivo. Nella resistenza secondaria, la mutazione di resistenza più importante è la mutazione G1202R, contro la quale sia ceritinib che alectinib sono inefficaci. In questi tumori sono stati osservati risultati promettenti con lorlatinib, un ALK-TKI di terza generazione [23]. Se è necessaria la chemioterapia, per il NSCLC ALK-mutato si utilizzano anche il pemetrexed e il platino.
Traslocazione di ROS1
La traslocazione ROS1, un’alterazione genetica molto rara, si verifica in circa l’1,5% di tutte le AC. Crizotinib è altrettanto efficace come nell’AC ALK-positivo e viene quindi utilizzato come terapia di prima linea (anche se non è ancora approvato per questo) [24]. Ceritinib e alectinib non hanno alcun effetto contro ROS1, mentre lorlatinib è efficace.
Sovraespressione di MET
L’oncogene “fattore di transizione mesenchimale-epiteliale” (MET) è il recettore del “fattore di crescita epatocitario” (HGF). La sovraespressione o l’amplificazione di MET è un meccanismo di resistenza secondaria relativamente comune nella terapia con EGFR-TKI (5-20%), ma questi cambiamenti si verificano anche nel NSCLC non trattato (2-4%). Per le amplificazioni MET o le mutazioni skip dell’esone 14, più rare, sia crizotinib che cabozantinib sono TKI efficaci [25,26]. I nuovi TKI, tra cui INC280, sono attualmente oggetto di studi clinici.
Mutazioni con significato ancora non chiaro
Molti NSCLC e soprattutto AC presentano altre mutazioni rare il cui significato terapeutico non è ancora chiaro, come le mutazioni di BRAF e HER2 e le traslocazioni di RET e NTRK1 [27,28]. Esistono TKI specifici per tutte queste aberrazioni genetiche e si spera che nel prossimo futuro si possano trovare strategie terapeutiche altamente efficaci.
Un’eccezione importante è la mutazione KRAS, che è di gran lunga la mutazione più comune nell’AC (20-25%). Purtroppo, al momento non esistono approcci terapeutici per questi casi. I pazienti con NSCLC mutato in KRAS sono trattati con la chemioterapia convenzionale, ma hanno una prognosi complessiva peggiore rispetto agli altri pazienti.
Immunoterapie
L’innovazione più importante degli ultimi due anni è l’introduzione dell’immunoterapia. La seconda generazione di immunoterapie consiste in anticorpi diretti contro PD-1 o il suo ligando PD-L1, che portano all’attivazione di cellule T citotossiche nel tumore. Studi randomizzati nel NSCLC di seconda linea hanno dimostrato la superiorità di questi cosiddetti inibitori del checkpoint immunitario rispetto alla chemioterapia standard con docetaxel sia per la PE che per l’AC [29,30]. Non solo hanno ottenuto un tasso di risposta migliore, ma anche una PFS e una OS più lunghe. C’è persino la speranza che in alcuni pazienti si possa ottenere una remissione lunga e possibilmente duratura. Ad esempio, nella PE con nivolumab, la PFS mediana è stata di 3,5 mesi e la OS a 1 anno è stata del 42% rispetto a 2,8 mesi e al 21% con docetaxel.
Le immunoterapie sembrano funzionare meglio per i carcinomi indotti dal tabacco che per i tumori con una mutazione driver. Si sospetta che l’induzione dei cosiddetti neo-antigeni da parte dell’esposizione al tabacco tossico svolga un ruolo. Questi neo-antigeni si offrono al sistema immunitario come nuovi punti di attacco. I farmaci meglio studiati finora sono nivolumab (approvato in Svizzera come terapia di seconda linea) e pembrolizumab.
Conclusione
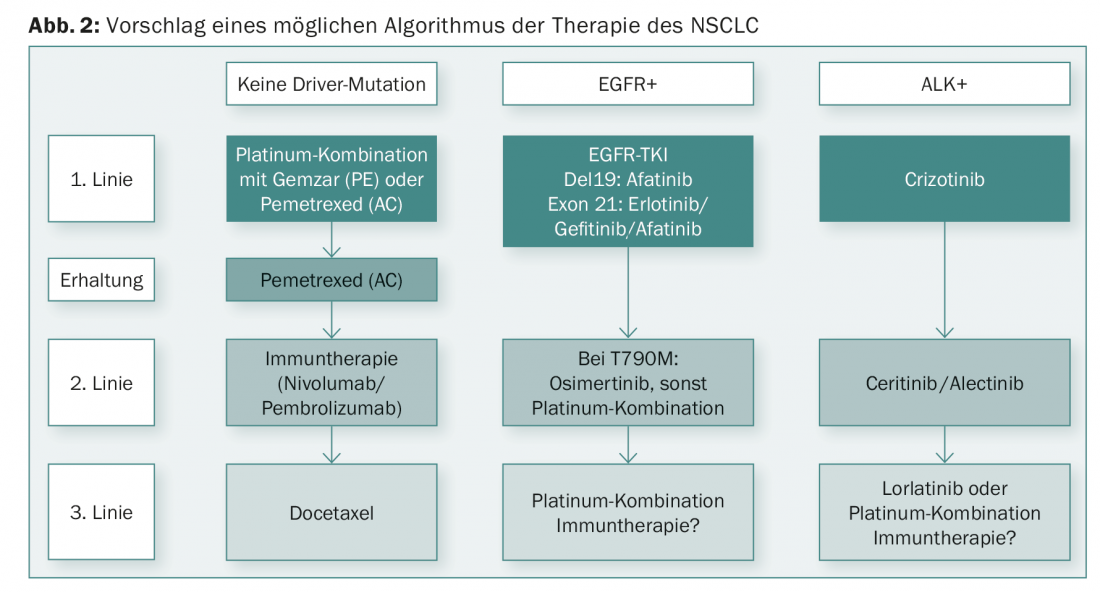
Le nuove scoperte degli ultimi anni hanno migliorato in modo significativo la prognosi del NSCLC. I progressi sia nei TKI che nelle immunoterapie sono stati rapidi. Dalle nuove scoperte si può ricavare un alogramma terapeutico differenziato (Fig. 2).
Letteratura:
- Lozano R, et al: Mortalità globale e regionale da 235 cause di morte per 20 gruppi di età nel 1990 e nel 2010: un’analisi sistematica per il Global Burden of Disease Study 2010. Lancet 2012; 380(9859): 2095-2128.
- Arndt V, et al: Rapporto svizzero sul cancro 2015: stato e sviluppi. Neuchatel: Ufficio federale di statistica; 2015.
- Morgensztern D, et al: Tendenze nella distribuzione degli stadi per i pazienti con carcinoma polmonare non a piccole cellule: un’indagine del National Cancer Database. J Thorac Oncol 2010; 5(1): 29-33.
- Leighl NB, et al: Test molecolari per la selezione dei pazienti con tumore al polmone per gli inibitori della tirosin-chinasi del recettore del fattore di crescita epidermico e del linfoma anaplastico. J Clin Oncol 2014; 32(32): 3673-3679.
- Vigneswaran J, et al.: Il test genetico completo identifica le alterazioni genomiche target nella maggior parte dei pazienti con carcinoma polmonare non a piccole cellule, in particolare l’adenocarcinoma, indagine di un singolo istituto. Oncotarget 2016, 26 febbraio. doi: 10.18632/oncotarget.7739. [Epub ahead of print]
- Scagliotti GV, et al: Studio di fase III di confronto tra cisplatino più gemcitabina e cisplatino più pemetrexed in pazienti naïve alla chemioterapia con carcinoma polmonare non a piccole cellule in stadio avanzato. J Clin Oncol 2008; 26(21): 3543-3551.
- Rossi A, et al: Sei o meno cicli pianificati di chemioterapia di prima linea a base di platino per il carcinoma polmonare non a piccole cellule: una revisione sistematica e una meta-analisi dei dati dei singoli pazienti. Lancet Oncol 2014; 15(11): 1254-1262.
- Brodowicz T, et al: Chemioterapia di prima linea con cisplatino e gemcitabina, seguita da gemcitabina di mantenimento o dalla migliore terapia di supporto nel carcinoma polmonare non a piccole cellule in stadio avanzato: uno studio di fase III. Cancro del polmone 2006; 52(2): 155-163.
- de Castria TB, et al: Cisplatino rispetto a carboplatino in combinazione con farmaci di terza generazione per il carcinoma polmonare non a piccole cellule in fase avanzata. Cochrane Database Syst Rev 2013; 8: CD009256.
- Scagliotti G, et al: Le analisi di interazione trattamento-istologia in tre studi di fase III mostrano la superiorità del pemetrexed nel carcinoma polmonare non a piccole cellule non squamoso. J Thorac Oncol 2011; 6(1): 64-70.
- Paz-Ares LG, et al: PARAMOUNT: Risultati finali di sopravvivenza globale dello studio di fase III di pemetrexed di mantenimento rispetto al placebo subito dopo il trattamento di induzione con pemetrexed più cisplatino per il carcinoma polmonare non a piccole cellule non squamoso avanzato. J Clin Oncol 2013; 31(23): 2895-2902.
- Cappuzzo F, et al: Erlotinib come trattamento di mantenimento nel carcinoma polmonare non a piccole cellule in fase avanzata: uno studio di fase 3 multicentrico, randomizzato, controllato con placebo. Lancet Oncol 2010; 11(6): 521-529.
- Fidias PM, et al: Studio di fase III di docetaxel immediato rispetto a docetaxel ritardato dopo la terapia di prima linea con gemcitabina più carboplatino nel carcinoma polmonare non a piccole cellule avanzato. J Clin Oncol 2009; 27(4): 591-598.
- Soria JC, et al: Revisione sistematica e meta-analisi degli studi randomizzati di fase II/III che aggiungono bevacizumab alla chemioterapia a base di platino come trattamento di prima linea nei pazienti con carcinoma polmonare non a piccole cellule avanzato. Ann Oncol 2013; 24(1): 20-30.
- Quoix E, et al: Chemioterapia doppia con carboplatino e paclitaxel settimanale rispetto alla monoterapia nei pazienti anziani con carcinoma polmonare non a piccole cellule in stadio avanzato: studio randomizzato di fase 3 IFCT-0501. Lancet 2011; 378(9796): 1079-1088.
- Zukin M, et al: Studio randomizzato di fase III di pemetrexed a singolo agente rispetto a carboplatino e pemetrexed in pazienti con carcinoma polmonare non a piccole cellule in fase avanzata e performance status dell’Eastern Cooperative Oncology Group di 2. J Clin Oncol 2013; 31(23): 2849-2853.
- Yang JC, et al: Afatinib rispetto alla chemioterapia a base di cisplatino per l’adenocarcinoma polmonare positivo alla mutazione EGFR (LUX-Lung 3 e LUX-Lung 6): analisi dei dati di sopravvivenza globale di due studi randomizzati di fase 3. Lancet Oncol 2015; 16(2): 141-151.
- Janne PA, et al: AZD9291 nel carcinoma polmonare non a piccole cellule resistente agli inibitori dell’EGFR. N Engl J Med 2015; 372(18): 1689-1699.
- Niederst MJ, et al: Il contesto allelico della mutazione C797S acquisita con il trattamento con gli inibitori EGFR di terza generazione influisce sulla sensibilità alle strategie terapeutiche successive. Clin Cancer Res 2015; 21(17): 3924-3933.
- Solomon BJ, et al: Crizotinib in prima linea rispetto alla chemioterapia nel carcinoma polmonare ALK-positivo. N Engl J Med 2014; 371(23): 2167-2177.
- Shaw AT, et al: Ceritinib nel carcinoma polmonare non a piccole cellule con riarrangiamento ALK. N Engl J Med 2014; 370(13): 1189-1197.
- Gadgeel SM, et al: Sicurezza e attività di alectinib contro la malattia sistemica e le metastasi cerebrali nei pazienti con carcinoma polmonare non a piccole cellule resistente a crizotinib (AF-002JG): risultati della parte di ricerca della dose di uno studio di fase 1/2. Lancet Oncol 2014; 15(10): 1119-1128.
- Shaw A, et al: Attività clinica e sicurezza di PF-06463922 da uno studio di escalation della dose in pazienti con NSCLC avanzato ALK+ o ROS1+. J Clin Oncol 2015; 33(suppl; abstr 8018).
- Shaw AT, et al: Crizotinib nel carcinoma polmonare non a piccole cellule ROS1-arrangiato. N Engl J Med 2014; 371(21): 1963-1971.
- Ross Camidge D, et al: Efficacia e sicurezza di crizotinib nei pazienti con carcinoma polmonare non a piccole cellule (NSCLC) avanzato amplificato con c-MET. J Clin Oncol 2014; 32(5s, suppl; abstr 8001).
- Paik PK, et al: Risposta a crizotinib e cabozantinib nei pazienti con adenocarcinoma polmonare di stadio IV con mutazioni che causano lo skipping dell’esone 14 di MET. J Clin Oncol 2015; 33(suppl; abstr 8021).
- Mazieres J, et al: Pazienti con cancro al polmone con mutazioni HER2 trattati con chemioterapia e farmaci mirati a HER2: risultati della coorte europea EUHER2. Ann Oncol 2016; 27(2): 281-186.
- Peters S, et al: Risposta drammatica indotta da vemurafenib in un adenocarcinoma polmonare mutato BRAF V600E. J Clin Oncol 2013; 31(20): e341-344.
- Brahmer J, et al: Nivolumab rispetto a docetaxel nel carcinoma polmonare non a piccole cellule a cellule squamose in fase avanzata. N Engl J Med 2015; 373(2): 123-135.
- Borghaei H, et al: Nivolumab rispetto a docetaxel nel carcinoma polmonare non a piccole cellule non squamoso avanzato. N Engl J Med 2015; 373(17): 1627-1639.
- Boolell V, et al: L’evoluzione delle terapie nel tumore del polmone non a piccole cellule. Cancers (Basilea) 2015; 7(3): 1815-1846.
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(3): 6-10