L’anticorpo monoclonale dupilumab blocca la componente comune del recettore per l’interleuchina (IL)-4 e l’IL-13, i fattori centrali dell’infiammazione di tipo 2. È autorizzato in Svizzera dal 2019 e nuovi studi hanno analizzato la sua efficacia e sicurezza nei pazienti con BPCO da moderata a grave con infiammazione T2 e nei bambini con asma da moderata a grave non controllata. I risultati sono stati presentati al Congresso DGP 2024.
Le esacerbazioni della BPCO sono associate a un aumento del rischio di ulteriori esacerbazioni, a un deterioramento della funzione polmonare e a un’elevata morbilità e mortalità. Le malattie BPCO con infiammazione di tipo 2 sono particolarmente colpite.
BOREAS è stato uno studio di fase 3, randomizzato, controllato, in doppio cieco, della durata di 52 settimane, sull’efficacia e la sicurezza di dupilumab bisettimanale da 300 mg nei pazienti con BPCO con eosinofili nel sangue ≥300 cellule/µl. Idealmente, dovrebbero aver già ricevuto una tripla terapia composta da un corticosteroide inalatorio (ICS), un β2-agonista a lunga durata d’azione (LABA) e un antagonista muscarinico a lunga durata d’azione (LAMA). Questo valeva per il 98% della popolazione, come ha spiegato il Dr. Henrik Watz, Istituto di Ricerca in Pneumologia presso la Clinica Polmonare di Grosshansdorf (Germania) [1]. In casi eccezionali, come quando l’ICS era controindicato, era consentita anche la combinazione LAMA/LABA. Le esacerbazioni devono essersi già verificate durante il trattamento, come indicatore della necessità di un’ulteriore terapia. Una storia di asma era un criterio di esclusione.
939 pazienti con eosinofili nel sangue ≥300 cellule/µl sono stati inclusi nel BOREAS e randomizzati in un rapporto 1:1 a dupilumab 300 mg (n=468) o placebo (n=471) per via sottocutanea (SC) una volta ogni 2 settimane (q2w) per 52 settimane. I pazienti avevano un’età compresa tra 40 e ≤80 anni. L’endpoint primario era il tasso annualizzato di esacerbazioni da moderate a gravi dall’inizio dello studio alla settimana 52. Gli endpoint secondari comprendevano la variazione del FEV1valore prima della broncodilatazione alla settimana 12 e alla settimana 52 rispetto al basale (BL), le esacerbazioni cumulative nel tempo e la sicurezza o la qualità della vita correlata alla salute dei pazienti in terapia come Esito riferito dal paziente (PRO).
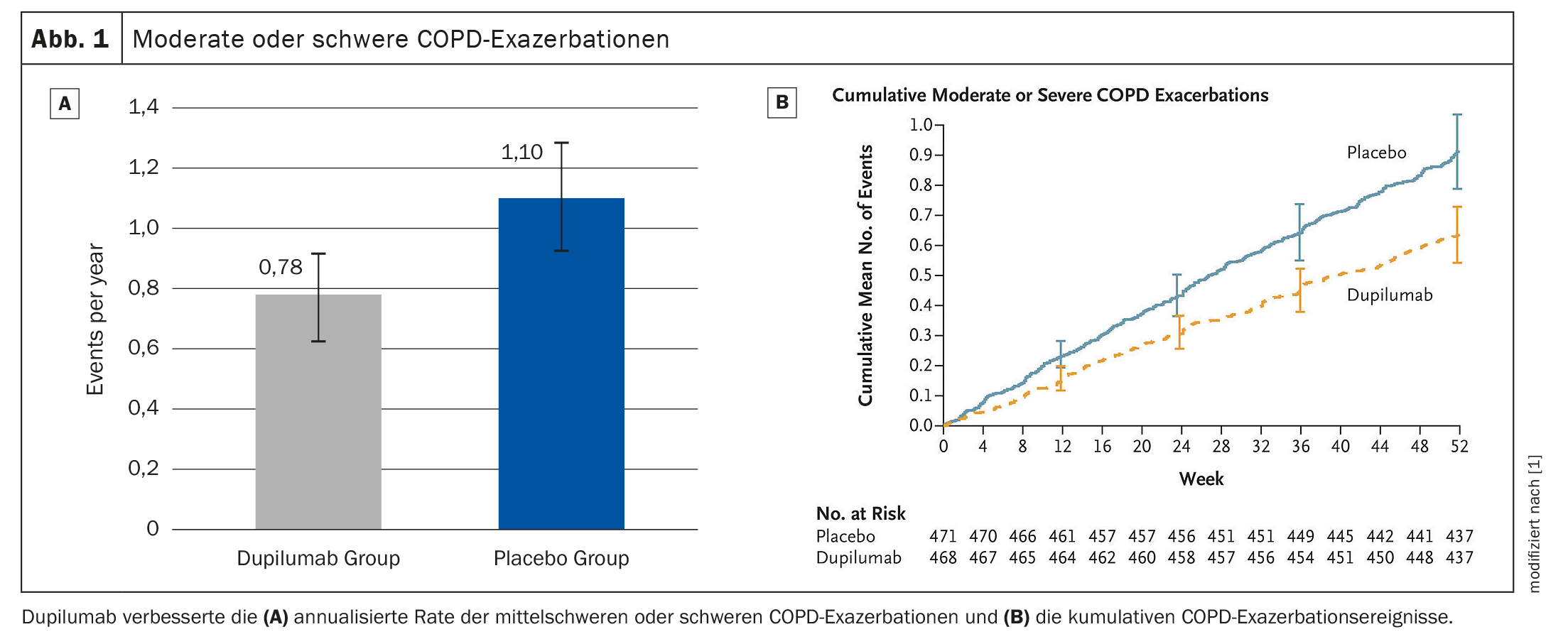
Il tasso di esacerbazione della BPCO si è ridotto del 30%.
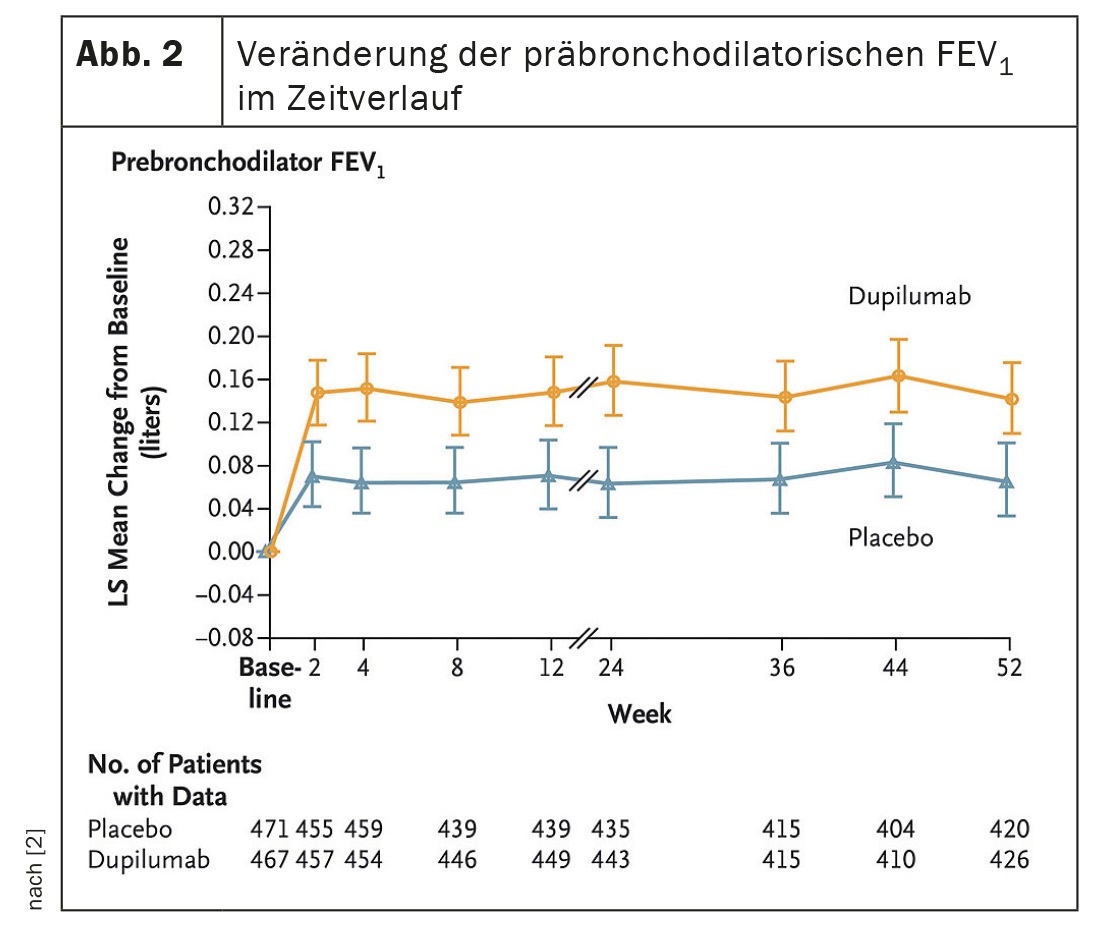
Dopo 52 settimane, dupilumab ha ridotto il tasso di esacerbazione del 30% rispetto al gruppo placebo (p=0,0005). (Fig. 1A, 1B). L’anticorpo IgG4 ha aumentato il FEV pre-BDIl valore 1 alla settimana 12 era significativo (differenza LSM vs. placebo: 83 ml, p<0,0001); che persisteva fino alla settimana 52 (83ml, p=0,0003) (Fig. 2) . Questo tendeva a tradursi in un minor trattamento annuale associato alle esacerbazioni con corticosteroidi sistemici (SCS) nel gruppo dupilumab- (13,57 giorni). [SD 13,17] rispetto al braccio placebo (19,09 giorni [SD 20,65]). La sicurezza era simile in entrambi i gruppi, gli eventi avversi erano uguali.
Dupilumab ha quindi migliorato in modo significativo le esacerbazioni da moderate a gravi, la funzione polmonare, la qualità della vita e i sintomi nei pazienti con BPCO con infiammazione T2, ha concluso il dottor Watz. Il ricorso ai giorni di SCS necessari per il trattamento dell’AECOPD tendeva a diminuire con dupilumab.
Effetto a lungo termine sulla funzione polmonare nei pazienti con asma pediatrico
Ridurre al minimo la compromissione della funzione polmonare è un obiettivo primario nel trattamento dell’asma pediatrico. L’uso a lungo termine di dupilumab nello studio Excursion ha determinato un miglioramento sostenuto della funzione polmonare nei pazienti di età compresa tra 6 e 11 anni con asma di tipo 2 incontrollata da moderata a grave, che hanno completato lo studio Voyage; un rapido miglioramento della funzione polmonare è stato osservato nei pazienti che sono passati dal placebo (PBO) a dupilumab (DPL).
In Voyage, dupilumab ha ridotto significativamente le esacerbazioni gravi e ha migliorato la funzione polmonare per 52 settimane. Excursion è stato uno studio di estensione in aperto, a braccio singolo, con bambini che avevano precedentemente partecipato a Voyage. La dottoressa Theresa Guilbert, pneumologa pediatrica presso il Cincinnati Children’s Hospital e l’Università di Cincinnati (USA), ha presentato un’analisi post-hoc di Excursion che ha valutato i miglioramenti della funzione polmonare numericamente superiori osservati nei bracci DPL/DPL rispetto a quelli PBO/DPL in Excursion [3].
I bambini hanno ricevuto dupilumab 100 mg o 200 mg ogni 2 settimane in base al peso corporeo per un periodo di un anno. I ricercatori hanno esaminato la variazione dal basale nello studio principale (PSBL) e la percentuale di FEV1 prima della broncodilatazione nell’arco di 104 settimane, oltre all’impatto delle caratteristiche basali come l’età di insorgenza dell’asma, il tempo trascorso dalla diagnosi, la dose di corticosteroidi inalatori (ISC) al basale e il controllo dell’asma sull’efficacia di dupilumab.
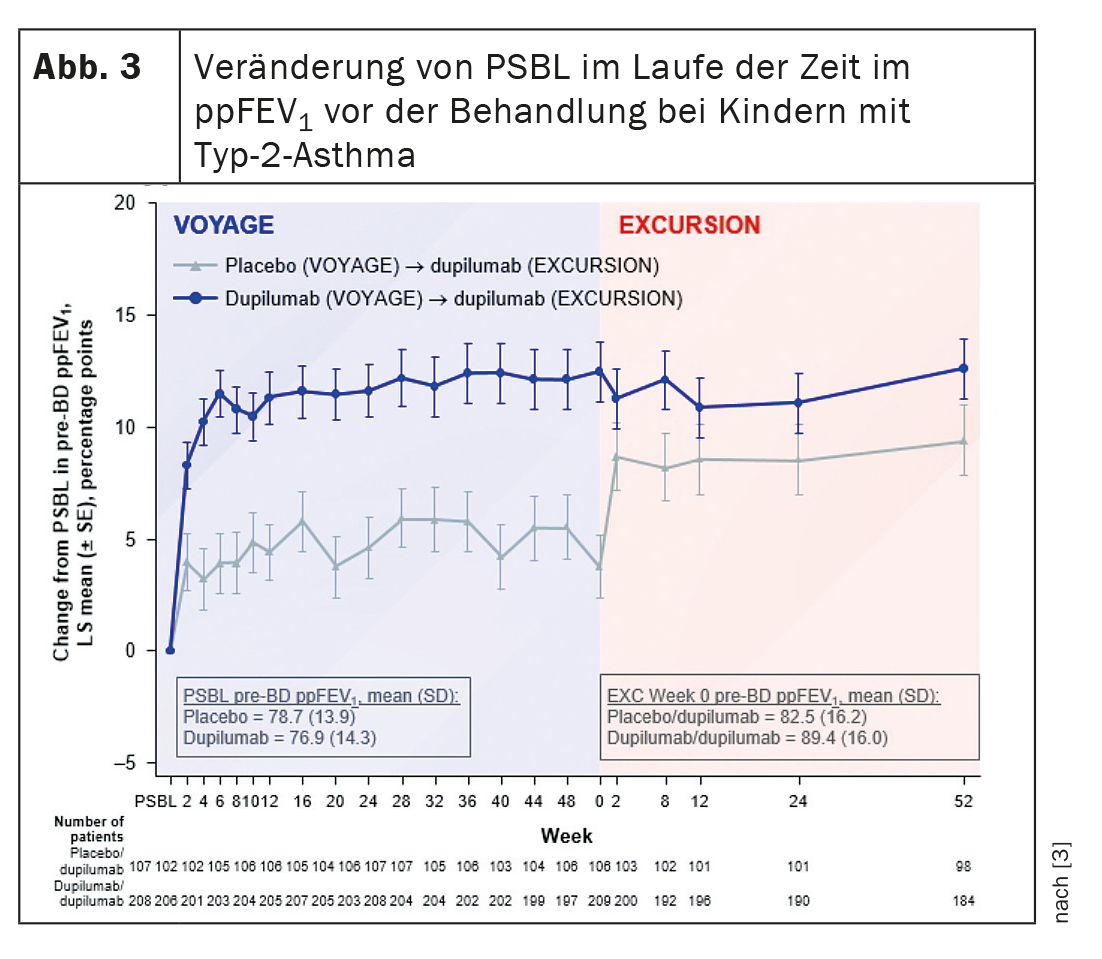
Dupilumab ha migliorato rapidamente la funzione polmonare durante il Viaggio, che è proseguita durante l’Escursione. In Excursion, i pazienti che hanno ricevuto il placebo durante Voyage hanno mostrato un miglioramento rapido e sostenuto della funzione polmonare fin dall’inizio del trattamento con dupilumab (Fig. 3) . Dupilumab è stato in grado di migliorare e mantenere la percentuale di FEV1 prevista prima della broncodilatazione fino a 104 settimane, ha riassunto i risultati il dottor Guilbert. La risposta della funzione polmonare al biologico in un periodo da 1 a 2 anni non differiva in base alla durata dell’asma o all’età all’inizio della terapia.
Il problema di questi dati è che i pazienti che sono passati dal placebo al dupilumab non hanno recuperato completamente la loro funzione polmonare, ha osservato il Prof. Dr. Marek Lommatzsch, University Medicine Rostock (Germania). Quindi la domanda è: si tratta di un effetto reale e significa che un ritardo di un anno nella terapia comporta una perdita della funzione polmonare? La dottoressa Guilbert ha spiegato che il suo gruppo di ricerca ha avuto inizialmente la stessa idea. “Tuttavia, non si tratta di una differenza statistica. Il valore è numericamente più alto, ma non raggiunge la significatività statistica rispetto al gruppo placebo”. Probabilmente sono necessari numeri più grandi per determinare questa differenza. Inoltre, “naturalmente si discute molto se si debba parlare di remissione clinica nel trattamento con l’avvento delle terapie biologiche”. C’è un certo dibattito sull’opportunità o meno di questa pratica in pediatria.
Congresso: DGP 2024
Fonti:
- Watz H: Efficacia e sicurezza di Dupilumab per la BPCO con infiammazione di tipo 2 indicata da un aumento degli eosinofili. Sessione “Novità sugli studi clinici nell’asma e nella BPCO”. 64° Congresso della Società tedesca di pneumologia e medicina respiratoria e.V., 20-24 marzo 2024, Mannheim (D).
- Bhatt SP, Rabe KF, Hanania NA, et al: Dupilumab per la BPCO con infiammazione di tipo 2 indicata dalla conta degli eosinofili. N Engl J Med 2023; 389: 205-214; doi: 10.1056/NEJMoa2303951.
- Guilbert T: Effetto a lungo termine di Dupilumab sulla funzione polmonare nei pazienti pediatrici con asma non controllata. Sessione “Novità sugli studi clinici nell’asma e nella BPCO”. 64° Congresso della Società tedesca di pneumologia e medicina respiratoria e.V., 20-24 marzo 2024, Mannheim (D).
InFo PNEUMOLOGIE & ALLERGOLOGIE 2024; 6(2): 36-37 (pubblicato il 30.5.24, prima della stampa)