Nel 2018, circa 10 milioni di persone hanno contratto la tubercolosi e 1,45 milioni sono morte. Una sfida sempre più grande è la cura dei pazienti con tubercolosi multiresistente (MDR-TB), per i quali i due farmaci più importanti nella terapia permanente della tubercolosi – isoniazide e rifampicina – hanno perso la loro efficacia.
Nel 2018, circa 10 milioni di persone hanno contratto la tubercolosi e 1,45 milioni sono morte. Una sfida sempre più grande è la cura dei pazienti con tubercolosi multiresistente (MDR-TB), per i quali i due farmaci più importanti nella terapia permanente della tubercolosi – isoniazide e rifampicina – hanno perso la loro efficacia. La resistenza ai farmaci è probabilmente causata, non di rado, dalla diversa farmacocinetica dei farmaci contro la TBC [1]. Tuttavia, nelle regioni con un’alta percentuale di MDR-TB nelle nuove diagnosi, si osserva anche la trasmissione diretta dei patogeni MDR con una frequenza crescente [2]. La terapia è lunga e può essere soggetta a effetti collaterali, quindi è necessario un team interdisciplinare ed esperto per gestire il trattamento. Secondo il rapporto annuale dell’Organizzazione Mondiale della Sanità (OMS), il successo del trattamento per la forma multiresistente di tubercolosi è attualmente solo del 55-56% a livello mondiale [2,3]. Il basso tasso di rilevamento dei casi di MDR-TB in tutto il mondo rimane problematico. Prima di poter prendere una decisione terapeutica sensata, è necessario disporre di una diagnostica con l’aiuto della quale, se possibile, è possibile determinare tutte le resistenze ai farmaci. Ad esempio, dei 500.000 nuovi casi di MDR-TB stimati per il 2018, solo 187.000 sono stati diagnosticati e segnalati. Il numero di casi che potevano essere trattati era corrispondentemente basso, pari a 156.000. Poiché solo circa la metà di loro completa con successo il trattamento, secondo le statistiche dell’OMS, oltre l’80% dei casi stimati di MDR rimane incontrollato e contribuisce alla diffusione della malattia [2].
In Germania, nel 2018 sono stati segnalati 118 casi di MDR-TB, che corrispondono a una quota stabile del 3,1% delle nuove diagnosi negli ultimi anni. Nel rapporto 2019 dell’Istituto Robert Koch (RKI), sono disponibili i risultati del trattamento dei casi di tubercolosi MDR del 2017 e il successo del trattamento è stato documentato solo nel 39% dei pazienti [4]. La data limite per la valutazione di questi risultati di trattamento trasmessi all’RKI è stata il 1° marzo 2019. Tuttavia, in quasi il 45% dei pazienti, la terapia non era stata completata al momento della valutazione e l’esito della terapia era quindi sconosciuto. Secondo l’Ufficio federale della sanità pubblica, sono stati diagnosticati sette casi di MDR-TB in Svizzera nel 2018 e dieci casi nel 2019 (Ufficio federale della sanità pubblica, comunicazione personale).
Le raccomandazioni dell’OMS sulla diagnosi e il trattamento della TBC resistente ai farmaci, che sono cambiate in modo significativo nel 2019 e nel 2020, sono spiegate in modo più dettagliato di seguito.
Diagnostica
Nei pazienti in cui si sospetta la tubercolosi polmonare sulla base di sintomi tipici o sulla base di una radiografia del torace evidente, almeno 2 campioni di espettorato di buona qualità devono essere esaminati per i micobatteri secondo le raccomandazioni dell’OMS [5,6]. Negli ultimi anni, i test di amplificazione degli acidi nucleici (NAAT) per le forme polmonari ed extrapolmonari di TB hanno acquisito la massima importanza nella diagnostica iniziale. I NAAT permettono di distinguere il complesso M. tuberculosis dai micobatteri non tubercolari (NTM). Con i metodi automatizzati come l’Xpert® MTB/RIF, il risultato del test per l’identificazione del patogeno e la resistenza alla rifampicina può essere atteso dopo poche ore. La nuova versione di Xpert® MTB/RIF Ultra ha mostrato una migliore sensibilità complessiva rispetto alla versione precedente (90% contro 85% [6]), soprattutto nella tubercolosi polmonare paucibacillare senza rilevamento microscopico di micobatteri (sensibilità 77% contro 67% [7]). Tuttavia, questo miglioramento è stato accompagnato da un peggioramento della specificità (96% contro 99% [6]). Soprattutto nei pazienti con un’anamnesi di TB negli ultimi 5 anni, è possibile un aumento dei risultati falsi positivi [7].
La microscopia dell’espettorato per rilevare i bastoncini acidofili fornisce un’indicazione della carica batterica dell’espettorato e quindi del rischio di infezione. Tuttavia, la trasmissione è possibile anche con microscopia negativa e NAAT positivo [8]. Ogni volta che si sospetta la tubercolosi, si deve cercare una coltura del patogeno. La coltura è attualmente ancora lo standard per la diagnostica della TB. Rispetto ai terreni di coltura solidi, la coltura liquida ha una sensibilità leggermente superiore e la crescita dei micobatteri può essere rilevata circa due settimane prima grazie al metodo.
Diagnosi della resistenza ai farmaci
Nonostante le sfide metodologiche, i test di resistenza culturale o fenotipica sono attualmente ancora molto apprezzati per le decisioni terapeutiche cliniche in Germania e in Svizzera [9]. I test di resistenza fenotipica di isoniazide, rifampicina, fluorochinoloni, aminoglicosidi e polipeptidi sembrano essere più affidabili in questo caso rispetto ad altri farmaci antitubercolari [10]. Le ragioni sono da un lato tecniche, come l’instabilità della sostanza dei carbapenemi. In alcuni casi, i valori soglia per la categorizzazione “sensibile”/”resistente” mancano o non sono sufficientemente provati scientificamente. Questo vale in particolare per le importanti sostanze cicloserina/terizidone e acido para-aminosalicilico (PAS) [11].
La coltivazione del patogeno e il test di resistenza fenotipica possono richiedere 2-10 settimane. Durante questo periodo, è necessario effettuare una terapia calcolata e allineata ai modelli di resistenza locali [12,13]. I risultati di un test di resistenza biologico molecolare o genotipico sono disponibili molto più rapidamente. In molti casi, questo può già essere effettuato da materiale diretto (ad esempio, espettorato contenente agenti patogeni). I risultati dovrebbero essere disponibili dopo poche ore o giorni e consentire l’avvio di una terapia mirata. Tuttavia, con le tecniche di biologia molecolare, attualmente non è possibile rilevare la resistenza a tutti i farmaci disponibili. Inoltre, la resistenza non associata alle mutazioni genetiche rilevate dai test rapidi può essere trascurata. Pertanto, i risultati dei test biologici molecolari rapidi devono essere solitamente confermati dal test di resistenza fenotipica. Sempre più spesso, il sequenziamento dell’intero genoma sta fornendo ulteriori risultati e sta già sostituendo i test di resistenza fenotipica per i farmaci di prima linea in alcuni Paesi [14,15].
Nuove raccomandazioni diagnostiche dell’OMS
I risultati dei test biologici molecolari mostrano un buon accordo con i risultati fenotipici per alcuni farmaci [15]. Pertanto, dal 2020, l’OMS raccomanda i test rapidi biologici molecolari nella diagnostica iniziale dei patogeni e nella diagnostica della resistenza, a preferenza dei metodi microscopici e culturali. Questo vale in particolare per il NAAT Xpert® MTB/RIF e l’Xpert® MTB/RIF Ultra di Cepheid per la TB polmonare. Entrambi i test indicano la resistenza alla rifampicina, oltre alla diagnosi del patogeno. Secondo l’OMS, i test Truenat® MTB, MTB Plus e MTB-RIF Dx di Molbio possono essere utilizzati come alternativa. Per la diagnostica del liquor nei casi di sospetta meningite tubercolare, si raccomanda vivamente l’uso di Xpert® MTB/RIF Ultra come test iniziale. Per altri materiali di campionamento nei casi di sospetta tubercolosi extrapolmonare, i dati analizzati giustificano solo una debole raccomandazione, principalmente per lo Xpert MTB/RIF [7].
I cosiddetti saggi line probe (LPA), come quelli commercializzati da Hain Lifescience su , possono essere utilizzati per diagnosticare la resistenza alla rifampicina e all’isoniazide (GenoType® MTBDRplus) in campioni di espettorato microscopici o culturalmente positivi. Gli LPA per i farmaci di seconda linea (GenoType® MTBDRsl) possono essere utilizzati al posto dei test fenotipici per determinare la resistenza ai fluorochinoloni (FQ) e all’amikacina, quando è stata precedentemente rilevata la resistenza alla rifampicina. La stessa raccomandazione vale in caso di monoresistenza all’isoniazide prima di iniziare la terapia con i fluorochinoloni. Il test di resistenza fenotipica continua ad essere raccomandato dall’OMS quando non viene rilevata alcuna resistenza quando si esegue il test con gli LPA, ma la probabilità di una resistenza aggiuntiva oltre alla MDR-TB appare elevata [6,7].
Nell’anno in corso, l’OMS valuterà il nuovo test rapido NAAT Xpert® MTB/XDR per la determinazione simultanea della resistenza all’isoniazide, ai fluorochinoloni, all’amikacina, alla kanamicina, alla capreomicina e all’etionamide.
Sequenziamento
Il sequenziamento del genoma intero (WGS) è una tecnica che può anche rilevare mutazioni rare associate alla resistenza ai farmaci. Inoltre, il sequenziamento può essere applicato per analizzare i dati epidemiologici e per rintracciare l’origine dei focolai di tubercolosi [16–18]. Un test completo di resistenza fenotipica e genotipica, compreso il sequenziamento, è offerto dai laboratori di riferimento in Germania e dovrebbe essere effettuato almeno per ogni ceppo MDR-TB. Pertanto, l’interpretazione delle mutazioni geniche in termini di rilevanza clinica è impegnativa in molti casi ed è una parte essenziale degli attuali sforzi di ricerca per portare questa tecnologia ad un uso diffuso [19]. I laboratori di riferimento in Germania e Svizzera offrono ora il WGS.
Trattamento della tubercolosi con monoresistenza all’isoniazide
Si stima che circa l’8% della TBC nel mondo presenti resistenza all’INH senza resistenza all’RMP. Nel 2018, l’OMS ha quindi pubblicato una raccomandazione separata sulla terapia per la monoresistenza all’INH, raccomandando una terapia di 4 volte con levofloxacina insieme o al posto dell’INH per l’intera durata della terapia di 6 mesi [20,21]. Questa raccomandazione è stata adottata nel 2020 [22,23].
In Germania, la percentuale di ceppi resistenti all’INH era del 9,4% nel 2018 [4], e in Svizzera, secondo l’Ufficio federale della sanità pubblica, era del 6,2% dei ceppi di TB testati (Ufficio federale della sanità pubblica, comunicazione personale). La raccomandazione per la terapia della monoresistenza all’INH (Tab. 1) sarà rivalutata nell’aggiornamento già notificato della linea guida tedesca. Per il momento, tuttavia, le raccomandazioni del 2017 rimangono valide per il trattamento in Germania. Un prerequisito importante per il trattamento è il test rapido e affidabile della resistenza ai fluorochinoloni, spesso utilizzati in questa situazione.
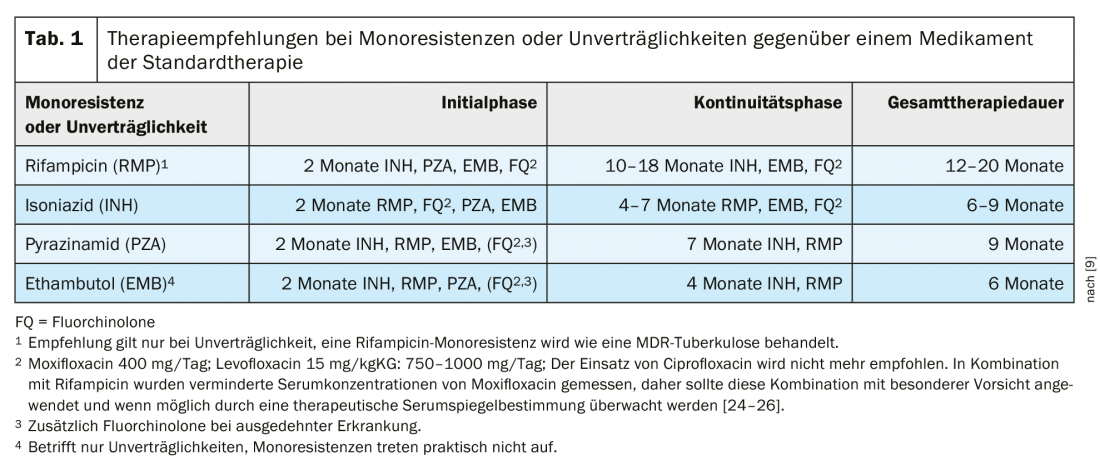
Trattamento della tubercolosi con monoresistenza o intolleranza alla rifampicina
Nelle raccomandazioni dell’OMS, la monoresistenza alla rifampicina è equiparata alla tubercolosi MDR. La resistenza alla rifampicina (RR) si verifica raramente senza resistenza all’isoniazide. Poiché l’assenza di rifampicina ha un grave impatto sul successo della terapia, nei documenti dell’OMS vengono spesso combinate MDR- e RR-TB. Le nuove raccomandazioni dell’OMS commentano che in caso di MDR/RR, l’uso di isoniazide ad alto dosaggio (10 -15 mg/kgKG) è possibile nel contesto della terapia MDR, in caso di provata sensibilità o resistenza di basso livello all’isoniazide [21]. L’attuale linea guida terapeutica tedesca raccomanda una terapia diversa dalla resistenza alla rifampicina per i pazienti con intolleranza alla rifampicina (Tab. 1).
Trattamento della tubercolosi multiresistente
Le raccomandazioni dell’OMS sono state inizialmente aggiornate nel 2019 sulla base delle prove esistenti [21]. Nel 2020, è seguito un aggiornamento completo delle raccomandazioni con il relativo Manuale Companion, che ha lo scopo di arricchire le raccomandazioni con aspetti pratici [22,23].
I farmaci disponibili per il trattamento della TBC farmaco-resistente sono stati classificati in nuovi gruppi dall’OMS dal 2018 (Tab. 2). Questa classificazione rimane valida con le nuove raccomandazioni del 2020. Soprattutto il nuovo farmaco bedaquilina, ma anche il linezolid, ricevono una priorità molto più alta con le nuove raccomandazioni. In questo contesto, la raccomandazione di una terapia completamente orale rappresenta un vero e proprio cambiamento di paradigma per la maggior parte dei pazienti.
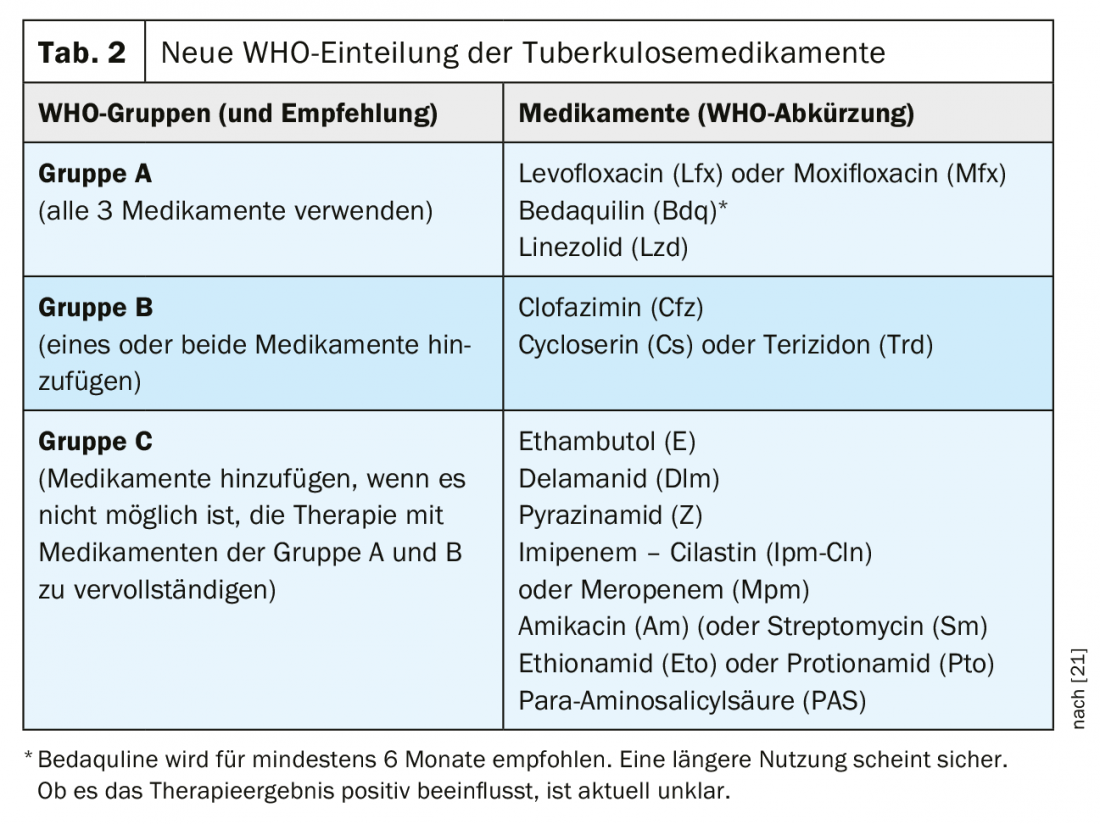
L’OMS raccomanda, per la terapia della tubercolosi MDR [27], una combinazione di almeno quattro farmaci con efficacia inizialmente molto probabile.
- Tutti e 3 i farmaci del gruppo A devono essere utilizzati, se possibile, e integrati da 1 farmaco del gruppo B.
- Se è possibile utilizzare solo 1 o 2 farmaci del gruppo A, allora si integrano entrambi i farmaci del gruppo B.
- Se non è possibile compilare una terapia completa a partire dai gruppi A e B, questa deve essere integrata dai farmaci del gruppo C.
La European Respiratory Society (ERS), l’American Thoracic Society (ATS) e la Infectious Disease Society of America (IDSA) raccomandano almeno cinque farmaci efficaci nella fase intensiva e quattro farmaci in seguito [28].
Purtroppo, con l’eccezione dei fluorochinoloni, i test di resistenza per i farmaci del gruppo A e B vengono effettuati solo nei laboratori di riferimento. Le nuove raccomandazioni dell’OMS suggeriscono ancora una durata di 18-20 mesi per questa terapia più lunga. Tuttavia, si commenta che la durata della terapia può essere adattata alla risposta individuale alla terapia MDR-TB. Per la maggior parte dei pazienti MDR-TB, una durata della terapia di 15-17 mesi dopo la conversione colturale dovrebbe essere sufficiente. Se si utilizza l’amikacina o la streptomicina, la fase intensiva con gli aminoglicosidi deve durare 6-7 mesi nella maggior parte dei casi [21].
Un’innovazione significativa è il declassamento degli aminoglicosidi nella terapia MDR-TB. L’OMS raccomanda di eliminarli dalla terapia, se possibile. Solo l’amikacina (in alternativa la streptomicina) deve essere ancora utilizzata se non ci sono altre possibilità di completare la terapia MDR-TB. La capreomicina e la kanamicina in genere non sono più raccomandate.
Con le nuove raccomandazioni dell’OMS del 2020, l’utilizzo della bedaquilina sarà ora
- oltre i 6 mesi,
- contemporaneamente al nuovo farmaco delamanid
- o durante la gravidanza
considerato sufficientemente sicuro. La base di dati per queste raccomandazioni era limitata, quindi deve essere possibile monitorare bene la terapia, soprattutto in queste situazioni [22,23].
Dichiarazione sulle raccomandazioni dell’OMS da una prospettiva tedesca
In seguito all’aggiornamento delle raccomandazioni dell’OMS nel 2019, il Centro di Ricerca Borstel (FZB) e il DZK hanno pubblicato una dichiarazione congiunta a sostegno delle nuove raccomandazioni dell’OMS.
Per il trattamento MDR in Germania, si raccomanda l’avvio di una terapia MDR composta da cinque farmaci con bedaquilina, linezolid, levo- o moxifloxacina, clofazimina e terizidone, dopo l’evidenza biologica molecolare della resistenza alla rifampicina e l’esclusione della resistenza ai fluorochinoloni (posizione 90, 91 e 94 del gene gyrA di tipo selvaggio). In caso di evidenza biologica molecolare di resistenza ai fluorochinoloni, si deve impiantare un sistema di porte endovenose e iniziare la terapia con bedaquilina, linezolid, clofazimina, terizidone, amikacina o meropenem/acido amossicillina-clavulanico. L’obiettivo rimane quello di somministrare inizialmente almeno cinque sostanze efficaci. La scelta di ulteriori farmaci del gruppo C deve essere effettuata in base ai risultati dei test di resistenza [29].
L’Amikacina è raccomandata solo per il trattamento di pazienti adulti con MDR/RR-TB:
- se non è possibile mettere insieme un regime terapeutico con farmaci dei gruppi A e B,
- I risultati dei test di resistenza suggeriscono che il farmaco è efficace e che si può garantire un attento monitoraggio per individuare precocemente lo sviluppo di effetti collaterali [29].
Tale monitoraggio è possibile nella maggior parte dei centri specializzati in Germania e Svizzera, per cui l’amikacina rimane un’opzione terapeutica. Le nuove raccomandazioni dell’OMS del 2020 sostengono questa posizione alle condizioni menzionate [22].
In Svizzera, non esistono raccomandazioni specifiche per la terapia della MDR-TB. Attualmente, l’Ufficio federale della sanità pubblica e la Lega polmonare raccomandano di consultare degli esperti in caso di resistenza alla rifampicina. Gli esperti possono essere contattati nei giorni feriali dalle 8 alle 12 e dalle 14 alle 17 tramite il numero telefonico gratuito della Lega polmonare svizzera 0800 388 388 . Guidato da loro, c’è un gruppo di esperti composto da medici, microbiologi e specialisti di salute pubblica che discutono casi complessi e rispondono alle domande dei professionisti su una piattaforma online.
Terapia a breve termine della tubercolosi multiresistente
Dal 2016, l’OMS raccomanda una terapia a breve termine di 9-12 mesi con una combinazione fissa di farmaci per alcuni pazienti MDR-TB selezionati e, con le nuove raccomandazioni, la preferisce alla terapia personalizzata più lunga [22,23,30]. Il prerequisito per questo trattamento a breve termine è la provata sensibilità dell’agente patogeno ai fluorochinoloni e idealmente a tutte le altre sostanze utilizzate. Inoltre, il paziente non deve essere stato trattato in precedenza con nessuno dei farmaci utilizzati per più di 1 mese. In Europa, questo vale probabilmente solo per pochi pazienti, poiché un’alta percentuale di casi di MDR-TB presenta una resistenza aggiuntiva [12,31]. Pertanto, attualmente in Germania non si può raccomandare un uso preferenziale della terapia a breve termine [9,29].
La combinazione di farmaci raccomandata dall’OMS nel 2016 conteneva aminoglicosidi, che non dovrebbero più essere utilizzati. Ora, dati recenti provenienti dal Sudafrica hanno dimostrato che la terapia a breve termine completamente orale con bedaquilina migliora i risultati del trattamento e porta a un minor numero di interruzioni del trattamento [32]. Per i pazienti con ceppi MDR-TB in cui è stata dimostrata la suscettibilità ai fluorochinoloni ed è indicata una terapia a breve termine, l’OMS raccomanda quindi di abbandonare gli aminoglicosidi a favore della bedaquilina dal 2020. La terapia orale completa a breve termine per 9-12 mesi deve includere bedaquilina, levo- o moxifloxacina, etionamide, etambutolo, pirazinamide, isoniazide ad alto dosaggio e clofazimina [22,23].
Nuova terapia di combinazione per la MDR-TB con resistenza ai fluorochinoloni
La terapia di combinazione di bedaquilina, pretomanide e linezolid (BPaL) per 6-9 mesi è stata approvata negli Stati Uniti per il trattamento della tubercolosi estesamente resistente (XDR-TB) e per il fallimento del trattamento della MDR-TB dal 14 agosto 2019. L’Agenzia Europea dei Medicinali ha approvato la pretonamide nel luglio 2020 per il trattamento della TB XDR o MDR in assenza di altre opzioni terapeutiche. Il nuovo nitroimidazolo Pretomanid è stato sviluppato dall’organizzazione no-profit TB-Alliance e la terapia combinata è stata testata su 109 pazienti in Sudafrica. Uno studio in aperto senza braccio di confronto (Nix-TB) ha portato all’approvazione, che è stata in grado di mostrare una buona efficacia con un successo terapeutico del 90% in situazioni di resistenza complicate [33].
L’OMS ha confrontato i dati dello studio Nix TB con quelli dei pazienti che hanno ricevuto bedaquilina e linezolid come parte della terapia combinata per una media di 21-26 mesi. Entrambi i gruppi hanno mostrato un ottimo successo terapeutico del 97% (BPaL) e del 92% (gruppo di confronto) [23]. L’analisi dei dati dello studio Nix-TB ha mostrato che gli effetti collaterali gravi con BPaL possono verificarsi nel 25% dei pazienti. Il linezolid è stato utilizzato nello studio Nix-TB al dosaggio di 1200 mg al giorno. Questo dosaggio è approvato per altre infezioni batteriche con una durata di terapia più breve. Le reazioni avverse al farmaco correlate alla dose, come la depressione del midollo osseo e la neuropatia periferica, si sono verificate con una frequenza corrispondente nello studio Nix-TB. In base all’esperienza dello studio, il dosaggio di linezolid può essere ridotto a 600-300 mg dopo 4 settimane di terapia ad alto dosaggio, in caso di effetti collaterali rilevanti. Sembra possibile anche un’interruzione della terapia fino a 35 giorni . La durata totale della terapia con BPaL deve essere di almeno 6 mesi. Se la conversione della coltura dell’espettorato non è stata raggiunta dopo 4 mesi, la durata della terapia deve essere estesa a 9 mesi [23].
L’OMS raccomanda l’uso del BPaL solo per i pazienti MDR-TB con resistenza ai fluorochinoloni, per i quali non è possibile mettere insieme altre terapie. Inoltre, l’uso deve avvenire in condizioni di studio e non deve essere stata effettuata una terapia precedente con bedaquilina o linezolid per più di 2 settimane [23].
Attualmente sono in corso ulteriori studi con l’obiettivo di migliorare la tollerabilità della combinazione di farmaci. Per esempio, lo studio ZeNix sta testando diverse dosi di linezolid.
Conclusione e prospettive
L’incidenza globale della tubercolosi (TB) sta attualmente diminuendo del 2% all’anno. Questa diminuzione è lungi dall’essere sufficiente per raggiungere gli obiettivi della strategia EndTB dell’OMS [2]. La resistenza ai farmaci è un ostacolo significativo in questo caso. Le modifiche alle raccomandazioni terapeutiche dell’OMS per la MDR-TB qui riassunte sono il gradito risultato della crescente ricerca in questo settore. La creazione di una diagnostica molecolare e l’approvazione di tre nuovi farmaci per il trattamento della M/XDR-TB (bedaquilina, delamanid e pretomanid) rappresentano importanti successi. Tuttavia, il numero di casi di MDR-TB stimati annualmente non sta diminuendo a un ritmo sufficiente e solo il 51% dei casi di TB confermati a livello globale sono stati testati per la resistenza alla rifampicina nel 2018.
In Germania e Svizzera, il numero di casi di MDR-TB è basso e sono disponibili risorse sufficienti. La terapia viene individualizzata dopo un’approfondita analisi della resistenza e può portare a un miglioramento del successo terapeutico [34,35]. Tuttavia, le maggiori sfide del controllo della TBC nel 21° secolo riguardano principalmente i Paesi ad alta incidenza con risorse limitate. Oltre a ulteriori sviluppi innovativi nella diagnostica e nella terapia, la prevenzione e in particolare lo sviluppo di una vaccinazione efficace saranno di importanza decisiva nella lotta contro la tubercolosi. C’è un’urgente necessità di migliorare l’accesso globale alle opzioni diagnostiche e terapeutiche esistenti e nuove per tutti.
Messaggi da portare a casa
- La tubercolosi è una malattia rara in Svizzera, ma 10 milioni di persone nel mondo contraggono la tubercolosi ogni anno.
- Nella tubercolosi multiresistente, i due farmaci più importanti nella terapia della tubercolosi, l’isoniazide e la rifampicina, non sono più efficaci.
- In Germania e in Svizzera, la terapia è personalizzata dopo un approfondito test di resistenza.
- I metodi biologici molecolari consentono una diagnosi rapida per l’avvio di una terapia mirata. Attualmente, i risultati dovrebbero essere ancora confermati da test fenotipici.
- La complessa e lunga terapia della tubercolosi MDR deve essere guidata da esperti. Servizi di consulenza gratuiti sono disponibili presso la Lega polmonare svizzera (tel.: 0800 388 388).
Letteratura:
- Prideaux B, et al.: L’associazione tra l’attività sterilizzante e la distribuzione del farmaco nelle lesioni della tubercolosi. Nat Med 2015; 21(10): 1223-1227.
- Rapporto globale sulla tubercolosi 2019. Ginevra: Organizzazione Mondiale della Sanità 2019. Licenza: CC BY-NC-SA 3.0 IGO.
- Rapporto globale sulla tubercolosi 2018, Organizzazione Mondiale della Sanità, Ginevra.
- Rapporto sull’epidemiologia della tubercolosi in Germania per il 2018. Istituto Robert Koch 2019.
- Mase SR, et al: Rendimento degli esami seriali dei campioni di espettorato nella diagnosi di tubercolosi polmonare: una revisione sistematica. Int J Tuberc Lung Dis 2007; 11(5): 485-495.
- Manuale operativo dell’OMS sulla tubercolosi. Modulo 3: diagnosi – diagnostica rapida per l’individuazione della tubercolosi. Ginevra: Organizzazione Mondiale della Sanità 2020. Licenza: CC BY-NC-SA 3.0 IGO.
- Linee guida consolidate dell’OMS sulla tubercolosi. Modulo 3: diagnosi – diagnosi rapida per il rilevamento della tubercolosi. Ginevra: Organizzazione Mondiale della Sanità 2020. Licenza: CC BY-NC-SA 3.0 IGO.
- Tostmann A, et al: Trasmissione della tubercolosi da parte di pazienti con tubercolosi polmonare negativa allo striscio in un’ampia coorte nei Paesi Bassi. Clin Infect Dis 2008; 47(9): 1135-1142.
- Schaberg T, et al.: Linea guida sulla tubercolosi per gli adulti – Linea guida per la diagnosi e il trattamento della tubercolosi, compresi i test e il trattamento LTBI del Comitato centrale tedesco (DZK) e della Società respiratoria tedesca (DGP). Pneumologia 2017; 71(6): 325-397.
- Lange CI, Abukabar I, Alffenaar JW: Gestione dei pazienti con tubercolosi multiresistente/estensivamente resistente ai farmaci in Europa: una dichiarazione di consenso TBNET. 2014.
- OMS, Rapporto tecnico sulle concentrazioni critiche per i test di suscettibilità ai farmaci anti-TBC dei medicinali utilizzati nel trattamento della TBC resistente ai farmaci. 2018.
- Otto-Knapp R, et al: Resistenza ai farmaci di seconda linea nei migranti con tubercolosi multiresistente ai farmaci nella regione di Berlino. Pneumologia 2014; 68: 496-500.
- Lange C, et al: Gestione dei pazienti con tubercolosi multiresistente/estensivamente resistente ai farmaci in Europa: una dichiarazione di consenso TBNET. European Respiratory Journal 2014; 44: 23-63.
- Servizio Nazionale Infezioni di Public Health England. National Mycobacterium Reference Service-South (NMRS-South). Manuale d’uso 2019.
- Allix-Beguec C, et al: Previsione della suscettibilità ai farmaci di prima linea contro la tubercolosi mediante sequenziamento del DNA. N Engl J Med 2018; 379(15): 1403-1415.
- Galagan JE: Approfondimenti genomici sulla tubercolosi. Nat Rev Genet 2014; 15(5): 307-320.
- Nikolayevskyy V, et al: Sequenziamento dell’intero genoma del Mycobacterium tuberculosis per il rilevamento della trasmissione recente e il tracciamento dei focolai: una revisione sistematica. Tubercolosi (Edinb) 2016; 98: 77-85.
- Merker M, et al: L’evoluzione della tipizzazione dei ceppi nel complesso del Mycobacterium tuberculosis. Adv Exp Med Biol 2017; 1019: 43-78.
- Meehan CJ, et al: Sequenziamento dell’intero genoma del Mycobacterium tuberculosis: standard attuali e problemi aperti. Nat Rev Microbiol 2019; 17(9): 533-545.
- OMS, Linee guida dell’OMS per il trattamento della tubercolosi resistente all’isoniazide: Supplemento alle Linee guida dell’OMS per il trattamento della tubercolosi resistente ai farmaci 2018; Organizzazione Mondiale della Sanità: Ginevra.
- OMS, Linee guida consolidate dell’OMS sul trattamento della tubercolosi resistente ai farmaci 2019; Organizzazione Mondiale della Sanità Ginevra
- Linee guida consolidate dell’OMS sulla tubercolosi. Modulo 4: trattamento – trattamento della tubercolosi resistente ai farmaci. Ginevra: Organizzazione Mondiale della Sanità 2020. Licenza: CC BY-NC-SA 3.0 IGO.
- Manuale operativo dell’OMS sulla tubercolosi. Modulo 4: trattamento – trattamento della tubercolosi resistente ai farmaci. Ginevra: Organizzazione Mondiale della Sanità 2020. Licenza: CC BY-NC-SA 3.0 IGO.
- Weiner M, et al.: Effetti della rifampicina e del polimorfismo del gene della resistenza ai farmaci sulle concentrazioni di moxifloxacina. Antimicrob Agents Chemother 2007; 51(8): 2861-2866.
- Nijland HM, et al.: La rifampicina riduce le concentrazioni plasmatiche della moxifloxacina nei pazienti con tubercolosi. Clin Infect Dis 2007; 45(8): 1001-1007.
- Alsultan A, Peloquin CA: Monitoraggio terapeutico dei farmaci nel trattamento della tubercolosi: un aggiornamento. Farmaci 2014; 74(8): 839-854.
- Ahmad N, et al: Correlazioni del trattamento con esiti positivi nella tubercolosi polmonare multiresistente ai farmaci: una meta-analisi dei dati del singolo paziente. Lancet 2018; 392(10150): 821-834.
- Nahid P, et al: Trattamento della tubercolosi resistente ai farmaci. Una linea guida ufficiale di pratica clinica ATS/CDC/ERS/IDSA. Am J Respir Crit Care Med 2019; 200(10): e93-e142.
- Maurer B, et al.: Dichiarazione congiunta sulla nuova raccomandazione dell’OMS sul trattamento della tubercolosi multiresistente e resistente alla rifampicina. Pneumologia 2019; 1-4 (in stampa).
- Linee guida OMS per il trattamento della tubercolosi resistente ai farmaci – Aggiornamento 2016.
- Günther G, et al: Tubercolosi multiresistente in Europa, 2010-2011. Malattie infettive emergenti 2015; 21: 409-416.
- Comunicazione rapida: cambiamenti chiave nel trattamento della tubercolosi resistente ai farmaci. Ginevra: Organizzazione Mondiale della Sanità 2019 (OMS/CDS/TB/2019.26). Licenza: CC BY-NC-SA 3.0 IGO.
- Conradie F, et al: Trattamento della tubercolosi polmonare altamente resistente ai farmaci. New England Journal of Medicine 2020; 382(10): 893-902.
- Olaru ID, et al: Regime di trattamento basato sulla bedaquilina per la tubercolosi multiresistente ai farmaci. Eur Respir J 2017; 49(5).
- Heyckendorf J, et al: Guarigione senza recidiva da tubercolosi multiresistente in Germania. Eur Respir J 2018; 51(2).
InFo PNEUMOLOGIA & ALLERGOLOGIA 2020: 2(3): 6-11