Le terapie innovative hanno migliorato la prognosi di molte malattie oncologiche. Un limite importante per la prognosi individuale sono le complicanze cardiovascolari associate alla malattia e alla terapia. Anche gli eventi rari possono avere conseguenze serie.
Negli ultimi anni, le terapie innovative hanno migliorato in modo significativo la prognosi di molte malattie oncologiche. Un limite importante per la prognosi individuale dopo una terapia oncologica di successo sono le complicazioni cardiovascolari associate alla malattia e alla terapia. Nonostante gli effetti cardiotossici delle terapie oncologiche, alcuni dei quali sono noti da tempo, ci sono solo pochi dati sulla stratificazione del rischio e sui trattamenti specifici. Questo vale per le terapie sistemiche classiche (ad esempio, antracicline, taxani o immunomodulatori), ma soprattutto per le terapie più recenti (ad esempio, inibitori del checkpoint o inibitori del proteasoma). Utilizzando gli inibitori BRAF/MEK come esempio, di seguito verranno discusse le sfide terapeutiche dal punto di vista della cardio-oncologia.
Esempio di melanoma maligno
Il melanoma maligno viene diagnosticato frequentemente negli uomini e nelle donne ed è, ad esempio, la quarta manifestazione più comune di un nuovo cancro in Svizzera, secondo il rapporto 2017 della Lega contro il cancro. Le mutazioni negli oncogeni sono spesso coinvolte in modo causale nello sviluppo dei melanomi maligni. Le mutazioni BRAF si trovano in circa la metà dei melanomi non resecabili o metastatici. Fino a poco tempo fa, i pazienti affetti avevano poche opzioni di trattamento con tassi di risposta inferiori al 20%. Secondo la linea guida del 2016, si raccomanda quindi la terapia con un inibitore BRAF/MEK [1].
BRAF è una serina/treonina chinasi citoplasmatica che svolge un ruolo regolatore nella regolazione della crescita cellulare all’interno del percorso Ras-Raf-MEK1-ERK1/2. La mutazione di gran lunga più frequente riguarda il codone 600. Il 90% delle mutazioni cambia la valina in acido glutammico (V600E) [2] con conseguente attivazione incontrollata. Questo ha portato allo sviluppo di inibitori specifici: vemurafenib e dabrafenib, oltre agli inibitori della chinasi MEK a valle: trametinib e cobimetinib. Negli studi clinici, la combinazione di preparati di entrambi i gruppi di sostanze è stata in grado di mostrare un beneficio aggiuntivo significativo per quanto riguarda la sopravvivenza libera da progressione e la sopravvivenza globale [3]. Ad esempio, nei pazienti con melanoma metastatico non trattato e mutazione BRAF V600E o V600K, è stata riscontrata una sopravvivenza mediana libera da progressione di 7,3 mesi con la monoterapia con vemurafenib, rispetto agli 11,4 mesi del gruppo di terapia combinata con dabrafenib e trametinib [4]. Gli inibitori MEK da soli, come dimostrato per trametinib, hanno dimostrato in precedenza di migliorare la sopravvivenza mediana libera da progressione a 4,8 mesi rispetto a 1,5 mesi come endpoint primario rispetto alla chemioterapia convenzionale. Una panoramica semplificata degli inibitori è riportata nella Figura 1.

Sono emersi diversi effetti avversi degli inibitori di BRAF e MEK. Vemurafenib ha mostrato principalmente artralgia, rash, affaticamento, alopecia, fotosensibilità, nausea, cheratoacantoma o carcinoma a cellule squamose nello studio di fase III BRIM-3 [5]. Dabrafenib ha mostrato manifestazioni cutanee in particolare, paragonabili agli effetti avversi riportati di vemurafenib, con la febbre vista come una complicanza più frequente nei pazienti trattati con dabrafenib [6].
Dati clinici sugli effetti collaterali cardiaci
Da un punto di vista clinico, da un lato la funzione cardiaca, rappresentata dalla frazione di eiezione ventricolare sinistra (LVEF), e dall’altro le aritmie di recente insorgenza e potenzialmente maligne (tachicardia ventricolare, fibrillazione ventricolare) sono rilevanti per la prognosi individuale. Negli studi clinici, un prolungamento del tempo QT è considerato un indicatore del potenziale verificarsi di aritmie maligne.
Una riduzione della LVEF nella terapia combinata (dabrafenib e trametinib) è stata osservata nell’8% dei pazienti; nel 3% dei pazienti questo ha portato all’interruzione dello studio. La metà dei pazienti colpiti (circa il 4%) presentava un grado maggiore di compromissione della LVEF. Non c’è stata alcuna diminuzione della LVEF nel gruppo di monoterapia con vemurafenib. Tuttavia, i pazienti con un’insufficienza cardiaca preesistente corrispondente a NYHA II o superiore sono stati esclusi dallo studio, per cui i dati non sono generalmente trasferibili ad altre collettività [4]. I tassi di interruzione dello studio sono stati paragonabili in entrambi i gruppi, dal 12 al 13%, così come la tossicità complessiva.
In uno studio comparabile, il 2% dei pazienti nel gruppo di monoterapia con dabrafenib ha mostrato una riduzione della LVEF, mentre il 4% dei pazienti nel gruppo di terapia combinata (dabrafenib e trametinib) ha mostrato una riduzione della LVEF [7]. Anche la combinazione di vemurafenib e dell’inibitore MEK cobimetinib ha comportato un aumento dei tassi di compromissione della LVEF (8% vs. 3% nel rispettivo gruppo) rispetto alla monoterapia [8]. Come nel caso delle terapie di combinazione descritte con gli inibitori BRAF, il peggioramento della LVEF si è verificato in una percentuale comparabile del 7% con la monoterapia con trametinib, con l’1% dei pazienti che ha dovuto interrompere lo studio a causa dello sviluppo di una LVEF altamente compromessa [9].
Altri effetti collaterali cardiaci sono stati osservati nel prolungamento del tempo QT (ad esempio nello studio di fase II BRIM-2). Tuttavia, non è stata riscontrata alcuna induzione di un episodio ritmico pericoloso per la vita [10]. In coorti più ampie, sono stati riscontrati prolungamenti QT rilevanti superiori a 480 ms nel 7% dei pazienti, senza evidenza di aritmie maligne. Nello 0,5% dei casi, il trattamento con vemurafenib è stato interrotto a causa del prolungamento del QT [11]. Larkin et al. Inoltre, in un ampio collettivo (3222 pazienti), sono stati riportati tempi QT prolungati nel 10% dei casi, oltre 500 ms nel 2% e due pazienti con aritmie rilevanti [12].
In sintesi, gli effetti collaterali cardiaci con limitazioni della LVEF sono in gran parte dovuti all’aggiunta di inibitori MEK. L’entità degli effetti avversi cardiaci è paragonabile nella terapia con inibitori MEK da soli e nella terapia combinata con inibitori BRAF. D’altra parte, la terapia combinata in particolare è superiore in termini di esito oncologico, soprattutto per quanto riguarda la sopravvivenza libera da progressione e l’insorgenza di secondi tumori della pelle.
Oltre alla riduzione della LVEF e al prolungamento del tempo QT, sono stati descritti aumenti della pressione sanguigna con un’incidenza del 15-25% per le sostanze. A differenza della restrizione della LVEF o del verificarsi di un tempo QT prolungato, le misure terapeutiche con i comuni farmaci antipertensivi e i controlli clinici mediante la misurazione della pressione sanguigna sono facili da ricavare nel caso dell’ipertensione.
Cosa possiamo imparare dai modelli preclinici ?
Le vie di segnalazione molecolare delle protein chinasi attivanti il mitogeno (MAP chinasi) nel cardiomiocita sono state ampiamente studiate a livello cellulare e nei modelli animali. In base a ciò, l’attivazione della via Ras-Raf-MEK1-ERK1/2 nei cardiomiociti è associata alla mediazione dell’ipertrofia cellulare e dell’apoptosi. I membri della cascata di segnalazione interagiscono con una serie di altre MAP chinasi, come la C-Jun N-terminal kinase (JNK), la p38 e la chinasi 5 regolata dal segnale extracellulare (ERK5) [13]. Classicamente, l’attivazione di ERK1/2 è associata ai processi di crescita, mentre le MAP chinasi JNK e p38 sono più probabilmente attivate nel contesto di stimoli patologici. L’attivazione artificiale della via MEK1-ERK1/2 è quindi più probabile che sia cardioprotettiva, mentre l’attivazione di altre MAP chinasi, come p38 o JNK, è più probabile che porti a effetti cardiaci negativi [14].
Le mutazioni nel percorso ERK1/2, in particolare la fosfatasi genitore ERK1/2 PTPN11 e la proteina G K-RAS, sono causalmente associate a difetti cardiaci congeniti come le sindromi di Noonan e LEOPARD. In queste sindromi sono stati descritti disturbi cardiaci e difetti del setto, ma soprattutto cardiomiopatie ipertrofiche.
L’inattivazione di PTNP11 (mutazione Y279C) nei topi fenoca la sindrome cardio-facio-cutanea, compreso lo sviluppo di una cardiomiopatia ipertrofica primaria, che progredisce in cardiomiopatia dilatativa con l’avanzare dell’età degli animali [15]. Nel modello murino, la cardiomiopatia ipertrofica potrebbe essere innescata anche da Raf1-L613V-knock-in, una mutazione della sindrome di Noonan umana [16]. In risposta all’aumento del carico di volume, i topi hanno mostrato una maggiore formazione di fibrosi cardiaca interstiziale e perivascolare e una sopravvivenza globale significativamente ridotta. L’attività di MEK ed ERK è più inducibile nel “knock-in” con legame al legante, di conseguenza il fenotipo cardiaco descritto potrebbe essere prevenuto dalla terapia con un inibitore di MEK.
L’iperattivazione artificiale con la sovraespressione cardiaca di MEK1, invece, porta a un’ipertrofia cardiaca compensata senza, almeno nei modelli animali, un aumento della letalità. La LVEF è stata migliorata ecocardiograficamente anche con una funzione diastolica compromessa. ERK1/2 è stata regolata nel modello transgenico MEK1 [17]. L’attivazione della via Raf-1/MEK/ERK è necessaria anche per l’ipertrofia cardiaca durante l’aumento del carico di pressione [18]. Nei processi di rimodellamento patologico nel contesto dell’infarto miocardico, l’attivazione della via di segnalazione ERK ha portato anche alla cardioprotezione.
Nel complesso, emerge un quadro complesso dei benefici e degli effetti negativi delle singole MAP chinasi, con un effetto pronunciato sull’ipertrofia cardiaca nella maggior parte dei lavori. I cambiamenti consecutivi (apoptosi, fibrosi, disfunzione cardiaca) derivano da un’ulteriore induzione di stress o dalla sovraattivazione di singole vie di segnalazione (tab. 1).
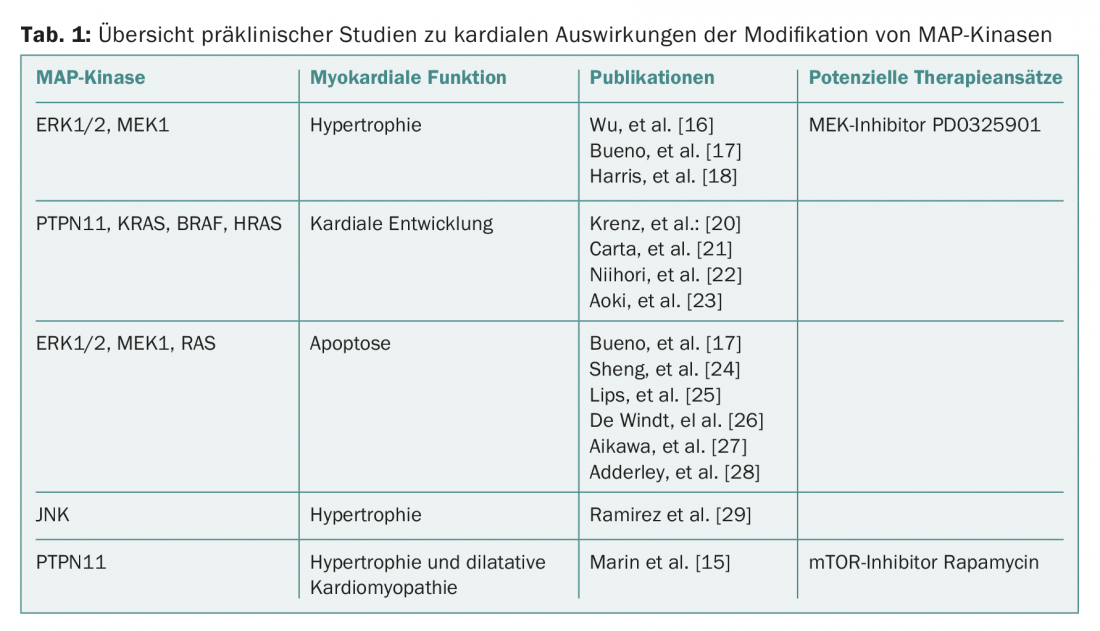
In parte, le osservazioni cliniche sulla cardiotossicità dell’inibizione di MEK possono essere replicate. L’intervento selettivo nella via di segnalazione Ras-Raf-MEK-ERK1/2 o nelle vie di segnalazione associate – come dimostrato per l’inibizione di mTOR con la rapamicina – potrebbe essere un approccio futuro per ridurre gli effetti collaterali cardiaci nel contesto delle terapie oncologiche con inibizione di BRAF/MEK. Si può anche ipotizzare che l’imaging di ultima generazione (ad esempio, la risonanza magnetica cardiaca o l’ecocardiografia 3D) possa identificare prima i pazienti con attivazione delle vie pro-ipertrofiche.
Conclusione per la pratica
Gli effetti collaterali cardiaci degli inibitori BRAF/MEK sono stati finora documentati in un numero relativamente piccolo di pazienti, in una percentuale a una cifra. Tuttavia, in caso di insorgenza, queste possono portare a gravi conseguenze e all’interruzione della terapia. La biologia molecolare ha rivelato un quadro diverso delle singole MAP chinasi, in particolare per quanto riguarda l’ipertrofia cardiaca e l’apoptosi. Ciò che non è chiaro sono le esatte condizioni di stress cardiaco e i fattori predisponenti di un paziente che portano a un peggioramento clinicamente significativo della LVEF durante la terapia. Per questo motivo, è necessario un monitoraggio cardiaco attento ed efficiente dei pazienti prima e durante la terapia di inibizione BRAF/MEK, in modo che i pazienti affetti (deterioramento della LVEF, prolungamento del tempo QT, ipertensione arteriosa) possano essere trattati immediatamente dai cardiologi. Se necessario, la terapia oncologica può essere proseguita sotto stretto monitoraggio.
Secondo la linea guida ESC, il trattamento degli effetti cardiotossici consiste innanzitutto nel minimizzare i fattori di rischio cardiovascolare, idealmente prima di iniziare una terapia (chemio)potenzialmente cardiotossica. Per esempio, potrebbe essere necessario un attento monitoraggio della pressione sanguigna. Il lavoro preclinico suggerisce anche un ruolo per i co-stressori. Se la LVEF è limitata, si ricorre alla terapia dell’insufficienza cardiaca con beta-bloccanti e ACE-inibitori come farmaci di prima linea. I dati preclinici suggeriscono che anche la via beta-adrenergica cardiaca agisce tramite MEK e potrebbe essere influenzata favorevolmente con il blocco. Nel caso di una limitazione nota della LVEF o di un profilo di rischio elevato, può essere presa in considerazione una terapia profilattica dell’insufficienza cardiaca [19].
Un attento monitoraggio dei biomarcatori cardiaci (troponina e NT-BNP) e un regolare monitoraggio dell’ECG (soprattutto prolungamento del QT, aritmie) durante la terapia possono fornire indicazioni precoci di una reazione cardiotossica. Inoltre, i sintomi clinici dell’insufficienza cardiaca, come l’edema o la dispnea, devono essere valutati regolarmente. Un esame cardiologico, compresa l’ecocardiografia, deve essere effettuato ogni 12 settimane durante la terapia. Oltre alla LVEF sistolica, possono emergere riduzioni precoci della funzione diastolica o longitudinale o aumenti della pressione arteriosa polmonare. In base ai rapporti sui casi, si può ipotizzare una comparsa precoce di disfunzione cardiaca per gli inibitori di MEK entro i primi 14 giorni dall’inizio della terapia. Un controllo precoce con l’ecocardiografia e i marcatori cardiaci sembra quindi ragionevole. Un possibile schema per la cura dei pazienti ad alto rischio a causa della terapia o di fattori predisponenti è riportato nella figura 2.
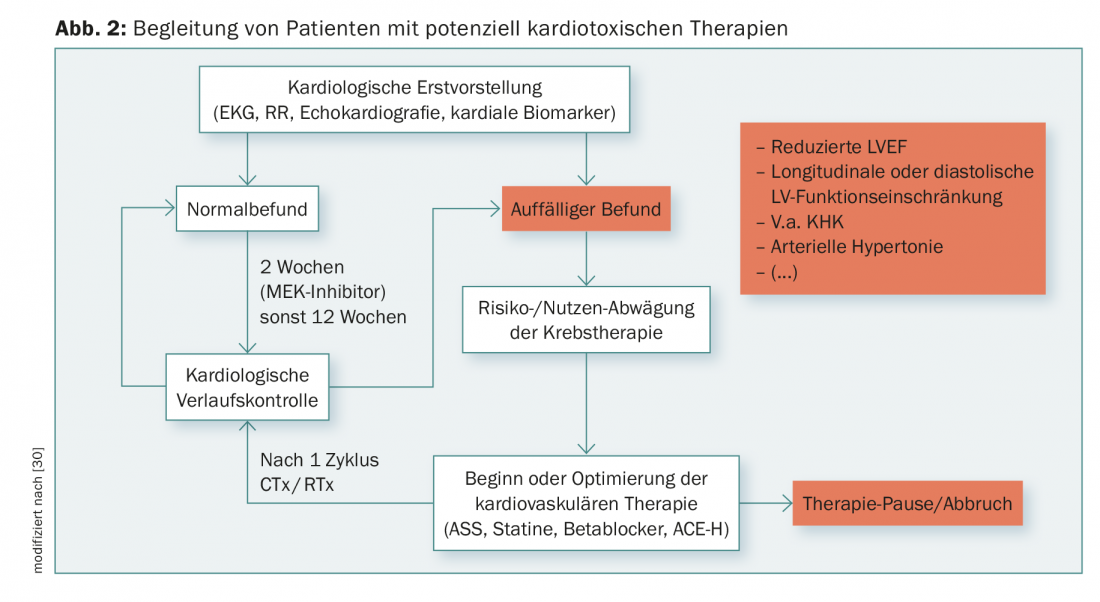
In futuro, sulla base delle conoscenze molecolari, potranno essere identificati bersagli specifici delle MAP chinasi e delle vie di segnalazione associate, il che renderà possibile un trattamento efficace degli effetti collaterali cardiaci.
Messaggi da portare a casa
- Gli effetti collaterali cardiaci dell’inibizione di BRAF/MEK sono stati finora a una cifra percentuale. Quando si verificano, tuttavia, possono portare a conseguenze gravi e all’interruzione della terapia.
- Secondo l’ESC, il trattamento degli effetti cardiotossici consiste innanzitutto nel ridurre al minimo i fattori di rischio cardiovascolare – idealmente prima di iniziare una terapia potenzialmente cardiotossica.
- In seguito, l’attento monitoraggio dei biomarcatori cardiaci, nonché il controllo regolare dell’ECG e la valutazione dei sintomi clinici durante la terapia possono fornire indicazioni precoci di una reazione cardiotossica.
- Un approccio interdisciplinare da parte degli oncologi e dei cardiologi curanti migliora la prognosi cardiaca individuale.
Letteratura:
- Dummer R, et al: Le linee guida svizzere aggiornate 2016 per il trattamento e il follow-up del melanoma cutaneo. Swiss Med Wkly 2016; 146: w14279.
- Cheng L, et al: Test molecolari per le mutazioni BRAF per informare le decisioni di trattamento del melanoma: un passo verso la medicina di precisione. Mod Pathol 2018; 31(1): 24-38.
- Long GV, et al: Dabrafenib e trametinib rispetto a dabrafenib e placebo per il melanoma BRAF-mutante Val600: studio randomizzato controllato di fase 3, multicentrico, in doppio cieco. Lancet 2015; 386(9992): 444-451.
- Robert C, et al: Miglioramento della sopravvivenza globale nel melanoma con la combinazione di dabrafenib e trametinib. N Engl J Med 2015; 372(1): 30-39.
- Chapman PB, et al: Miglioramento della sopravvivenza con vemurafenib nel melanoma con mutazione BRAF V600E. N Engl J Med 2011; 364(26): 2507-2516.
- Hauschild A, et al: Dabrafenib nel melanoma metastatico BRAF-mutato: uno studio randomizzato controllato multicentrico, open-label, di fase 3. Lancet 2012; 380(9839): 358-365.
- Long GV, et al: Inibizione combinata di BRAF e MEK rispetto alla sola inibizione di BRAF nel melanoma. N Engl J Med 2014; 371(20): 1877-1888.
- Larkin J, et al: Vemurafenib e cobimetinib combinati nel melanoma BRAF-mutato. N Engl J Med 2014; 371(20): 1867-1876.
- Flaherty KT, et al: Miglioramento della sopravvivenza con l’inibizione di MEK nel melanoma BRAF-mutato. N Engl J Med 2012; 367(2): 107-114.
- Ribas A, et al: BRIM-2: uno studio multicentrico di fase II in aperto di vemurafenib in pazienti precedentemente trattati con melanoma metastatico positivo alla mutazione BRAF V600E. Journal of Clinical Oncology 2011; 29(15 suppl): 8509-8509.
- Flaherty L, et al: Uno studio a braccio singolo, in aperto, ad accesso allargato di vemurafenib nei pazienti con melanoma metastatico negli Stati Uniti. Cancer J 2014; 20(1): 18-24.
- Larkin J, et al: Vemurafenib nei pazienti con melanoma metastatico BRAF(V600) mutato: uno studio in aperto, multicentrico, sulla sicurezza. Lancet Oncol 2014; 15(4): 436-444.
- Wang Y: Le protein chinasi attivate dal mitogeno nello sviluppo e nelle malattie del cuore. Circolazione 2007; 116(12): 1413-1423.
- Molkentin JD: Confronto tra le vie di segnalazione buone e cattive nel cuore: ruolo della calcineurina e del fattore nucleare delle cellule T attivate. Circ Res 2013; 113(1): 16-19.
- Marin TM, et al: La rapamicina inverte la cardiomiopatia ipertrofica in un modello murino di mutazione PTPN11 associata alla sindrome di LEOPARD. J Clin Invest 2011; 121(3): 1026-1043.
- Wu X, et al: la modulazione del percorso MEK-ERK migliora i fenotipi della malattia in un modello murino della sindrome di Noonan associato alla mutazione Raf1(L613V). J Clin Invest 2011; 121(3): 1009-1025.
- Bueno OF, et al: La via di segnalazione MEK1-ERK1/2 promuove l’ipertrofia cardiaca compensata nei topi transgenici. EMBO J 2000; 19(23): 6341-6350.
- Harris IS, et al: la chinasi Raf-1 è necessaria per l’ipertrofia cardiaca e la sopravvivenza dei cardiomiociti in risposta al sovraccarico di pressione. Circolazione 2004; 110(6): 718-723.
- Zamorano JL, et al.: Documento di posizione ESC 2016 sui trattamenti antitumorali e la tossicità cardiovascolare, sviluppato sotto gli auspici del Comitato ESC per le linee guida pratiche: la Task Force per i trattamenti antitumorali e la tossicità cardiovascolare della Società Europea di Cardiologia (ESC). Eur Heart J 2016; 37(36): 2768-2801.
- Krenz M, Yutzey KE, Robbins J: La mutazione Q79R della sindrome di Noonan in Shp2 aumenta la proliferazione delle cellule mesenchimali della primordia valvolare attraverso la segnalazione della chinasi 1/2 regolata dal segnale extracellulare. Circ Res 2005; 97(8): 813-820.
- Carta C, et al: Le mutazioni missense germinali che interessano l’isoforma B di KRAS sono associate a un fenotipo grave di sindrome di Noonan. Am J Hum Genet 2006; 79(1): 129-135.
- Niihori T, et al: Mutazioni germinali KRAS e BRAF nella sindrome cardio-facio-cutanea. Nat Genet 2006; 38(3): 294-296.
- Aoki Y, et al.: Mutazioni germinali nel proto-oncogene HRAS causano la sindrome di Costello. Nat Genet 2005; 37(10): 1038-1040.
- Sheng Z, et al.: Inibizione dell’apoptosi dei miociti cardiaci da parte della Cardiotrofina 1 (CT-1) attraverso un percorso dipendente dalla proteina chinasi attivata dal mitogeno. Divergenza dai segnali a valle del CT-1 per l’ipertrofia delle cellule miocardiche. J Biol Chem 1997; 272(9): 5783-5791.
- Lips DJ, et al: la via di segnalazione MEK1-ERK2 protegge il miocardio dal danno ischemico in vivo. Circolazione 2004; 109(16): 1938-1941.
- De Windt LJ, et al: L’ipertrofia mediata dalla calcineurina protegge i cardiomiociti dall’apoptosi in vitro e in vivo: un modello di insufficienza cardiaca dilatativa indipendente dall’apoptosi. Circ Res 2000; 86(3): 255-263.
- Aikawa R, et al.: Lo stress ossidativo attiva le chinasi regolate dal segnale extracellulare attraverso Src e Ras nei miociti cardiaci coltivati di ratti neonati. J Clin Invest 1997; 100(7): 1813-1821.
- Adderley SR, Fitzgerald DJ: Il danno ossidativo dei cardiomiociti è limitato dall’induzione mediata dalle chinasi regolate extracellulari 1/2 della ciclossigenasi-2. J Biol Chem 1999; 274(8): 5038-5046.
- Ramirez MT, et al: Il percorso MEKK-JNK è stimolato dal recettore alfa1-adrenergico e dall’attivazione di ras ed è associato all’ipertrofia cardiaca in vitro e in vivo. J Biol Chem 1997; 272(22): 14057-14061.
- Tilemann LM, et al: Cardio-oncologia: priorità contrastanti del trattamento antitumorale ed esito cardiovascolare. Clin Res Cardiol 2018; 107(4): 271-280.
InFo ONCOLOGIA & EMATOLOGIA 2018; 6(4): 8-12.











