Le piccole modifiche apportate nell’aggiornamento BCLC 2022 possono avere un grande impatto nella terapia locale dei pazienti con HCC in stadio da 0 a C. Le terapie combinate e ulteriori misure interdisciplinari mostrano miglioramenti curativi. Quali pazienti sono adatti a quali tipi di terapia in quale fase della malattia viene spiegato sulla base delle possibilità, dei limiti e delle prospettive future delle terapie locoregionali nell’HCC.
Un’attuale estensione della rappresentazione dell’algoritmo BCLC nello standard BCLC del 2022 [1] fa discutere. I tipi di terapia e i percorsi di trattamento per il carcinoma epatocellulare (HCC) ivi delineati sono stati integrati solo da piccole differenze. Ma sono proprio questi “passi secondari” a rappresentare interessanti e buone opportunità, ha spiegato il Professor Dr Roman Klöckner della Clinica e Policlinico di Radiologia Diagnostica e Interventistica del Centro Medico Universitario di Mainz (D) [2].
Per lo stadio molto precoce (0) e precoce (A) dell’HCC, le opzioni terapeutiche finora sono state l’ablazione, la resezione e, se necessario, il trapianto. La scelta giusta per il singolo paziente dipende, ad esempio, dalle competenze del centro, dalle opzioni di radiologia interventistica, dall’opzione di trapianto e dall’esperienza del chirurgo epatico. Una sfida speciale, tuttavia, sono i pazienti stessi, i cui quadri clinici sono noti per essere altamente complessi e con processi tumorali molto eterogenei. Il fatto stesso di avere sempre a che fare con due quadri clinici simultanei – con la cirrosi epatica da un lato e l’HCC dall’altro. A causa dei molti quadri tumorali diversi e della gamma di opzioni interventistiche, la discussione interdisciplinare di ogni singolo paziente nel comitato tumori è quindi essenziale, afferma il Prof. Klöckner. Questi pazienti devono essere discussi in modo intensivo, non solo una volta, ma prima di ogni nuova misura o ciclo.
Una possibile terapia locale curativa per il carcinoma epatocellulare molto precoce e in fase iniziale consiste nel ‘cuocerlo’ in modo minimamente invasivo mediante l’ablazione e l’uso di micro- o radio-onde. Il Professor Klöckner ha citato come esempio la cosiddetta “Tecnica No-Touch”, che non punge direttamente nel tumore, ma immediatamente accanto ad esso. Questo approccio gode di ottimi risultati e presenta anche tre vantaggi, come ha spiegato l’esperto:
- Rischio ridotto di proliferazione delle cellule tumorali
- Il rischio di rottura del tumore nei focolai esofitici è praticamente nullo.
- Complicazione della fistola biliopleurica sotto controllo
Sebbene i tassi di recidiva siano più alti rispetto alla chirurgia in tutti gli studi, non si traducono in un tasso di sopravvivenza più basso, per cui l’ablazione può certamente essere considerata equivalente alla chirurgia.
Combinazione potente: Ablazione + TACE
La combinazione con la chemioembolizzazione percutanea trans-arteriosa (TACE) consente di ablare tumori fino a un cut-off di 7 cm. Questo perché il flusso sanguigno si arresta nel tumore ben embolizzato. Questo elimina il raffreddamento proprio del tumore, con il risultato di una diffusione più omogenea del calore e quindi di zone di ablazione leggermente più ampie. Se necessario, ablare con due aghi e da diverse posizioni o sovrapposizioni.
Anche in questa fase, che fino a poco tempo fa era più o meno terapeuticamente dominata dai radiologi, ci sono dei cambiamenti. La terapia di sistema, notevolmente migliorata, offre già un’alternativa completa alla radiologia in alcuni pazienti, e anche in questo caso la discussione interdisciplinare apre la strada all’inserimento del paziente nel percorso terapeutico. Oggi, secondo il Prof. Klöckner, non si deve più commettere l’errore di mettere il paziente su un “percorso infinito TACE” una volta sola. Le sfide, soprattutto con il BCLC B, sono più complesse di quanto possano apparire in un diagramma di flusso S3, e molte di esse non sono rappresentate nella linea guida. Questi includono il diverso carico tumorale e la funzione epatica, il modello di crescita e la posizione del tumore, l’apporto vascolare, ecc. Non tutti i pazienti rispondono ugualmente bene alla TACE e a volte traggono maggiori e minori benefici da questa terapia.
Molti fattori determinano i pro e i contro della terapia locoregionale (panoramica 1), tra cui, ad esempio, i problemi vascolari: se un paziente ha uno stent nel dotto biliare, questo depone contro la TACE e a favore della terapia sistemica o della radioembolizzazione. Quest’ultima non porta alla necrosi diretta e quindi non comporta alcun rischio di infezione, come può accadere con la TACE, ma decompone lentamente il tumore.

Piccoli passi laterali – grande effetto
La classificazione in pro e contro TACE mostra la dimensione dei piccoli passi falsi nei tipi di terapia menzionati all’inizio: i casi classificati come “contro TACE” e che sono classificati nella fase intermedia nella linea guida sarebbero stati embolizzati prima. Oggi, in ogni caso, sono trattati principalmente con una terapia sistemica e possono anche essere trattati con successo per via locoregionale, se la risposta è buona.
È possibile distruggere un carico tumorale elevato con la TACE. Tuttavia, poiché è stato dimostrato che la risposta alla TACE è legata alle dimensioni del tumore, sappiamo che questi tumori non rispondono altrettanto bene. Esiste anche il rischio di una grave sindrome post-embolizzazione se il carico tumorale è elevato.
L’invasione macrovascolare è spesso trascurata dal radiologo, eppure colpisce un terzo dei pazienti durante il decorso della malattia. Anche quelli che sono formalmente classificati come BCLC C e che quindi sarebbero chiaramente “candidati alla terapia sistemica”, possono ora essere trattati locoregionalmente. Alcuni dati, soprattutto dal Giappone, mostrano un approccio curativo anche per gli interventi chirurgici in questa fase per le infiltrazioni di piccole dimensioni. A causa della pessima situazione dei dati, non è ancora stata detta l’ultima parola. Il Prof. Klöckner vede la TACE in modo critico in questo caso, ma se fosse così, tratterebbe ancora con la SIRT.
SIRT: adatta solo a pochi – ma poi davvero buona
A causa della scarsa disponibilità di dati dovuta al fallimento degli studi SARAH e SIRveNIB, il SIRT è stato più o meno cancellato. In fase avanzata, con poche eccezioni, non è più un problema, soprattutto perché è anche costoso e necessita di una buona giustificazione. Tuttavia, anche qui ci sono piccole nicchie in cui la SIRT fornisce risultati preziosi, secondo il Prof. Klöckner.
Nei pazienti che non vogliono essere operati a causa dell’ipertensione o che non vogliono essere ablati a causa della vicinanza del tumore al dotto biliare o al vaso, si può avere successo con la SIRT superselettiva – almeno a livello segmentale o anche in modo più selettivo. È necessaria una dosimetria personalizzata di conseguenza. Con min. 210 Dose tumorale Gray fino a quattro cifre in alcuni casi, viene trattato il segmento di forma tipicamente triangolare. In questo caso, la SIRT è curativa, anche se non da un giorno all’altro.
Un’ultima modifica riguarda l’inclusione del concetto di migrazione della fase di trattamento nell’aggiornamento BCLC. Questo è importante perché consente ai terapeuti di cambiare la terapia normalmente prevista nel percorso orientativo, fornendo buone ragioni. Per esempio, trattare un paziente che ha risposto in modo eccellente alla terapia sistemica con una terapia locoregionale. Il Prof. Klöckner ha sottolineato ancora una volta l’importanza di un buon scambio tra tutte le discipline per rendere giustizia a questi pazienti complessi.
TACE/SIRT più immunoterapia: nuovo fuoco per il sistema?
La combinazione di TACE e TKI si è dimostrata negativa in diversi studi, in definitiva la tossicità era troppo elevata e quindi la compliance era scarsa. Questo contrasta con la combinazione di TACE/SIRT più immunoterapia, che ha un profilo di effetti collaterali più favorevole e può quindi essere combinata molto meglio (Fig. 1) [3].
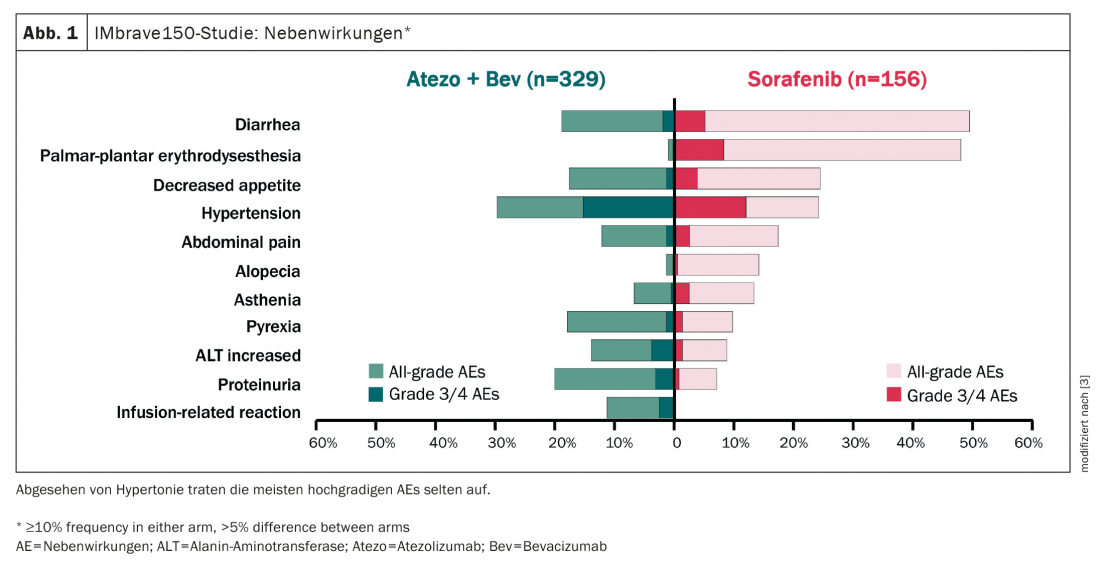
Questa combinazione offre anche la speranza di stimolare il sistema immunitario con una terapia combinata. La risposta alla sola immunoterapia era ancora scarsa, pari al 27%. Tuttavia, insieme alla TACE/SIRT, si spera in tassi di risposta più elevati attraverso il percorso di distruzione del tumore, rilascio di TAA, stimolazione del sistema immunitario e, auspicabilmente, una risposta più forte degli immunoterapici contro l’HCC. Nel caso terapeutico ideale, si verifica non solo un effetto additivo, ma addirittura sinergico.
Congresso: GI-Oncologia 2022
Letteratura:
- Reig M, Forner A, Rimola J, et al: Strategia BCLC per la previsione della prognosi e la raccomandazione del trattamento: l’aggiornamento del 2022. J Hepatol 2022; 76(3): 681-693; doi: 10.1016/j.jhep.2021.11.018.
- GI-Oncologia 2022 – 18° aggiornamento interdisciplinare; evento in aula l’11.6.2022 a Wiesbaden (D)
- Galle PR, Finn RS, Qin S, et al: ASCO GI 2020; Abstr 476; doi: 10.1200/JCO.2020.38.4_suppl.476.
InFo ONCOLOGIA ED EMATOLOGIA 2022; 10(4): 28-29