Nel melanoma maligno, recentemente sono state pubblicate alcune nuove scoperte sui fattori prognostici e sui rischi. Le linee guida modificate portano con sé alcune innovazioni nella vita quotidiana e mirano alla divisione più accurata possibile tra melanomi ad alto rischio e a basso rischio. I cambiamenti maggiori si verificano soprattutto nei melanomi sottili tra 0,75 e 1 mm, per i quali sono stati creati nuovi criteri aggiuntivi. Tuttavia, il futuro della diagnostica del melanoma comporterà senza dubbio il lavoro con i marcatori del melanoma e le analisi delle mutazioni, che già oggi vengono utilizzate di routine per il trattamento del melanoma metastatico avanzato.
Il tasso di incidenza del melanoma è molto alto, soprattutto nella popolazione più giovane. Inoltre, le metastasi si verificano relativamente presto, per cui non è ancora stata trovata una cura. Il melanoma maligno è il tumore mortale più comune nei giovani adulti, e rappresenta la terza causa di morte dopo gli incidenti e il suicidio. In futuro, quindi, l’attenzione non dovrà essere rivolta solo al trattamento del melanoma, ma anche alla prevenzione e all’identificazione dei gruppi a rischio per i quali vale la pena sottoporsi a esami e screening regolari.
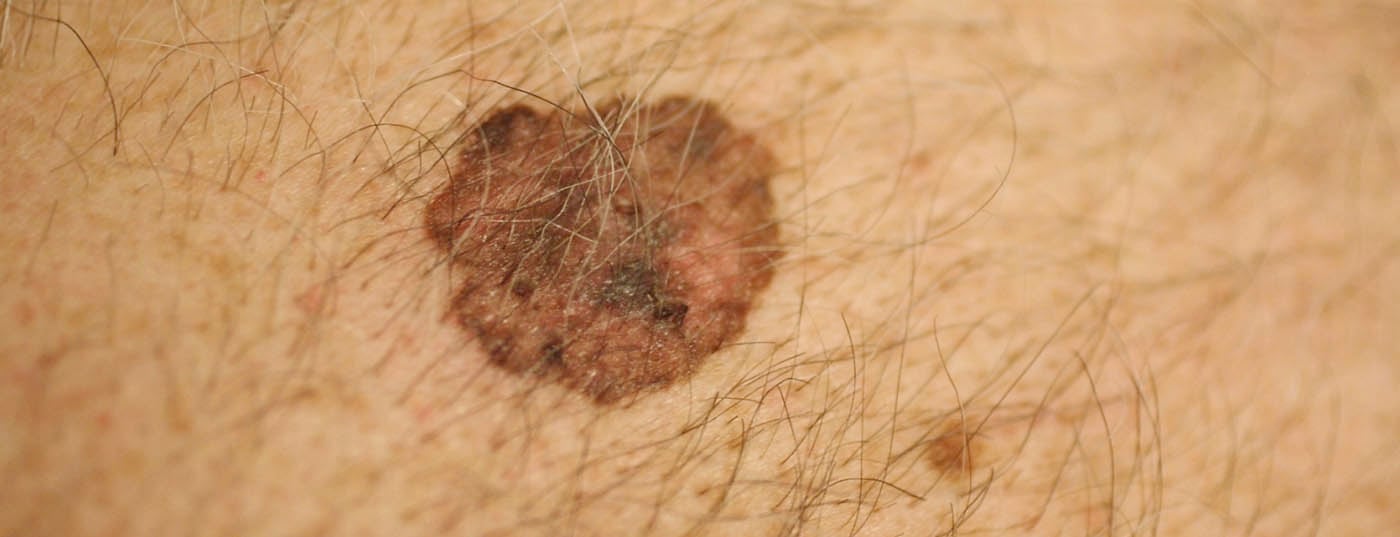
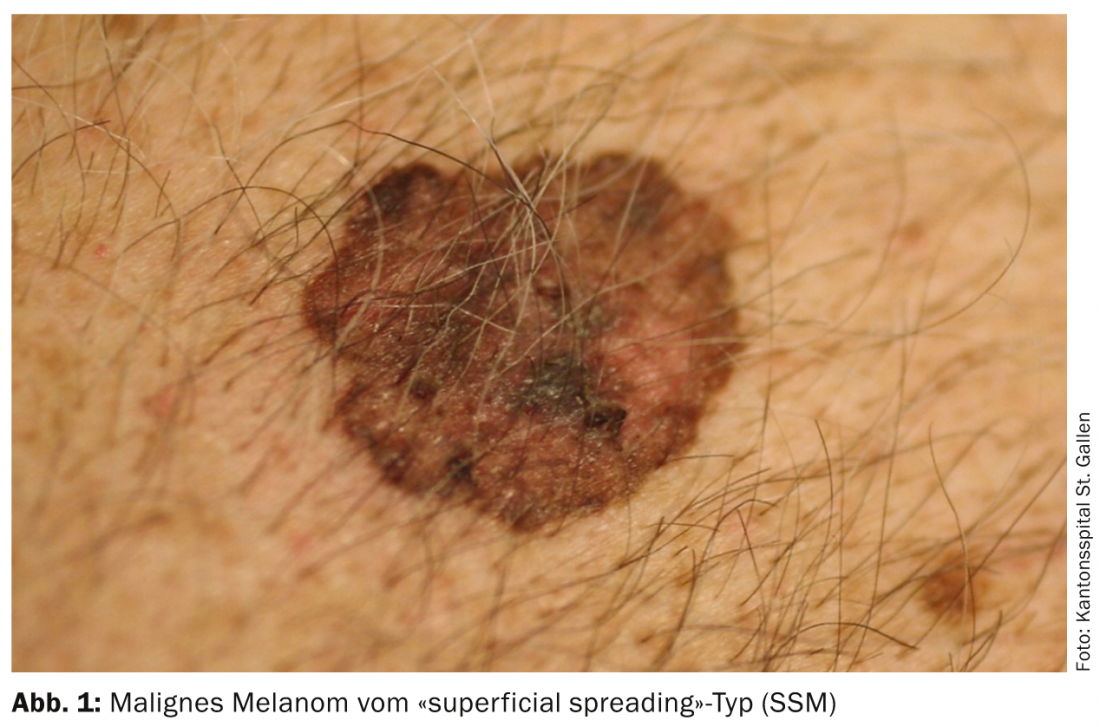
L’enorme aumento dei melanomi ha in gran parte a che fare con il cambiamento del comportamento nel tempo libero. Così, la pelle giovane è esposta al sole prima e in modo più intenso, soprattutto durante le vacanze balneari, nella fascia di spiaggia, nel solarium, ecc. In particolare, si sviluppa il cosiddetto “melanoma a diffusione superficiale” (SSM). (Fig.1) e melanomi nodulari su siti del corpo che non sono nemmeno esposti cumulativamente a molto sole, ma che subiscono un’esposizione al sole di tipo switch-on e switch-off. Inoltre, la maggiore mescolanza di etnie nelle latitudini meridionali è altrettanto significativa, in quanto i caucasici che vivono vicino all’equatore hanno un’incidenza significativamente più alta di melanoma, soprattutto quelli di origine europea centrale e settentrionale. Il tasso di incidenza in Svizzera è di oltre 220 persone per 1 milione di abitanti all’anno, il più alto in Europa.
Gruppi a rischio
Le precedenti campagne di prevenzione si rivolgevano maggiormente alle pelli ad alto rischio, cioè ai tipi di pelle I e II, che subiscono più scottature senza una protezione solare sufficiente. Tuttavia, i veri pazienti a rischio elencati nella Tabella 1 sono stati finora piuttosto trascurati. Pertanto, le misure di prevenzione relative alla protezione solare devono essere applicate a tutti, poiché non è possibile distinguere tra individui a basso rischio e ad alto rischio nella popolazione generale.

In particolare, il numero di nevi displastici, soprattutto nella regione glutea, indica un rischio di melanoma fino a nove volte superiore rispetto alla popolazione normale. Anche gli altri gruppi a rischio elencati nella Tabella 1 presentano un rischio di melanoma aumentato di 2,3-18 volte. È quindi importante includere con precisione anche quei pazienti (gruppo 5 del Scheda. 1), che sono già stati trattati per un altro tumore, devono essere informati sul rischio di melanoma e sottoposti a regolari controlli. È inoltre importante evidenziare un rischio già nei bambini e sicuramente effettuare un esame totale del corpo, compreso un check-up medico. la regione glutea e genitale.
Gli uomini hanno un rischio aggiuntivo. Hanno una prognosi peggiore e una mortalità più elevata, indipendentemente dallo spessore del melanoma. Troviamo ulteriori fattori di rischio dal lato della genetica; soprattutto nei melanomi familiari, si ipotizzano mutazioni ereditarie di due geni con un ruolo critico nel ciclo cellulare, ovvero CDKM2A e CDK4. Tuttavia, anche altri fattori scatenanti, come l’esposizione al sole e altri fattori ambientali, giocano un ruolo in questo caso. Inoltre, sono coinvolti molti altri loci genici, che differiscono a seconda del tipo di melanoma, se si tratta di un melanoma lentigo-maligna o di un melanoma uveale, per esempio.
Il melanoma lentigo-maligna è inoltre più associato all’età avanzata e alla radiazione solare totale cumulativa. Appare solo sul viso, sulla parte superiore della schiena e sugli arti superiori.
L’uso di aspirina per più di cinque anni è risultato essere un debole fattore protettivo, così come l’uso di nicotina per il melanoma lentigo maligna. L’uso di inibitori del TNF-α (biologici) nel trattamento della malattia infiammatoria intestinale comporta un aumento dell’incidenza di melanoma rispetto ai pazienti senza TNF-α. Questi pazienti hanno un rischio maggiore di sviluppare il melanoma rispetto, ad esempio, ai familiari di pazienti affetti da melanoma che non presentano fattori di rischio aggiuntivi.
Classificazione del melanoma e cambiamenti
Finora, lo spessore del melanoma è il fattore prognostico più importante e determina le decisioni terapeutiche. Non è cambiato molto in questa procedura chirurgica principale per quanto riguarda il post-escissione. La regola è ancora valida: al di sotto di 1 mm di spessore secondo Breslow, 1 cm viene ritagliato, al di sopra di 2 mm di spessore è 2 cm. Per il melanoma in situ, si sceglie una distanza di sicurezza di 0,5 cm.
La valutazione dell’indice mitotico è ora decisiva per ulteriori esami, come la rimozione dei linfonodi sentinella. Il tasso di mitosi in un millimetro quadrato viene ora esaminato anche per i melanomi di spessore compreso tra 0,75 mm e 1 mm. Se questo è superiore a 1, è necessario effettuare anche un esame del linfonodo sentinella, come nel caso di un melanoma più spesso di 1 mm. Tuttavia, questo non ha alcuna influenza sulla sopravvivenza globale e sulla libertà dalla recidiva, ma serve a rilevare le micrometastasi e quindi anche l’indicazione per la linfadenectomia. Inoltre, esiste la possibilità che in studi futuri questi pazienti ad alto rischio con micrometastasi possano essere trattati in modo prospettico e/o adiuvante in base all’analisi delle mutazioni del melanoma.
Tuttavia, è importante che la riesecuzione avvenga entro un mese, perché questo influisce anche sulla sopravvivenza complessiva del paziente. L’escissione primaria deve essere eseguita poco, la post-escissione al massimo insieme al linfonodo sentinella, ma entro un mese.
La nuova classificazione TNM (tabelle 2 e 3) prende in considerazione il tasso mitotico, che deve essere valutato per i melanomi di spessore inferiore a 1 mm.

Un altro fattore importante è l’ulcerazione, che può essere indicativa di un diverso immunotipo di difesa del tumore e può giustificare la terapia adiuvante con interferone-α nello stadio tumorale IIb, cioè superiore a 2 mm Breslow con ulcerazione.

Chi dovrebbe occuparsi dei pazienti ad alto rischio?
Oggi è già certo che una formazione specialistica dermatologica triennale è fondamentale per la diagnosi del melanoma. Inoltre, i pazienti ad alto rischio dovrebbero essere esaminati almeno una volta all’anno, compreso l’esame dermatoscopico. È necessario scattare fotografie a corpo intero e foto di confronto, oppure utilizzare supporti di archiviazione digitale come Molemax.
Lo screening può avvenire anche presso il medico di famiglia?
Non c’è dubbio che la popolazione a rischio sia troppo ampia per essere esaminata da uno specialista nel suo complesso, cosa che in realtà sarebbe raccomandata. In effetti, è più importante che i soggetti a rischio, soprattutto gli uomini di mezza età tra i 40 e i 60 anni, si sottopongano a controlli in primo luogo. Questo dovrebbe essere l’obiettivo primario di qualsiasi campagna sul melanoma. Inoltre, però, è necessario sviluppare e offrire una maggiore formazione ai medici di base sugli standard della dermoscopia. Sarebbe utile un diploma di competenze speciali, anche per i non dermatologi.
Ulteriori diagnosi in presenza di melanoma
Secondo la linea guida S3 dell’ADO, la diagnosi iniziale di diffusione è utile per i melanomi fino allo stadio IIb, cioè i melanomi fino a 4 mm con o senza ulcerazione senza metastasi linfonodali o a distanza vengono trattati secondo la stadiazione, compresa la stadiazione. Biopsia del linfonodo sentinella ogni anno e proteina S-100 ogni anno per cinque anni. Gli esami clinici si svolgono ogni sei mesi. Inoltre, i pazienti in stadio Ib, ossia melanomi inferiori a 1 mm ma con ulcerazione e un tasso mitotico superiore a ≥1/mm2, sono anche candidati a un esame ecografico annuale e alla misurazione di S-100 nel siero. La risonanza magnetica, la TAC, la radiografia del torace, l’ecografia addominale e la scintigrafia scheletrica non sono raccomandate nel follow-up di questi melanomi fino a 4 mm di spessore.
Esame PET-CT: nei melanomi di spessore pari a 4 mm e in situazioni selezionate, nonché nei pazienti molto giovani, si raccomanda un esame PET-CT come test diagnostico primario prima di eseguire la dissezione o l’asportazione del linfonodo sentinella. L’utilità di un’ulteriore risonanza magnetica della testa è discutibile nel caso di una PET-CT negativa. Nella PET-CT, invece, si trovano ripetutamente metastasi solitarie, che possono essere affrontate in modo curativo (ad esempio, recidiva nella cicatrice, linfonodo, metastasi solitaria nei tessuti molli tra il tumore primario e la stazione linfonodale).
linfonodo sentinella: In qualsiasi melanoma di diametro superiore a 1 mm (e in situazioni particolari anche a 0,75 mm, Tab. 4) , è consigliabile la ricerca e l’asportazione selettiva del linfonodo sentinella (se non si riscontrano arricchimenti sulla PET-CT in un melanoma di oltre 4 mm Breslow).

Il work-up dei linfonodi sentinella è raccomandato nella linea guida S3 secondo i protocolli nazionali o internazionali. In questo caso, ha senso lavorare con almeno otto sezioni di tessuto e definire se sono presenti micrometastasi (conglomerati di cellule di melanoma, specificati in decimi di millimetro) o macrometastasi. Ulteriori fattori che devono essere risolti sono la profondità di penetrazione delle cellule di melanoma nel parenchima linfonodale, l’infiltrazione della capsula linfonodale, il suo sfondamento e la linfangiosi. Il significato delle varie indicazioni relative al carico tumorale non è ancora chiaro dal punto di vista prognostico, ma deve essere indicato dal punto di vista istopatologico.
Raccomandazioni per le metastasi dallo stadio IIc (pazienti ad alto rischio di recidiva): Questi pazienti devono ricevere una risonanza magnetica della testa, una PET-CT di tutto il corpo, una sonografia dei linfonodi, il marcatore tumorale S-100 nel siero e il marcatore tumorale LDH. Se viene rilevata una metastasi locoregionale, è necessario eseguire un’ecografia addominale e una radiografia del torace. I pazienti con micro- o macrometastasi accertate devono essere presentati al comitato tumori interdisciplinare. Il consenso è che la linfadenectomia elettiva non viene eseguita principalmente a meno che non siano state trovate macrometastasi nel linfonodo sentinella o miglioramenti sulla PET-CT. La linfadenectomia profilattica in presenza di micrometastasi deve essere discussa caso per caso. In questo momento, è necessaria anche un’informazione attiva del paziente e una discussione/supporto dettagliato. Determina anche se le terapie adiuvanti, ad esempio, hanno senso o meno.
La radioterapia adiuvante è consigliata dopo la linfoadenectomia se sono interessati tre linfonodi, se c’è stata una rottura capsulare o se c’è una metastasi linfonodale di oltre 3 cm. In caso di metastasi, è utile anche far analizzare i campioni presso un istituto di patologia, che può effettuare test genetici molecolari. In particolare, si raccomanda l’analisi della mutazione BRAF, se negativa anche l’analisi della mutazione NRAS e, nel caso dei melanomi mucosi, l’esame del c-Kit. Questo è molto importante al giorno d’oggi, non solo per gli attuali studi adiuvanti, ma anche per il successivo trattamento di eventuali metastasi, contro le quali si possono utilizzare farmaci mirati per questa mutazione.
Mark David Anliker, MD
Letteratura:
- Nikolaou V, Stratigos AJ: Tendenze emergenti nell’epidemiologia del melanoma. Br J Dermatol 2014; 170: 11-19.
- Fong ZV, Tanabe KK: Confronto tra le linee guida sul melanoma negli Stati Uniti, Canada, Europa, Australia e Nuova Zelanda: una valutazione critica e una revisione completa. Br J Dermatol 2014; 170: 20-30.
- Vredenborg A, et al: Nevi melanocitici acquisiti nell’infanzia e melanoma familiare. JAMA Dermatol 2014; 150: 35-40.
- Programma di Linee Guida Oncologiche, Linea Guida S3, Melanoma, Versione 1.0, gennaio 2013.
CONCLUSIONE PER LA PRATICA
- La nuova classificazione TNM distingue non solo in base allo spessore del melanoma, ma anche in base al tasso mitotico, che influenza fortemente la procedura di stadiazione e definisce meglio il rischio di metastasi anche nei melanomi sottili.
- Ogni medico è tenuto a sottoporre i pazienti a rischio a un check-up regolare e a indicare le misure preventive già durante l’infanzia.
- Nei melanomi sottili, si esegue meno imaging per la diagnosi primaria, ma l’estirpazione del linfonodo sentinella è raccomandata per i melanomi sottili fino a 0,75 mm, se è presente un tasso mitotico più elevato, che potrebbe diventare significativo per quanto riguarda la terapia adiuvante e gli approcci terapeutici futuri che coinvolgono, ad esempio, l’inibizione di BRAF, NRAS e l’inibizione di nuovi bersagli molecolari.
- Dovrebbero essere introdotti degli standard per i medici di base e i dermatologi, eventualmente anche dei corsi con certificati di competenze per la dermoscopia e il rilevamento del melanoma.
A RETENIR
- La nuova classificazione TNM fa la differenza non solo in base allo spessore del melanoma, ma anche in base al livello di mitosi, che ha importanti ripercussioni sulla classificazione e definisce meglio il rischio di metastasi nel melanoma di basso spessore.
- Ogni medico dovrebbe proporre controlli regolari ai pazienti a rischio e informarli sulle misure preventive a partire dall’infanzia.
- L’imaging è raramente utilizzato per la diagnosi iniziale nei mélanomi di basso spessore; tuttavia, l’esame dei gangli sentinella è consigliato dopo uno spessore di 0,75 mm del mélanome, in presenza di un alto tasso di mitosi, ciò che può essere pertinente per quanto riguarda il trattamento adiuvante e i futuri approcci terapeutici che comprendono, ad esempio, l’inibizione di BRAF, NRAS e l’inibizione di nuove molecole terapeutiche.
- Devono essere definiti degli standard per i medici di base e i dermatologi, e preferibilmente anche per i corsi di formazione con un certificato di competenza in dermatoscopia e nel riconoscimento dei melanomi.
PRATICA DERMATOLOGICA 2014; 24(3): 6-10