I linfomi MALT colpiscono più comunemente lo stomaco. Causalmente, esiste una forte associazione con la gastrite da Helicobacter pylori (Hp) (oltre il 90% dei pazienti). Con un’adeguata antibiotica, l’Hp può essere eradicato, portando alla remissione completa in quasi l’80% dei pazienti con linfoma MALT in fase iniziale. La diagnosi di linfoma MALT rientra in gran parte nel dominio della valutazione morfologica da parte del patologo. La traslocazione specifica t(11;18)(q21;q21) è di importanza concettuale, fisiopatologica, prognostica, predittiva e sempre più terapeutica.
Il tessuto linfoide associato alla mucosa (MALT) è un secondo compartimento biologicamente diverso accanto al tessuto linfoide somatico nodale. L’importanza concettuale e la migliore comprensione dei linfomi di origine extranodale rispetto agli equivalenti nodali derivano dal lavoro di Isaacson e Wright di 30 anni fa, con la descrizione iniziale del linfoma MALT (MALTL) nello stomaco, nel polmone, nella ghiandola salivare e nella tiroide [1]. Il riconoscimento di frequenze variabili di aberrazioni genetiche nel MALTL di diverse provenienze dà sempre più importanza alla specificità dell’organo. Tra i tanti, tuttavia, lo stomaco rimane l’organo più frequentemente colpito da MALTL.
Il concetto di infezione
A rigore, lo sviluppo del concetto di MALT inizia in realtà 20 anni prima, con la descrizione del “linfoma mediterraneo” nell’intestino tenue, caratterizzato da malassorbimento e formazione di immunoglobuline (Ig) abortive, costituite da catene pesanti α difettose senza catene leggere, per le quali è stato coniato il termine “malattia delle catene α” [2].
Nel caso del linfoma, in seguito noto anche come “malattia immunoproliferativa dell’intestino tenue” (IPSID), gli stadi iniziali potevano essere portati in remissione con l’antibiotico, dando così vita all’idea del tumore sensibile all’antigene (Ag) [3]. Con l’associazione documentata con la gastrite da Helicobacter pylori (Hp) in oltre il 90% dei pazienti MALTL, il legame causale tra l’infezione precedente da Hp e il successivo sviluppo del tumore è stato rapido.
stabilito [4].
Helicobacter pylori
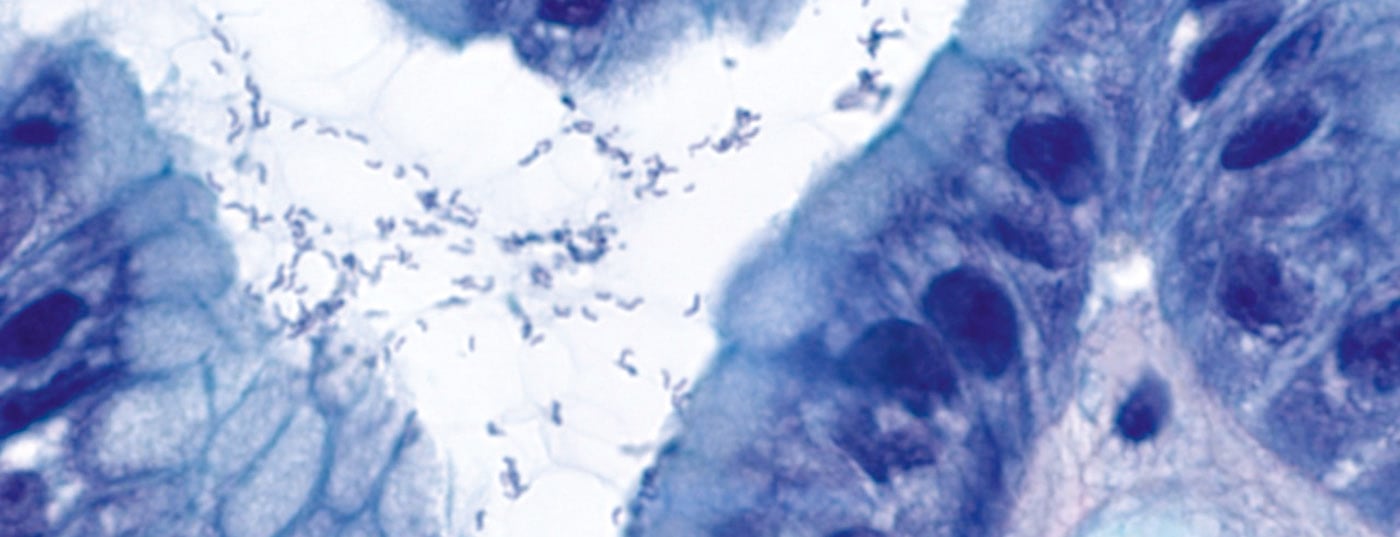
Sono passati 30 anni dalla prima descrizione dell’Hp (Fig. 1) come “bacilli curvi non identificati nello stomaco di pazienti con gastrite e ulcerazione peptica” da parte di Barry Marshall e John Robin Warren [5]. I due hanno ricevuto il Premio Nobel per la Medicina nel 2005 per questa scoperta. In particolare, l’infezione da Hp causa una gastrite cronica e porta all’acquisizione di tessuto linfoide associato alla mucosa, da cui la selezione clonale può portare al MALTL.
La stimolazione Ag indiretta e diretta dei linfociti B, provocata dall’Hp, è mediata dalle cellule presentanti l’Ag e dai linfociti T intratumorali specifici per l’Hp. La risposta immunitaria, cioè la produzione di anticorpi anti-Hp e di Ig idiotipiche, non può eliminare in modo efficiente l’Ag. Tuttavia, l’Hp può essere eradicato con un’adeguata antibiotica e si può ottenere una remissione completa del linfoma in quasi l’80% dei pazienti nella fase iniziale del MALTL [6].
Una migliore comprensione del rivoluzionario cambio di paradigma terapeutico per trattare con successo un tumore con gli antibiotici deriva dal continuum biologico delle infiltrazioni linfoproliferative nello stomaco che inizia con la gastrite Hp e termina con il linfoma a cellule B trasformato altamente maligno.
Hp-positivo/Hp-negativo
In assenza di un gold standard, il test combinato per l’Hp viene eseguito nei pazienti sintomatici, per cui il rilevamento è spesso falso-negativo in caso di terapia a lungo termine con H2-bloccanti. Clinicamente, i diversi tipi di Hp differiscono in termini di virulenza, con i ceppi Cag-A+ che sono associati a una morbilità del paziente significativamente più elevata.
Circa il 10% dei pazienti MALTL sono Hp-negativi; è probabile che abbiano una prognosi peggiore in termini di sopravvivenza globale. Comprensibilmente, la terapia di eradicazione da sola raramente riesce a curarli, per cui è necessaria una terapia antitumorale. L’Helicobacter heilmannii svolge un ruolo solo in circa l’uno per mille di tutte le infezioni da Hp nell’uomo.
Vaccinazione anti-Hp
Con un’incidenza media dell’infezione da Hp del 30% e il rischio associato di sviluppare gastrite B, ulcera gastrica, MALTL o addirittura carcinoma gastrico, l’urgenza della profilassi è evidente. Finora, tuttavia, i vaccini contro l’Hp sono stati utilizzati solo nei topi in laboratorio. Tuttavia, nell’esperimento è possibile ottenere una riduzione significativa della colonizzazione batterica, il che dimostra anche che i vaccini innescano una risposta immunitaria nell’ospite e che quindi hanno un potenziale di eradicazione. Tuttavia, la risposta immunitaria naturale rimane legata alle cellule T regolatorie, che a loro volta limitano l’eliminazione dell’Hp. Ci si può aspettare di più dai futuri concetti di vaccinazione che potrebbero bypassare o superare la regolazione immunitaria legata all’ospite [7].
Morfologia
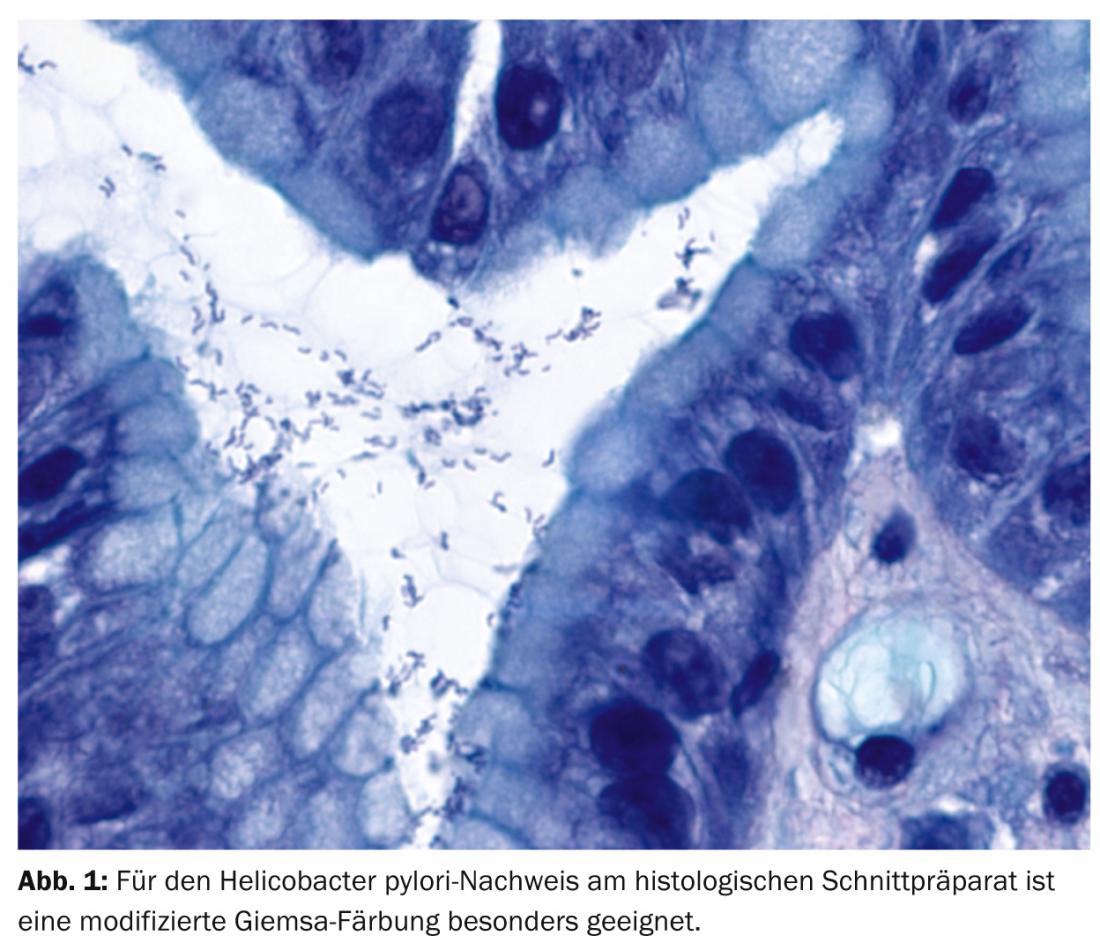
Nell’approccio di routine del patologo, la diagnosi di MALTL rientra in gran parte nel dominio della morfologia. Quindi, la biopsia gastrica mostra una linfoproliferazione diffusa nella mucosa e nella sottomucosa con focolai di infiltrazione abbastanza circoscritti nell’epitelio di superficie e nel corpo ghiandolare, le cosiddette lesioni linfoepiteliali (Fig. 2).
I follicoli linfatici reattivi residui si trovano a livello intratumorale, che in un primo momento sono stati lasciati fuori dal tumore, ma in seguito sono stati colonizzati da esso. Dal punto di vista citomorfologico, le cellule tumorali sono di dimensioni medio-piccole e di forma centrocitoide, linfocitoide o monocitoide. Inoltre, il MALTL mostra una differenziazione delle plasmacellule, tipicamente diretta contro l’epitelio di superficie. Come per altri linfomi a bassa malignità, anche nel MALTL è possibile la trasformazione in linfoma blastico.
Profilo immunitario
Secondo la classificazione valida dell’OMS 2008, il MALTL non ha un profilo immunitario specifico e quindi non può essere definito in termini di immunofenotipo. Piuttosto, rimane semplicemente l’ultima opzione in termini di diagnosi differenziale rispetto ad altri linfomi a cellule B a bassa malignità, quasi per exclusionem. La positività è obbligatoria per il CD20 e, come espressione della differenziazione delle plasmacellule, di solito anche un po’ più pronunciata per il CD79a, mentre la rilevabilità delle Ig monotipiche dipende fortemente dalla qualità della biopsia. In genere, c’è positività per CD21, CD35, CD43, Bcl-10, IRTA-1 e T-bet, ma tutti questi possono essere espressi come marcatori non specifici in altri sottotipi di linfoma. In definitiva, il fattore più utile per la diagnosi è probabilmente la mancanza di rilevamento di CD10 o di ciclina D-1 e SOX-11 nella differenziazione dal linfoma follicolare e dal linfoma a cellule mantellari.
Marcatori molecolari
Nell’interpretazione di infiltrazioni linfoproliferative equivoche di cellule B nello stomaco, l’analisi della clonalità nella PCR ha un valore diagnostico differenziale. importanza, ma alla fine il rilevamento della clonalità è pragmaticamente irrilevante per le conseguenze terapeutiche immediate, dal momento che l’eradicazione antibiotica dell’Hp viene eseguita sia per la gastrite policlonale Hp che per la MALTL monoclonale nella fase iniziale Ag-dipendente. Come inserimento, va notato che la “gastrite clonale” è diagnosticata molto più frequentemente dai gastroenteropatologi di quanto non sia correttamente riconosciuta dagli ematopatologi [8].
Allo stesso modo, il rilevamento di una rottura del gene MALT-1 non ha alcun ruolo nella diagnosi di routine di MALTL, anche se in seguito parlerò del significato più preciso della traslocazione t(11;18)(q21;q21) nel MALTL gastrico.
Biologia molecolare specifica del MALTL
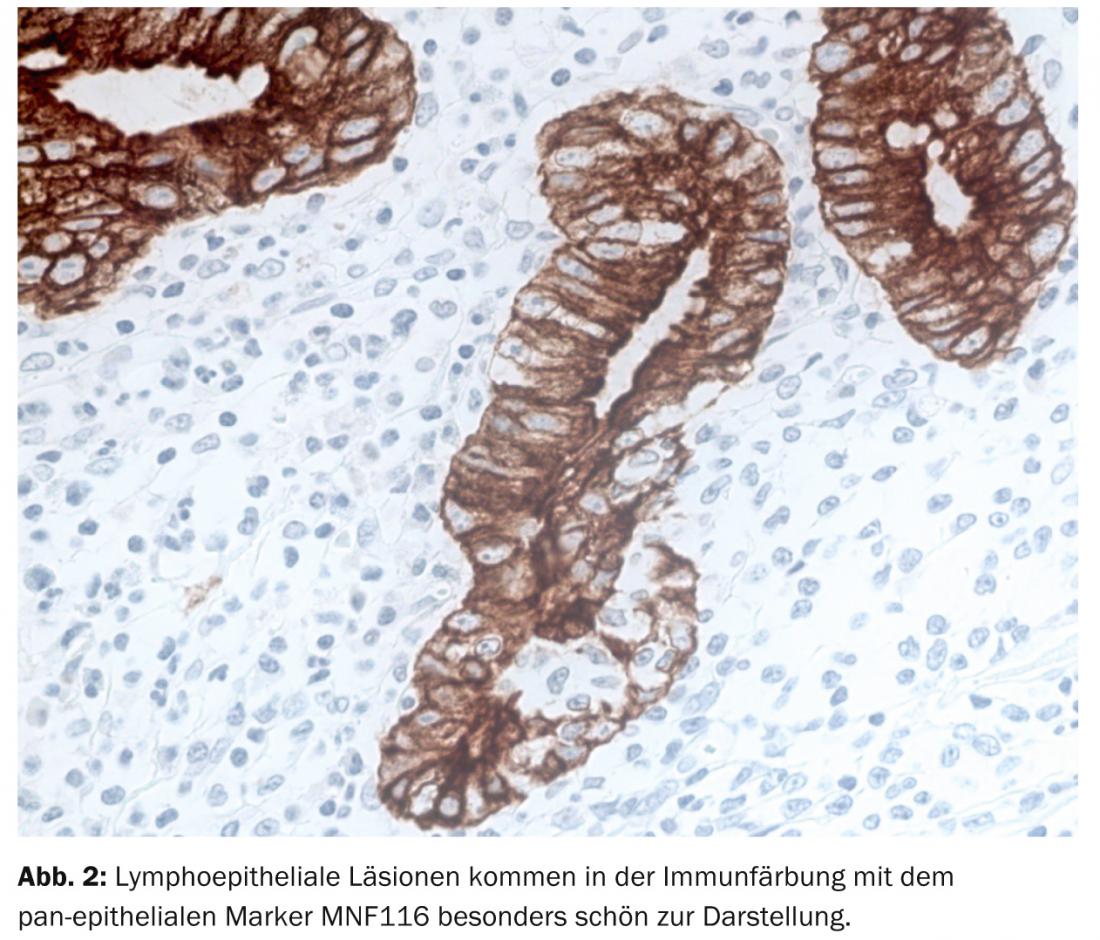
Dal punto di vista diagnostico, la traslocazione reciproca ricorrente t(11;18)(q21;q21) che porta all’ibrido di fusione chimerico BIRC3(API2)-MALT1 è l’aberrazione strutturale più specifica nel MALTL gastrico [9], che può essere rilevata nel 30-50% dei pazienti mediante analisi FISH (Fig. 3).
Dal punto di vista fisiopatologico, la mutazione t(11;18)/BIRC3(API2)-MALT1 in sinergia con le traslocazioni t(1;14)/BCL10-IGH e t(14;18)/IGH-MALT1 e la mutazione TNFAIP3 portano all’inibizione sincrona dell’apoptosi e all’attivazione di NF-κB attraverso l’interazione oncogenica di MALT1 e BCL10.
A livello prognostico, la t(11;18) caratterizza tipicamente i casi con elevata stabilità cariotipica come unica aberrazione genetica ed è protettiva contro la potenziale trasformazione blastica. La traslocazione t(11;18) viene rilevata più frequentemente nei MALTL con stadio iniziale avanzato e decorso più aggressivo, progressione del tumore e diffusione ad altri organi, ed è più frequentemente associata a ceppi Hp Cag-A+.
Predittivamente, nel MALTL t(11;18)-positivo, lo sviluppo del tumore non è innescato dall’Hp e di conseguenza il 78% di questi pazienti è refrattario alla terapia con la sola eradicazione dell’Hp. Tuttavia, il presunto fallimento terapeutico più frequente è dovuto all’intervallo di controllo troppo breve e quindi all’impazienza del paziente o dell’oncologo. È inoltre importante distinguere chiaramente tra la colonizzazione persistente di Hp nella mucosa gastrica, l’evidenza istologica di infiltrati linfoidi residui nella biopsia gastrica ripetuta o semplicemente un clone di cellule B persistente nella PCR.
Dal punto di vista terapeutico, gli inibitori del MALT1 sono stati recentemente testati direttamente per l’attività antitumorale in vitro [10].
Biologia molecolare aspecifica del MALTL
Al contrario, le traslocazioni t(3;14)/FOX-P1-IGH, t(3;14)/BCL6-IGH e t(8;14)/C-MYC-IGH si trovano esclusivamente nei MALTL trasformati blasticamente come aberrazioni genetiche strutturali non specifiche. Le anomalie numeriche frequenti, come la trisomia 3, che è associata nell’80% alle trisomie 11, 12 o 18, l’instabilità microsatellitare/lo squilibrio allelico, l’inattività di TP53 o la delezione di p16, restano da menzionare per completezza.
Messaggi da portare a casa
- Il linfoma a cellule B altamente maligno dello stomaco può essere considerato una trasformazione blastica se viene rilevato un riarrangiamento isoclonale delle Ig e la firma di espressione genica è identica a quella del MALTL, anche se i meccanismi molecolari per questo non sono ancora stati completamente chiariti.
- L’Helicobacter heilmannii (Hh, Gastrospirillium hominis) svolge un ruolo solo nell’uno per mille circa di tutte le infezioni da Helicobacter nell’uomo. I rari casi di linfoma MALT associato all’Hh possono essere portati alla remissione completa con una terapia di eradicazione antibiotica, analogamente all’Hp.
- “Il tumore è una malattia genetica”: la traslocazione t(11;18)(q21;q21)/BIRC3(API2)-MALT1 è il biomarcatore molecolare più importante del linfoma MALT gastrico e ha un significato diagnostico, concettuale, fisiopatologico, prognostico, predittivo e terapeutico.
PD Dr. med. Sergio B. Cogliatti
Letteratura:
- Isaacson PG, Wright DH: Linfoma maligno extranodale derivante dal tessuto linfoide associato alla mucosa. Cancro 1984; 53: 2515-2524.
- Frand U, et al: Linfoma maligno in Israele – uno studio epidemiologico su 399 casi. Harefua 1963; 65: 83-86.
- Galian A, et al: Studio patologico della malattia della catena alfa con particolare attenzione all’evoluzione. Cancro 1977; 39: 2081-2101.
- Doglioni C, et al: Alta incidenza di linfoma gastrico primario nell’Italia nord-orientale. Lancet 1992; 339: 834-835.
- Marshall BJ, Warren JR: Bacilli curvi non identificati nello stomaco di pazienti con gastrite e ulcerazione peptica. Lancet 1984; 323: 1311-1315.
- Wotherspoon AC, et al: Regressione del linfoma gastrico primario a cellule B di basso grado del tipo tessuto linfoide associato alla mucosa dopo l’eradicazione dell’Helicobater pylori. Lancet 1993; 342: 575-577.
- Czinn SJ, Blanchard T: Vaccinazione contro l’infezione da Helicobater pylori. Nat Rev Gastroenterol Hepatol 2011; 8: 133-140.
- Hummel M, et al: i criteri di Wotherspoon combinati con l’analisi della clonalità delle cellule B mediante la tecnologia avanzata della reazione a catena della polimerasi discriminano il linfoma della zona marginale gastrica nascosto dalla gastrite cronica. Gut 2006; 55: 782-787.
- Mathijs B, Marynen P: t(11 ;18)(q21 ;q21) BIRC3/MALT1. Atlas Genet Cytogenet Oncol Haematol 2002; 6: 34-36.
- Burgess DJ: Assalto al MALT1. Nature Reviews Cancer 2013; 13: 80-81.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(1): 22-26