La manifestazione principale della malformazione artero-venosa (AVM) sintomatica è l’emorragia intracranica, tipicamente subaracnoidea o intracerebrale, come risultato della rottura nel rimodellamento distruttivo localizzato della parete del vaso. Altri sintomi tipici sono l’irritazione, che spesso si presenta come cefalea ed epilessia, oppure la riduzione della circolazione nelle aree cerebrali adiacenti, con conseguenti deficit neurologici focali non emorragici. Per ridurre il rischio di emorragia, l’obiettivo terapeutico è l’esclusione della MAV, che può essere effettuata per via endovascolare, chirurgica, radiochirurgica o con una combinazione di due o tutti e tre questi metodi, a seconda delle circostanze. In presenza di sintomi non emorragici come cefalea, epilessia o deficit neurologici focali, si può prendere in considerazione l’occlusione parziale per migliorare i sintomi. In caso di sintomi emorragici, la chiusura di una lesione (aneurisma) sospettata come fonte di emorragia può proteggere parzialmente da un’ulteriore emorragia della MAV nello stesso sito, ma la chiusura completa della MAV è preferibile se possibile con un rischio accettabile.
Le malformazioni artero-venose (AVM) sono malattie vascolari circoscritte, spesso con origine alla nascita, che possono manifestarsi nel corso della vita con le conseguenze di connessioni multiple in cortocircuito tra i sistemi arterioso e venoso. Come per tutte le malattie neurovascolari, esiste la possibilità di un’interferenza con la normale circolazione cerebrale adiacente o direttamente con il cervello.
Le MAV del SNC sono paragonabili per frequenza e tipologia alle altrettanto rare MAV di altri tessuti, che oggi vengono solitamente trattate solo per i loro sintomi. La differenza cruciale sta nel tipo di manifestazione clinica, che nella MAV cerebrale comprende emorragia e sintomi neurologici irritanti (epilessia, mal di testa) o disfunzioni neurologiche – tutte condizioni che limitano gravemente la qualità della vita. Questi rischi, che accompagnano sia l’approccio osservazionale che quello attivo, rendono la decisione di un trattamento attivo o di un atteggiamento di attesa nel caso di un riscontro incidentale di una MAV non facile e spesso controverso.
Formazione di un nido
Le MAV sono probabilmente già create a livello fetale e diventano visibili e proporzionalmente più grandi con la crescita. Oggi la risonanza magnetica viene eseguita sempre più spesso a livello fetale o nella prima infanzia, e anche in questo caso raramente mostra forme specifiche di MAV per caso. Si può quindi supporre che la maggior parte delle MAV cerebrali, anche se presumibilmente fetali, diventino visibili solo nel corso della vita e, a seconda della loro localizzazione, si manifestino solo secondariamente.
Le malformazioni artero-venose comprendono molteplici cortocircuiti creati in modo patologico (fistole AV) tra arterie e vene, cioè senza una rete capillare interposta che riduce la pressione e la velocità del flusso sanguigno . Il conseguente gradiente di pressione AV porta a una circolazione accelerata, un cosiddetto “shunt AV”. L’aspirazione consecutiva porta alla genesi di numerosi nuovi vasi corrispondenti alla necessità e spesso attira collateralmente i territori dei vasi arteriosi e venosi vicini – si forma una ricca rete di vasi artero-venosi, un nidus. A seconda della struttura e della posizione del nido della MAV e del suo rapporto con le arterie e le vene delle parti adiacenti del cervello, può essere molto compatto e circoscritto, ma anche configurato in modo diffuso, e in questo caso più difficile da distinguere dal tessuto cerebrale normale.
Stenosi ed ectasie
L’aumento della circolazione può portare all’invecchiamento precoce e all’usura della sezione interessata del vaso, con conseguente formazione di stenosi ed ectasie vascolari. Entrambi i tipi di alterazioni della parete sono ora associati a un aumento del rischio di emorragia, l’ectasia arteriosa e venosa come sede di pareti vascolari indebolite e la stenosi ostruttiva come indicatore di pressione prestenotica potenzialmente elevata – circostanze meglio valutate dall’esame angiografico con catetere. Ancora oggi, i metodi di imaging trasversale mancano in gran parte di queste informazioni, che sono fondamentali per decidere di agire attivamente.
Catturare i processi distruttivi in tempo
Come in altre malattie neurovascolari, ad esempio anche negli aneurismi, i processi aterotrombotici che sono circoscritti alla parete del vaso sono ora ritenuti responsabili dei cambiamenti infiammatori adiacenti che indeboliscono la parete del vaso [1, 2]. La difficoltà consiste nel rilevare questi processi di rimodellamento biologico distruttivo in tempo e in modo corretto a causa della loro sottigliezza, al fine di prevenire potenziali emorragie.
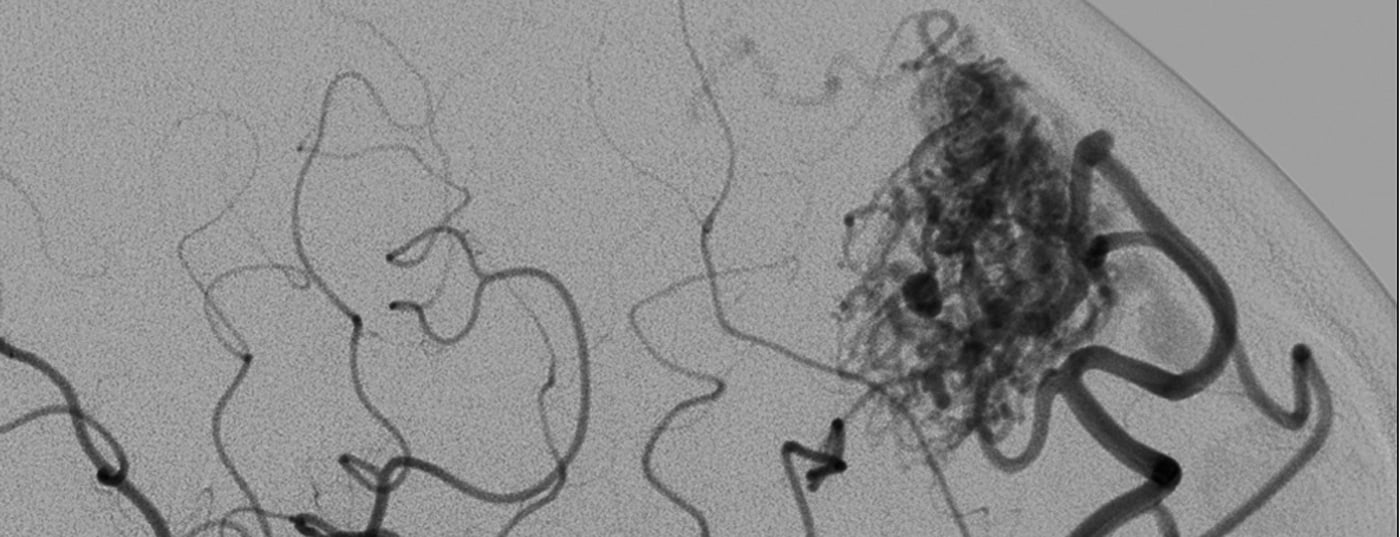
Poiché statisticamente le MAV sono rare, la patomorfologia è altamente variabile e il comportamento biologico è inoltre individualmente variabile, la prognosi affidabile di un rischio di sanguinamento rimane difficile [3–6]. Oltre alle dimensioni e alla posizione, i criteri morfologici vascolari che influenzano la prognosi includono la formazione di aneurismi arteriosi, l’ectasia venosa e, in particolare, le stenosi associate al deflusso venoso (Fig. 1). Sebbene si sospetti che i processi biologici siano responsabili della tendenza al sanguinamento, non esistono altri marcatori biologici affidabili che possano essere utilizzati per valutare in modo affidabile la condizione e il potenziale decorso di una malformazione vascolare [2].
Il risultato incidentale
L’odierna qualità dell’imaging medico che utilizza la risonanza magnetica (RM) e la tomografia computerizzata (TC) spesso consente di identificare una MAV senza cercarla specificamente, creando la tipica situazione di una MAV asintomatica trovata per caso.
L’RCT multicentrico internazionale ARUBA (“A Randomised Trial of Unruptured Brain AVMs”; http://avm.ucsf.edu/patient_info/aruba_trial), iniziato nel 2007, confronta l’approccio osservazionale con il trattamento attivo e si schiera contro un approccio attivo ai reperti incidentali in base ai dati attualmente conosciuti. Una valutazione dettagliata dei dati ottenuti è prevista a breve.
Sebbene le malformazioni arterovenose intracraniche siano molto rare, si deve presumere che l’incidenza reale sia in qualche modo sottostimata, con una prevalenza attualmente stimata di 15 su 100000. L’incidenza annuale (presentazione sintomatica) delle malformazioni AV è di 1-2/100000 all’anno. Per le MAV che non si sono manifestate con un’emorragia, le differenze tra le varie serie pubblicate sono relativamente piccole, per cui si può ipotizzare un rischio di emorragia tra il 2 e il 4% all’anno. Una volta che una MAV ha sanguinato, il rischio di ulteriori emorragie aumenta.
Le associazioni familiari di malformazioni AV sono viste clinicamente quasi esclusivamente in associazione con la sindrome di Osler-Weber-Rendue (telangectasia emorragica ereditaria, HHT) e altrimenti si verificano sporadicamente. Di norma, l’insorgenza sporadica di una MAV rende superfluo un chiarimento dei membri della famiglia.
In ogni caso, una malformazione AV deve essere chiarita in dettaglio mediante un’angiografia con catetere, per poter individuare e valutare i fattori che rappresentano un rischio maggiore per il paziente. I seguenti parametri sono indicatori riconosciuti di un aumento del rischio di emorragia per i motivi sopra indicati e dalle pubblicazioni:
- Piccola malformazione AV (dimensioni del nido <3 cm)
- Posizione profonda (peri- o intraventricolare, o nei gangli della base)
- Drenaggio venoso profondo ed ectasia venosa associata a stenosi e aneurismi associati a livello juxta- o intranidale.
Se si è già verificata un’emorragia, il rischio di una nuova emorragia è notevolmente aumentato, soprattutto nei primi sei mesi [7].
I sintomi iniziali non emorragici sono
Epilessia: le crisi epilettiche sono il sintomo iniziale in oltre un terzo dei pazienti. Nella maggior parte dei pazienti, le crisi sono focali o focali complesse, con la MAV corticale più comunemente associata a crisi epilettiche. Molti pazienti possono essere controllati relativamente bene con i farmaci.
Mal di testa: il mal di testa cronico è presente in circa il 30% dei pazienti con MAV. L’obliterazione endovascolare di qualsiasi coinvolgimento del flusso arterioso meningeo di solito determina una marcata riduzione di tali cefalee, che è indicativa di un’irritazione meningea. Sono stati discussi meccanismi come l’irritazione delle arterie cerebrali che porta al mal di testa; i nervi vasorum dei segmenti prossimali delle arterie cerebrali potrebbero forse consentire la percezione dei segnali di dolore.
Deficit neurologici focali: anche i deficit neurologici focali sono presenti in quasi un terzo dei pazienti con MAV. Possono essere progressive, stabili o fluttuanti. Il meccanismo di questi deficit focali varia. A volte dietro questi deficit focali può nascondersi una condizione postictale, ma più spesso può esserci un disturbo circoscritto della circolazione cerebrale (fenomeno del “furto”). Quindi, a volte è probabile che alla base ci sia un’ipertensione venosa regionale o anche un effetto irritativo, pulsatile e occupante spazio di un’ectasia vascolare.
Opzioni terapeutiche
In linea di principio, le malformazioni AV possono essere trattate con la neurochirurgia, il neurointervento o la radioterapia. L’obiettivo di tutti e tre i trattamenti, singolarmente o in combinazione con due o tre terapie, deve essere quello di chiudere completamente la MAV. Il presupposto, talvolta esistente, che una riduzione delle dimensioni della MAV comporti anche una riduzione del rischio di emorragia non è corretto. Al contrario, un cambiamento nell’emodinamica di una MAV (conseguenza praticamente inevitabile di una riduzione delle dimensioni senza occlusione completa) può anche portare ad un aumento del rischio di emorragia e non deve assolutamente cullare un falso senso di sicurezza.
In linea di principio, la decisione a favore o contro una terapia specifica per un angioma AV dovrebbe essere presa su base interdisciplinare. A nostro avviso, la terapia neurochirurgica e la terapia interventistica, da sole o in combinazione, svolgono il ruolo principale (Fig. 1). Nel caso di MAV profonde o di MAV del tronco encefalico, che sono alimentate da arterie multiple e perforanti, la radiochirurgia è significativamente meno rischiosa. A causa della latenza tra la terapia e la chiusura della MAV dopo la radioterapia, l’estirpazione chirurgica e la terapia endovascolare, da sole o in combinazione, sono da privilegiare per ottenere un rapido effetto preventivo.
Trattamento endovascolare
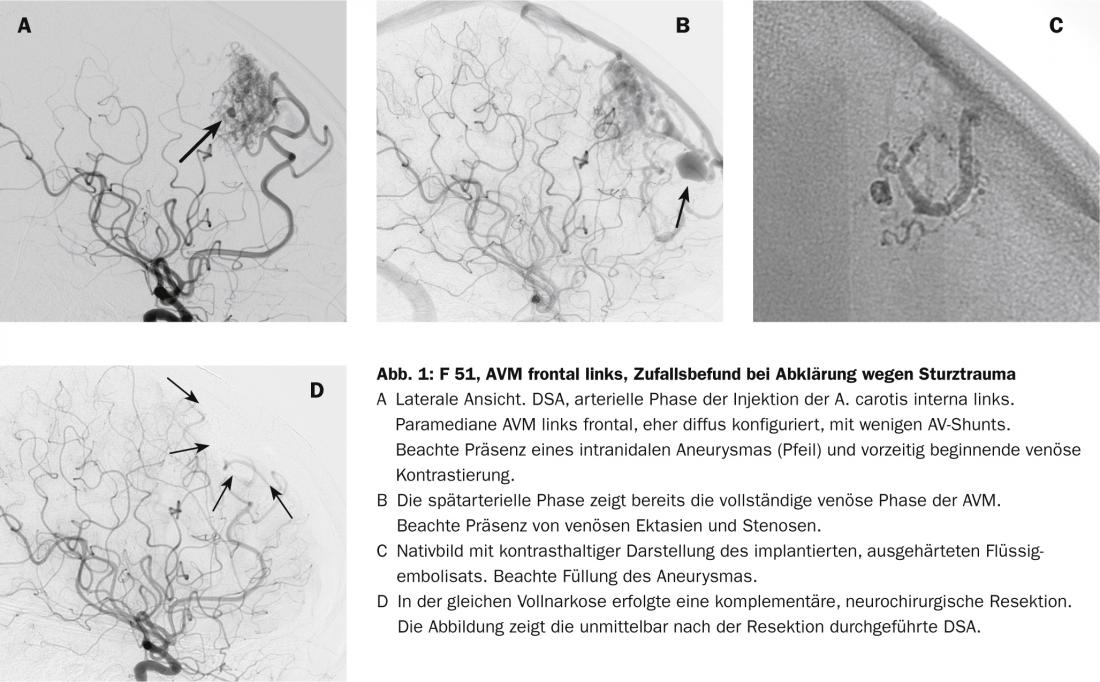
L’accesso endovascolare con catetere superselettivo a una MAV, solitamente eseguito in anestesia, è oggi una procedura di routine e, purché le dimensioni del vaso lo consentano, è possibile avvicinarsi a qualsiasi ramo del vaso. L’imaging superselettivo del lume del vaso consente un’analisi fine della morfologia del vaso e del nidus, aprendo al contempo l’opzione della chiusura endovascolare. A questo scopo, di solito si utilizzano adesivi liquidi polimerizzanti o sostanze precipitanti, poco o per nulla adesive. Sotto controllo visivo fluoroscopico biplanare, queste sostanze vengono iniettate gradualmente, evitando l’occlusione dei vasi adiacenti normali.
Il rischio risiede nell’obliterazione dei vasi normali e nel sanguinamento causato dall’iniezione e dalla manipolazione endovascolare. Si tratta di rischi che vengono assunti solo se considerati proporzionati al rischio di emorragia spontanea valutato. Per lo più utilizziamo una sostanza precipitante. Una volta raggiunta la posizione intranidale del catetere, questo viene iniettato lentamente nel nidus. Spesso è possibile chiudere ampie parti della MAV o addirittura l’intera MAV con una sola posizione del catetere. Tuttavia, a seconda della compartimentazione, potrebbe essere necessario chiudere una tale MAV in due o tre posizioni. Il tasso di occlusioni complete è aumentato in modo significativo dopo l’uso di tali sostanze (Fig. 2) [8].
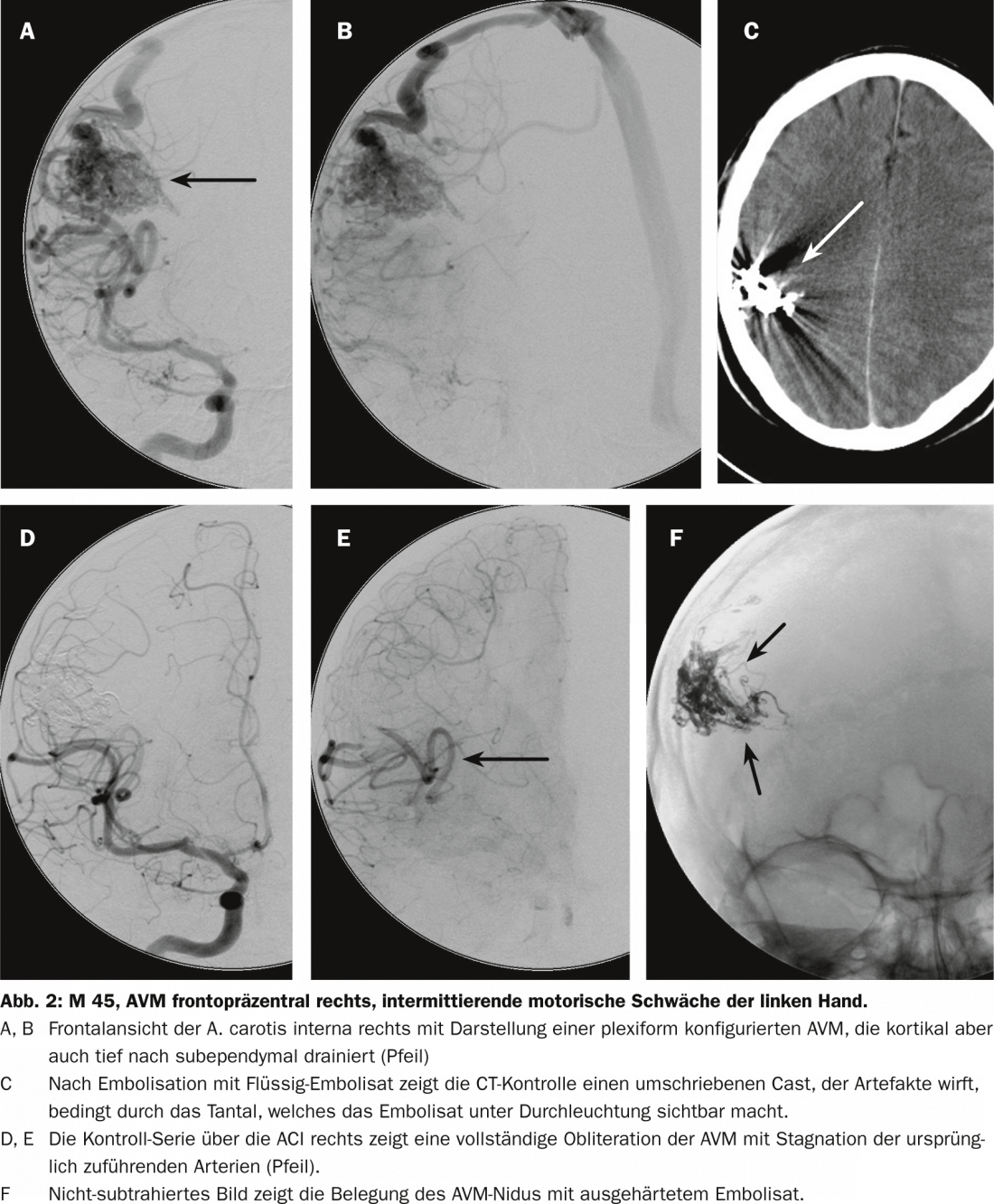
Trattamento neurochirurgico
Le malformazioni AV superficiali e piccole possono essere operate e completamente rimosse con una mortalità e una morbilità molto basse, mentre le malformazioni AV profonde e grandi che drenano attraverso il parenchima cerebrale possono essere associate a una morbilità e a una mortalità chirurgica drammaticamente più elevate, fino a oltre il 50%. Un’ampia meta-analisi del 2000 con oltre 2400 pazienti ha mostrato che la mortalità media dopo l’estirpazione neurochirurgica è del 3,3% e la morbilità media dell’8,6% (1,5-18,7%) [9].
Il rischio del trattamento neurochirurgico deve essere valutato individualmente utilizzando la classificazione secondo Spetzler e Martin. La graduazione della MAV di Spetzler-Martin si basa sulle dimensioni, sul drenaggio venoso e sull’eloquenza del tessuto cerebrale circostante, in base all’angiografia con catetere, alla TAC o alla risonanza magnetica. La graduazione della lesione è determinata dalla somma dei singoli punti. Più alto è il punteggio, più alto è il rischio operatorio neurochirurgico di morbilità o mortalità.
Questa classificazione non fornisce una prognosi sui rischi di una terapia endovascolare associata.
Radiochirurgia stereotassica
Nella radioterapia stereotassica, che viene eseguita in un’unica sessione come la cosiddetta radiochirurgia, l’insorgenza graduale dell’effetto delle radiazioni, che dura fino a un massimo di 1 o 2 anni dopo il completamento della terapia, è di particolare importanza. Il successo obliterativo del trattamento, che può essere osservato circa cinque anni dopo la terapia, dipende in modo decisivo dalle dimensioni della MAV e dal diametro dei vasi che la alimentano. Per le MAV con un nido di dimensioni inferiori a 15 mm, il tasso di obliterazione completa è del 77%; se il nido è compreso tra 15 e 25 mm, il tasso di obliterazione è del 62%, riducendosi al 44% se il nido è più grande di 25 mm. In presenza di ulteriori afflussi durali, la probabilità di obliterazione completa è solo la metà. Le complicazioni da trattamento ritardato della radioterapia, dovute principalmente alla necrosi da radiazioni nel tessuto cerebrale adiacente, sono del 5-7%; inoltre, esiste un rischio persistente di emorragia del 3-4% all’anno, finché la MAV non è stata chiusa.
Cooperazione multidisciplinare
La consulenza e il trattamento delle MAV cerebrali sono meglio eseguiti in modo multidisciplinare da un’équipe medica composta da neuroradiologi interventisti, neurochirurghi e radioterapisti, associati alla valutazione critica di neurologi e, se opportuno, neuropsicologi e psichiatri. L’assistenza post-terapeutica viene fornita in stretta collaborazione con i neurointensivisti e, se necessario, con una rete di riabilitazione e reinserimento sociale.
L’esclusione preventiva dell’emorragia mediante il trattamento di una MAV asintomatica è ora messa in discussione, in quanto i rischi della terapia invasiva sono attualmente considerati superiori a quelli di un decorso spontaneo. È quindi necessaria un’assistenza a lungo termine dei pazienti e dei familiari, soprattutto quando si decide per un approccio non attivo, ed è vantaggioso un rapporto continuo medico-paziente.
Letteratura:
- Chen Y, et al.: Evidenza del coinvolgimento delle cellule infiammatorie nelle malformazioni arterovenose cerebrali. Neurochirurgia 2008; 62(6): 1340-1349 (discussione 1349-1350).
- Kim H, et al: Considerazioni genetiche relative all’emorragia intracranica e alle malformazioni arterovenose cerebrali. Acta Neurochir Suppl 2008; 105: 199-206.
- Laakso A, Hernesniemi J: Malformazioni arterovenose: epidemiologia e presentazione clinica. Neurosurg Clin N Am 2012; 23(1): 1-6.
- Laakso A, et al: Rischio di emorragia nei pazienti con malformazioni arterovenose di grado Spetzler-Martin IV e V non trattate: uno studio di follow-up a lungo termine su 63 pazienti. Neurochirurgia 2011; 68(2): 372-377; (discussione 378).
- Hernesniemi JA, et al: Storia naturale delle malformazioni arterovenose cerebrali: uno studio di follow-up a lungo termine del rischio di emorragia in 238 pazienti. Neurochirurgia 2008; 63(5): 823-829 (discussione 829-831).
- Al-Shahi R, Warlow C: Una revisione sistematica della frequenza e della prognosi delle malformazioni arterovenose del cervello negli adulti. Brain 2001; 124: 1900-1926.
- Stapf C, et al.: Predittori di emorragia nei pazienti con malformazione arterovenosa cerebrale non trattata. Neurologia 2006; 66(9): 1350-1355.
- Panagiotopoulos V, et al: Embolizzazione di malformazioni arterovenose intracraniche con copolimero etilene-alcool vinilico (onice). AJNR Am J Neuroradiol 2009; 30(1): 99-106.
- Castel JP, Kantor G: Morbilità e mortalità postoperatoria dopo l’esclusione microchirurgica delle malformazioni arterovenose cerebrali. Dati attuali e analisi della letteratura recente. Neurochirurgia 2001; 47(2-3): 369-383.