Le allergie tardive ai farmaci possono manifestarsi in varie forme, da un lieve esantema a reazioni pericolose per la vita. La diagnosi è solitamente difficile e si basa sull’anamnesi, sui test cutanei e sul classico test di trasformazione dei linfociti (LTT). La cito-LTT si basa sulla misurazione di una combinazione di citochine nei surnatanti delle colture cellulari e ha sostituito la classica LTT nella diagnostica di routine, grazie alla sua maggiore sensibilità.
Le allergie ai farmaci si manifestano solitamente sulla pelle, ma nelle forme più gravi sono coinvolti anche il fegato, i reni, i polmoni e persino il muscolo cardiaco. I sintomi principali sono l’esantema, che si manifesta come esantema maculopapulare (MPE), la pustolosi esantematica acuta generalizzata (AGEP), la reazione bollosa (sindrome di Stevens-Johnson, SJS, e necrolisi epidermica tossica, TEN) e la reazione da farmaco con eosinfilia e sintomi sistemici (DRESS). Si tratta di reazioni delle cellule T a un farmaco. Di solito compaiono solo dopo giorni di trattamento. I pazienti affetti non mostrano anticorpi IgE contro il farmaco, per cui i test sierologici corrispondenti rimangono negativi. Dopo il contatto iniziale con la sensibilizzazione, alcune cellule T persistono come cellule di memoria, chiamate anche linfociti T di memoria, soprattutto nella milza e nei linfonodi. Alcune di queste cellule di memoria circolano anche nel sangue. Nonostante il basso numero, ci sono sufficienti cellule T farmaco-specifiche nel sangue che possono essere rilevate diagnosticamente con speciali test cellulari.
Il test di trasformazione dei linfociti (LTT) viene utilizzato da oltre 40 anni ed è applicato a un gran numero di farmaci. Il test è complesso perché non si basa sull’analisi del siero, ma rileva la reazione specifica delle cellule T vive. Le cellule mononucleari (=linfociti, monociti) vengono isolate dal sangue intero mediante centrifugazione a gradiente di densità e poi coltivate con il farmaco presumibilmente scatenante, che rappresenta l’allergene. Di solito vengono testate 3-5 concentrazioni. Dopo una settimana, la proliferazione di queste cellule viene misurata nelle ultime 16 ore di coltura cellulare mediante l’assorbimento di timidina marcata radioattivamente e confrontata con la proliferazione spontanea senza antigene. Questo rapporto si chiama indice di stimolazione (SI). In generale, un SI di 2-3 è considerato positivo e indica la presenza di linfociti T specificamente sensibilizzati. Questo test aiuta quindi a identificare il farmaco scatenante e a confermare il sospetto di un’allergia ai farmaci. resp. determinare il farmaco responsabile in caso di somministrazione di più farmaci.
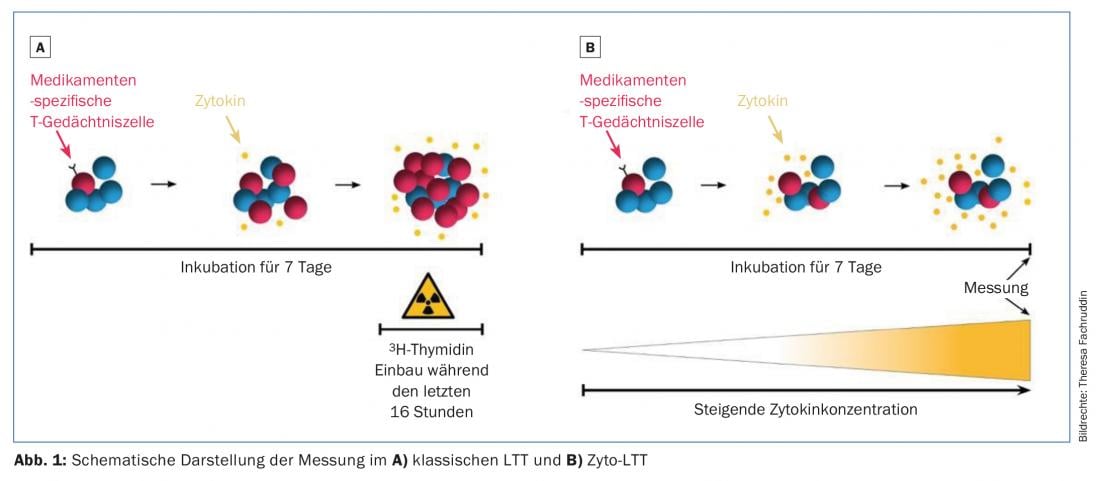
Uno svantaggio di della LTT utilizzata finora è la sua sensibilità talvolta bassa a seconda del farmaco. Le ragioni sono due: in primo luogo, solo la risposta proliferativa delle cellule viene misurata in una breve finestra temporale. Con un breve tempo di stimolazione, le cellule coltivate possono già essere di nuovo dormienti e non sono più rilevabili nell’LTT standard. In secondo luogo, le allergie ai farmaci sono molto eterogenee nelle loro manifestazioni e le risposte cellulo-mediate non sempre si traducono in un forte aumento della proliferazione. È già stato dimostrato che nelle reazioni citotossiche come la sindrome di Stevens-Johnson, l’LTT fornisce un risultato positivo per il farmaco scatenante solo nel 30% dei casi. In questi casi, la reazione non si basa su un aumento della proliferazione, ma piuttosto sul rilascio di mediatori citotossici come il granzima B e la granulisina. Negli ultimi anni, si sono quindi cercate delle alternative alla LTT standard descritta sopra.
La diversità delle manifestazioni cliniche dell’allergia ai farmaci si basa sul rilascio di citochine (IL-2, IL-4, IL-5, IL-13, IFN-γ,…) e molecole citotossiche (granzima B, granulysina, perforina,…). Nel tentativo di migliorare la LTT standard (e di sostituire la metodologia radioattiva), l’attenzione si è concentrata su una selezione di citochine adatte. È stata studiata l’influenza del numero di cellule e della durata della coltura cellulare, nonché le condizioni esatte di coltura. Il cyto-LTT (cytokine LTT) risultante da questi sforzi misura la concentrazione di cinque mediatori IL-5, IL-13, IFN-γ, granzima B e granulysina nei surnatanti delle colture cellulari, utilizzando la citometria a flusso. Il periodo di incubazione è di sette giorni e vengono determinati i valori di SI, analogamente al classico LTT. L’aumento della sensibilità con una specificità sempre eccellente è già stato dimostrato in oltre 150 pazienti testati. Un motivo importante per questo è probabilmente la risposta non proliferativa che può essere rilevata con la misurazione delle citochine oltre alla proliferazione, a differenza della classica LTT. Un ulteriore vantaggio decisivo della cito-LTT è il rilevamento cumulativo: si è potuto dimostrare che la quantità di citochine si accumula nei surnatanti di coltura per l’intero periodo dei sette giorni, mentre la classica LTT rileva solo le ultime 16 ore di proliferazione. In questo modo, l’intero periodo di reazione può essere seguito indirettamente attraverso la cito-LTT.

La cito-LTT presenta vantaggi significativi rispetto alla LTT classica e nel frattempo l’ha sostituita. La sensibilità è stata migliorata dal 50% (SJS, n=8) all’83% (MPE, n=36). La misurazione di diverse citochine funzionalmente diverse è una delle ragioni della maggiore sensibilità e permette anche di catturare o riflettere meglio l’eterogeneità di un modello di malattia nella provetta. È persino possibile trarre conclusioni sulla pericolosità della reazione. I dati preliminari dimostrano che un esantema “banale”, ad esempio all’amoxicillina, è associato principalmente a livelli elevati di IL-5/IL-13, mentre nei pazienti con DRESS tutti e cinque i parametri misurati sono elevati. Nei pazienti con la sindrome di Stevens-Johnson, anche in questo caso sono elevati solo i livelli di granzima B e di granulisina e forse di IFN-γ.
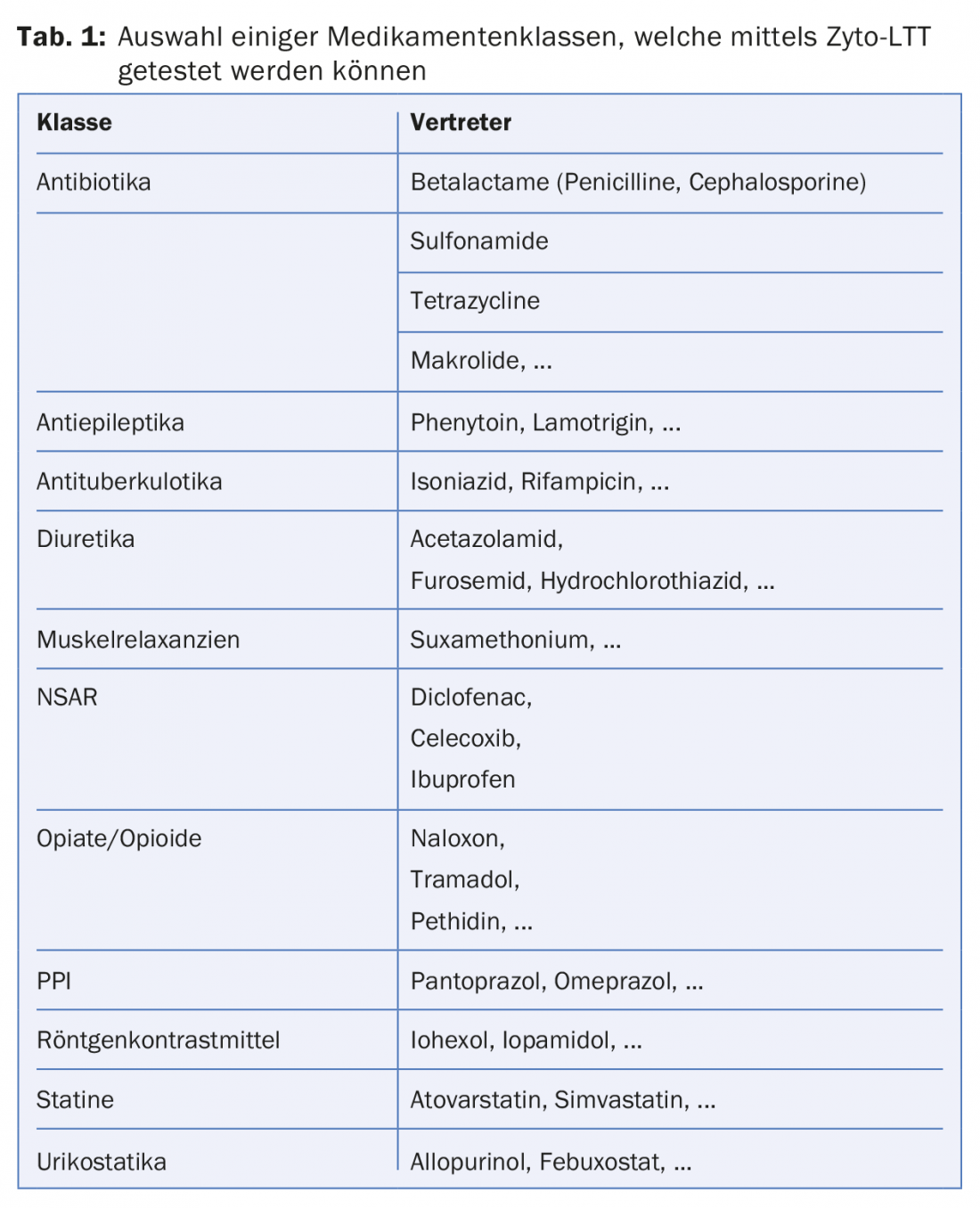
La cito-LTT può facilitare la difficile diagnosi delle allergie ai farmaci. Finora sono stati testati più di 250 farmaci diversi, i più comuni sono elencati nella tabella 1. Poiché la cito-LTT può fornire risultati chiaramente positivi anche in caso di test cutanei negativi e quindi non di rado è più sensibile del test cutaneo, in alcune circostanze può persino sostituire il test cutaneo con farmaci (intradermico o epicutaneo), che richiede molto tempo. D’altra parte, si tratta di un test costoso. Le analisi sono giustificate solo se c’è il ragionevole sospetto di un’allergia al farmaco e l’indicazione deve essere fatta dallo specialista.
Messaggi da portare a casa
- Le allergie tardive ai farmaci possono assumere varie forme, da un lieve esantema a reazioni pericolose per la vita.
- La diagnosi è solitamente difficile e si basa sull’anamnesi, sui test cutanei e sul classico test di trasformazione dei linfociti (LTT).
- I test di provocazione sono scarsamente standardizzati per le reazioni di tipo tardivo (dose singola o ciclo completo di terapia?).
- La cito-LTT si basa sulla misurazione di una combinazione di citochine nei surnatanti delle colture cellulari e ha sostituito la classica LTT nella diagnostica di routine, grazie alla sua maggiore sensibilità.
Ulteriori letture:
- Yawalkar N, Egli F, Pichler WJ, et al: Infiltrazione di cellule T citotossiche nelle eruzioni cutanee indotte da farmaci. Clin Exp Allergy 2000; 30: 847-855.
- Pichler WJ: Meccanismo immunitario dell’ipersensibilità ai farmaci. Immunol Allergy Clin North Am 2004; 24(3): 373-397, Recensione.
- Lochmatter P, Beeler A, Pichler WJ, et al.: Rilascio in vitro farmaco-specifico di IL-2, IL-5, IL-13 e IFN-gamma in pazienti con ipersensibilità ai farmaci di tipo ritardato. Allergia 2009; 64: 1269-1278.
- Naisbitt DJ, Farrell J, Pichler WJ, et al: Caratterizzazione delle cellule T farmaco-specifiche nell’ipersensibilità alla lamotrigina. J Allergy Clin Immunol 2003; 111(6): 1393-1403.
- Pichler WJ, Tilch J: Il test di trasformazione dei linfociti nella diagnosi di ipersensibilità ai farmaci. Allergia 2004; 59(8): 809-820.
PRATICA DERMATOLOGICA 2018; 28(2): 23-25