La neutropenia è un ospite frequente nella pratica come quadro clinico indipendente, ma anche come sintomo concomitante di molte malattie e come reazione avversa ai farmaci. La suscettibilità associata alle infezioni può rappresentare una sfida in molti casi. Una buona gestione previene conseguenze pericolose.
La neutropenia è un ospite frequente nella pratica ematologica e oncologica come quadro clinico indipendente, ma anche come sintomo di accompagnamento di molte malattie e come reazione avversa ai farmaci. La suscettibilità associata alle infezioni può rappresentare una sfida in molti casi. Ciò è dovuto, tra l’altro, all’ampiezza dello spettro clinico. Dalla situazione di emergenza della neutropenia febbrile alla forma cronica, spesso innocua, tutto è rappresentato. Di conseguenza, per una gestione ottimale, è importante conoscere la causa della neutropenia.
Gravità della neutropenia
Anche l’approccio terapeutico varia a seconda della gravità e quindi del rischio di infezione. Per forma lieve si intende una conta assoluta dei neutrofili (ANC) compresa tra 1000 e 1500 cellule per microlitro. La neutropenia moderata è presente con ANC tra 500 e 1000 cellule per microlitro e la neutropenia/agranulocitosi grave ha ANC inferiore a 500 cellule per microlitro (Tabella 1) .
Sebbene le forme lievi spesso non richiedano un trattamento, l’uso immediato ed empirico di antibiotici ad ampio spettro e, se necessario, di fattore stimolante le colonie di granulociti (G-CSF) è indicato nei casi di febbre e agranulocitosi [1–3].

Non tutta la neutropenia è uguale
Per la caratterizzazione della neutropenia, è importante non solo la sua gravità, ma anche il suo decorso. In linea di principio, si distingue tra forme acute e croniche. La dinamica temporale, i farmaci e le infezioni precedenti, così come la storia familiare, possono fornire informazioni sul meccanismo sottostante. Esistono forme primarie e secondarie di neutropenia (panoramica 1) . La neutropenia primaria è molto più rara della neutropenia causata da cause estrinseche. Tuttavia, devono essere presi in considerazione soprattutto nei pazienti più giovani, con decorso cronico fin dall’infanzia e un’anamnesi familiare positiva [2–4].

La neutropenia cronica idiopatica è una delle neutropenie primarie più comuni. A essere colpite sono soprattutto le donne. Con una durata di almeno tre mesi, è una diagnosi di esclusione. Di conseguenza, non devono esserci cause genetiche, infettive, infiammatorie, autoimmuni, maligne o legate ai farmaci. Sebbene vi sia una maggiore suscettibilità alle infezioni batteriche, la malattia ha solitamente un decorso benigno. Il trattamento con G-CSF non è sempre necessario e non è raccomandato con valori di ANC superiori a 500 cellule/µl e senza la presenza di infezioni ricorrenti [5]. Deve essere valutato individualmente. Finora non è stata trovata alcuna causa per le grandi differenze individuali nella suscettibilità all’infezione.
La neutropenia etnica benigna, che colpisce soprattutto le persone di origine africana e mediterranea, di solito non ha effetti clinici o ha un decorso lieve [6]. Questo vale anche per la neutropenia familiare benigna, che è chiaramente determinata geneticamente ma indipendente dall’etnia [2]. Mentre la base genetica della neutropenia familiare benigna è sconosciuta, la neutropenia etnica benigna è associata a varianti del recettore dell’antigene Duffy [7,8].
Un altro esempio di neutropenia congenita per lo più lieve è la neutropenia ciclica. Si tratta di un disturbo ereditario autosomico dominante, spesso con mutazioni nel gene ELANE [9]. È caratterizzata da fluttuazioni periodiche nella conta dei neutrofili con un tempo di oscillazione di circa 21 giorni. Durante il nadir, alcuni pazienti sviluppano afte orali o altre infezioni, ma il decorso complessivo è per lo più benigno [2].
La sindrome di Kostmann, nota anche come neutropenia congenita grave (SCN), invece, è una condizione che comporta un’elevata suscettibilità alle infezioni già nell’infanzia e aumenta il rischio di sviluppare una leucemia mieloide acuta [10]. La neutropenia persistente nei bambini, negli adolescenti o nei giovani adulti può indicare un’insufficienza midollare sottostante. In questi casi, si raccomanda un ulteriore chiarimento da parte di esperti specializzati.
Sebbene la neutropenia congenita e idiopatica non debba essere trascurata nel chiarimento delle cause, nella maggior parte dei casi la neutropenia isolata è acquisita. Vari farmaci, malattie del midollo osseo, sintomi di carenza, infezioni e processi immunologici possono essere considerati come fattori scatenanti.
Un fenomeno comune: la neutropenia indotta dai farmaci
La percentuale maggiore di neutropenie è dovuta ai farmaci [1,11–13]. L’incidenza dell’agranulocitosi iatrogena è di circa 1-5 per milione di popolazione all’anno, con un tasso di mortalità di circa il 5% [1,14]. In genere, c’è un’associazione temporale con la terapia farmacologica. In linea di principio, molti farmaci possono causare neutropenia attraverso due meccanismi diversi, con più della metà dei casi scatenati da pochi agenti (Panoramica 2) [11–16,22]. Da un lato, gli anticorpi indotti dai farmaci possono portare alla distruzione immuno-mediata dei granulociti neutrofili. D’altra parte, esistono agenti con effetti citotossici diretti sui precursori mieloidi, come le fenotiazine, la clozapina, il dapsone e la procainamide [15].

A differenza della neutropenia immuno-mediata, la tossicità diretta è dose-dipendente. Mentre in questo caso la quantità fa il veleno, il danno ai granulociti nel contesto della formazione di anticorpi indotta dai farmaci è indipendente dal tempo e dalla dose. Poiché la sensibilizzazione è destinata a durare tutta la vita, una piccola dose della sostanza scatenante è sufficiente a causare neutropenia o addirittura agranulocitosi ripetutamente. A causa dei diversi meccanismi di danno ai neutrofili, gli effetti dei diversi farmaci sono difficili da prevedere e caratterizzare. La Figura 1 offre una panoramica di alcuni valori empirici.
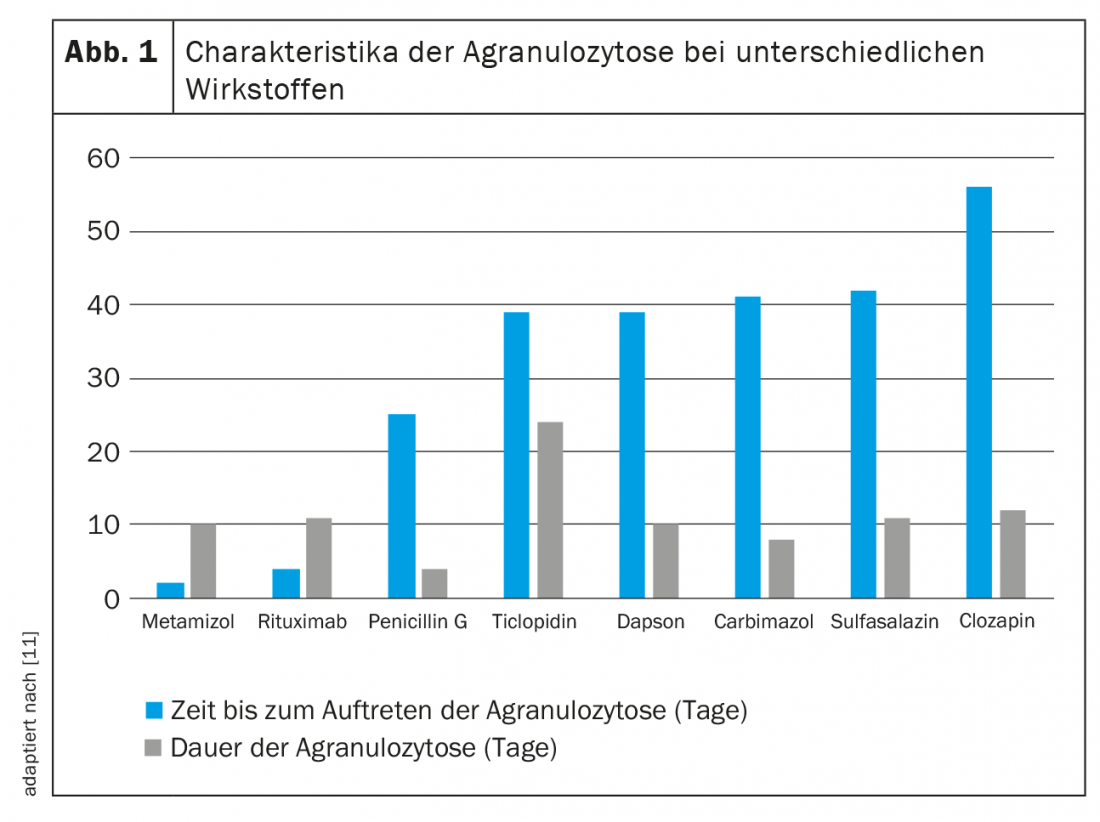
Probabilmente l’agente più noto che presenta un rischio di agranulocitosi è il metamizolo (Novalgin®). I dati corrispondenti sono stati pubblicati già nel 1964 [16]. La neutropenia si verifica solitamente nei primi due mesi di trattamento e si normalizza entro due settimane [11]. Si stima che il rischio di neutropenia indotta da metamizolo sia compreso tra 1/116 e 1/466 000 esposizioni. Il rischio assoluto è basso con un dosaggio normale e un uso breve, con grandi differenze geografiche [17,18]. Mentre l’incidenza è alta in Svezia, ad esempio, sembra essere più bassa nei Paesi Bassi o in Spagna. Questo potrebbe essere dovuto a diversi modelli di utilizzo, in quanto il rischio aumenta con la somministrazione prolungata del farmaco e con una co-medicazione sfavorevole. L’ipotesi che, ad esempio, i britannici, gli irlandesi e gli scandinavi abbiano un rischio maggiore di agranulocitosi correlata al metamizolo a causa della loro etnia è stata esaminata in uno studio epidemiologico [19]. Ciò ha permesso di concludere che alcuni alleli HLA potrebbero anche essere associati allo sviluppo di neutropenia sotto terapia con metamizolo.
La conclusione è che il metamizolo – sebbene critico dal punto di vista ematologico – è una scelta difendibile in alcuni casi, nonostante il rischio di agranulocitosi, soprattutto rispetto ad analgesici alternativi come i farmaci antinfiammatori non steroidei (FANS). Questi tendono ad avere un profilo di effetti collaterali ancora meno favorevole, che non deve essere trascurato [20]. Tuttavia, il metamizolo deve essere usato con cautela e con la necessaria attenzione. Sebbene i controlli di laboratorio regolari non siano raccomandati nei pazienti asintomatici, i soggetti affetti dovrebbero essere istruiti sul rischio di agranulocitosi e sui suoi sintomi [21].
In generale, l’età avanzata, il cattivo stato di salute, la sepsi o lo shock, l’insufficienza renale e i valori di ANC inferiori a 100 cellule/µl sono considerati fattori prognostici sfavorevoli nella neutropenia indotta da farmaci [1]. D’altra parte, la terapia con antibiotici ad ampio spettro per via endovenosa e G-CSF migliora la prognosi [1]. Grazie alla crescente esperienza nella gestione dei pazienti affetti, negli ultimi anni sono stati fatti grandi progressi in questo campo. Tuttavia, la somministrazione di G-CSF in particolare è ancora controversa. Statisticamente, la somministrazione mostra ricoveri più brevi e un minor uso di antibiotici, ma non esistono linee guida chiare sull’uso del G-CSF nell’agranulocitosi non chemioterapica, indotta da farmaci [13,22–24]. Se la conta dei neutrofili è inferiore a 100 cellule/µl, devono essere somministrati fattori di crescita ematopoietici, altrimenti la decisione deve essere valutata individualmente.
Neutropenia e infezioni: La gallina e l’uovo
I virus come l’HIV, l’EBV, il CMV, l’epatite A e il Sars-CoV-2 possono causare neutropenia. Inoltre, la neutropenia può verificarsi nella febbre tifoidea, nella brucellosi, nella tularemia, nella shigellosi e nella tubercolosi, con la carenza di neutrofili che favorisce nuovamente l’infezione. Anche le Rickettsiae e vari parassiti possono causare neutropenia. L’influenza è più diffusa alle nostre latitudini e colpisce la Svizzera ogni anno. Si verificano per lo più casi lievi e transitori di neutropenia, ma esiste una chiara associazione. Il rischio sembra essere più elevato per l’influenza B che per l’influenza A [25]. Un altro rischio che può essere eliminato con la vaccinazione antinfluenzale.
Gestione nella vita clinica quotidiana
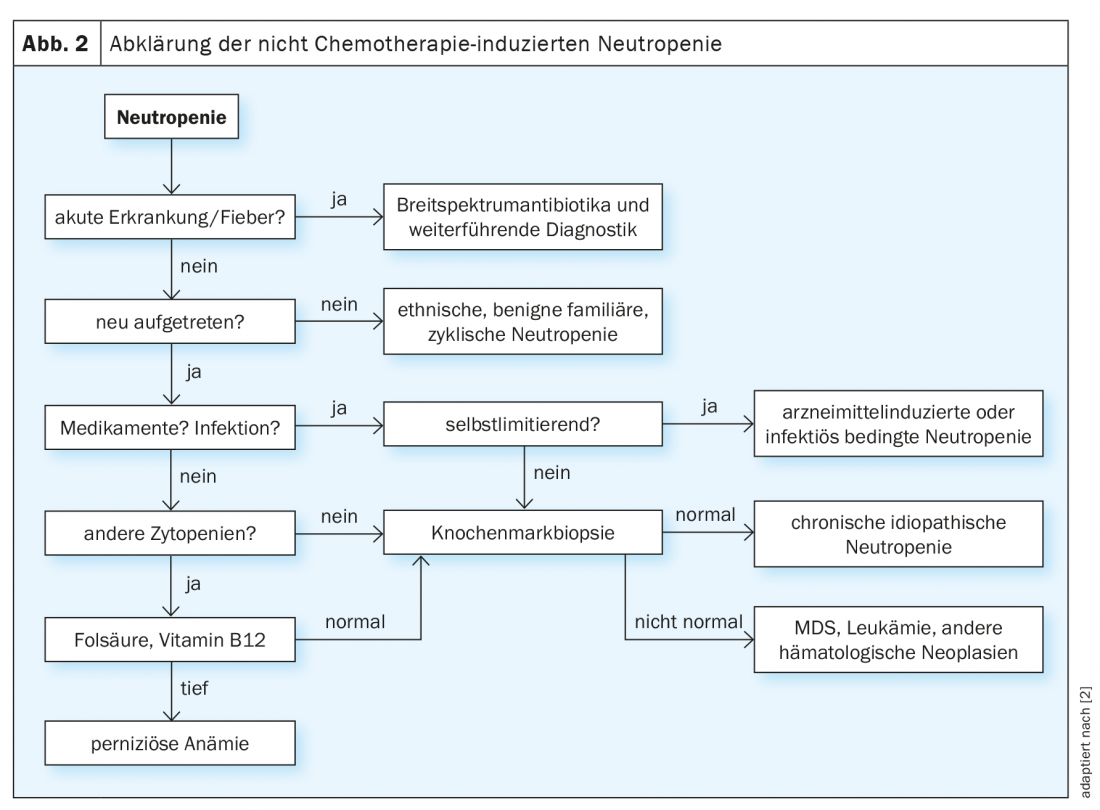
Mentre la febbre nella neutropenia è sempre un’indicazione per un’adeguata terapia antibiotica con o senza somministrazione di G-CSF, la successiva ricerca della causa spesso si rivela un processo lungo (Fig. 2) [2,3]. I decorsi cronici, soprattutto lievi, in età adulta sono più indicativi di forme primarie di neutropenia, come la neutropenia etnica benigna. Un’insorgenza acuta, invece, è un indicatore di una genesi farmacologica o infettiva del disturbo, soprattutto se c’è un’esposizione corrispondente nell’anamnesi. Se la conta dei neutrofili si normalizza nel corso della malattia, in questo caso non sono necessari ulteriori chiarimenti. Tuttavia, se l’eziologia rimane poco chiara, è necessario eseguire un esame del midollo osseo.
La terapia della neutropenia non indotta da chemioterapia dipende principalmente dal rischio individuale di infezione e dalla causa, per cui lo spettro va dalla somministrazione continua di G-CSF a una procedura di attesa. È importante che tutti i pazienti conoscano il proprio rischio individuale di infezione, nonché i segnali di avvertimento e le precauzioni, e possano agire di conseguenza.
In caso di infezioni acute, la somministrazione di G-CSF può essere considerata [2,3,26]. Questo non dovrebbe mai basarsi esclusivamente sulla conta dei neutrofili e quindi dovrebbe essere utilizzato solo in caso di neutropenia sintomatica. Anche un aumento dell’ANC a oltre 250-300 cellule/µl può ridurre drasticamente il tasso di infezione nei pazienti sintomatici [2].
Naturalmente, la terapia causale della neutropenia – se disponibile – è la prima priorità. La sostituzione dell’acido folico e della vitamina B12 e, ad esempio, il trattamento della neutropenia autoimmune con metotrexato o ciclofosfamide sono solo alcuni esempi che illustrano l’importanza di un’adeguata chiarificazione delle cause [27].
Caso speciale COVID-19
Ci sono solo pochi dati, ma comunque piuttosto preoccupanti, sulla somministrazione di G-CSF in presenza di infezione da Sars-CoV-2, soprattutto nei pazienti con tumore. Ad esempio, in uno studio che comprendeva 55 pazienti, è stato osservato un esito peggiore della malattia con il trattamento con G-CSF [28]. Le 16 persone che hanno ricevuto il G-CSF hanno avuto una maggiore richiesta di ossigeno e mortalità. In uno studio di tre casi, è stato ipotizzato che il G-CSF promuova l’infiammazione e l’attivazione dei macrofagi. In tutti i pazienti, il deterioramento clinico si è verificato circa 72 ore dopo la somministrazione del farmaco [29]. Osservazioni simili sono state descritte in un altro rapporto su un paziente COVID-19 di 47 anni [30].
Il rischio del trattamento con G-CSF in presenza di COVID-19 non può certamente essere valutato in modo definitivo sulla base dei dati attuali. La necessità di ulteriori dati è grande e questo potrebbe essere innovativo per gli anni a venire.
Prospettiva
Un’analisi retrospettiva di tutti i casi con neutropenia isolata inferiore a 500 cellule/µl tra il 2015 e il settembre 2020 è attualmente in corso presso l’Inselspital Universitario di Berna. I pazienti con chemioterapia o radioterapia e quelli con altre citopenie concomitanti non sono inclusi. L’obiettivo principale è quello di raccogliere dati sulla causa, la terapia, i tassi di infezione e di ospedalizzazione, nonché altri esiti. Speriamo di scoprire correlazioni che potrebbero essere rilevanti per la stratificazione del rischio e quindi anche a livello terapeutico.
Messaggi da portare a casa
- La neutropenia/agranulocitosi deve ricevere la nostra attenzione a causa dell’aumento del rischio di infezione con possibili decorsi gravi.
- La neutropenia indotta da farmaci è la forma più comune di neutropenia isolata.
- Le forme croniche benigne di neutropenia negli adulti sono diagnosi di esclusione e di solito hanno un decorso benigno.
- Il trattamento con G-CSF deve sempre essere valutato individualmente ed è consigliato per le infezioni ricorrenti e per le conte dei neutrofili inferiori a 0,5 ×109/L. La somministrazione profilattica di antibiotici non è raccomandata.
- La neutropenia può verificarsi come conseguenza dell’infezione da COVID-19. L’effetto del G-CSF nei pazienti COVID-19 non è ancora chiaro. L’uso di G-CSF, soprattutto nei pazienti con tumore, deve essere fatto con cautela fino a quando non saranno disponibili ulteriori dati.
Letteratura:
- Andres E, et al: Presentazione clinica e gestione dell’agranulocitosi indotta da farmaci. Expert review of hematology 2011; 4(2): 143-151.
- Gibson C, Berliner N: Come valutiamo e trattiamo la neutropenia negli adulti. Sangue 2014; 124(8): 1251-1258.
- Dale DC: Come diagnostico e tratto la neutropenia. Current opinion in hematology 2016; 23(1): 1-4.
- Palmblad J, et al: Come diagnostichiamo e trattiamo la neutropenia negli adulti. Expert review of hematology 2016; 9(5): 479-487.
- Dale DC, Bolyard AA: Un aggiornamento sulla diagnosi e sul trattamento della neutropenia cronica idiopatica. Curr Opin Hematol 2017; 24(1): 46-53.
- Atallah-Yunes SA, Ready A, Newburger PE: Neutropenia etnica benigna. Recensioni sul sangue 2019; 37: 100586.
- Rappoport N, et al: Il recettore dell’antigene Duffy per le chemochine, ACKR1,- ‘Jeanne DARC’ della neutropenia benigna. British journal of haematology 2019; 184(4): 497-507.
- Reich D, et al: La riduzione del numero di neutrofili nelle persone di origine africana è dovuta a una variante regolatoria nel gene del recettore dell’antigene Duffy per le chemochine. PLoS Genet 2009; 5(1): e1000360.
- Dale DC: Neutropenia ciclica e cronica: un aggiornamento sulla diagnosi e sul trattamento. Progressi clinici in ematologia e oncologia 2011; 9(11): 868-869.
- Welte K, Zeidler C, Dale DC: Neutropenia congenita grave. Seminari di ematologia. 2006; 43(3): 189-195.
- Andersohn F, Konzen C, Garbe E: Revisione sistematica: agranulocitosi indotta da farmaci non chemioterapici. Annali di medicina interna 2007; 146(9): 657-665.
- Garbe E: Agranulocitosi indotta da farmaci non chemioterapici. Opinione di esperti sulla sicurezza dei farmaci 2007; 6(3): 323-335.
- Andres E, et al: Gestione moderna dell’agranulocitosi indotta da farmaci non chemioterapici: studio di coorte monocentrico di 90 casi e revisione della letteratura. European journal of internal medicine 2002; 13(5): 324-328.
- Kaufman DW, et al: Incidenza relativa di agranulocitosi e anemia aplastica. Am J Hematol 2006; 81(1): 65-67.
- Tesfa D, Keisu M, Palmblad J: Agranulocitosi idiosincratica indotta da farmaci: possibili meccanismi e gestione. American journal of hematology 2009; 84(7): 428-434.
- Huguley CM: Agranulocitosi indotta dal dipirone, un pericoloso antipiretico e analgesico. JAMA 1964; 189: 938-941.
- Ibanez L, et al: Agranulocitosi associata a dipirone (metamizolo). European journal of clinical pharmacology 2005; 60(11): 821-829.
- Hedenmalm K, Spigset O: Agranulocitosi e altre discrasie ematiche associate al dipirone (metamizolo). European journal of clinical pharmacology 2002; 58(4): 265-274.
- Shah RR: Agranulocitosi indotta da metamizolo (dipirone): il rischio varia in base all’etnia? J Clin Pharm Ther 2019; 44(1): 129-133.
- Fauler J: Effetti indesiderati dei FANS e dei coxib. MMW Advances in Medicine 2005; 147(31-32): 31-35.
- Stamer UM, et al.: Dipirone (metamizolo): Considerazioni sul monitoraggio per la diagnosi precoce dell’agranulocitosi. Dolore 2017; 31(1): 5-13.
- Njue L, Baerlocher GM: Neutropenia/agranulocitosi indotta da farmaci. il medico informato 2018; 02/2018: 23-26.
- Beauchesne MF, Shalansky SJ: Agranulocitosi indotta da farmaci non chemioterapici: una revisione di 118 pazienti trattati con fattori stimolanti le colonie. Farmacoterapia 1999; 19(3): 299-305.
- Sprikkelman A, de Wolf JT, Vellenga E: L’applicazione dei fattori di crescita emopoietici nell’agranulocitosi indotta da farmaci: una revisione di 70 casi. Leucemia 1994; 8(12): 2031-2036.
- Higgins P, et al: Tassi di neutropenia negli adulti con influenza A o B: un’analisi retrospettiva dei pazienti ricoverati nel Queensland sudorientale durante il 2015. Intern Med J 2016; 46(11): 1328-1332.
- Dale DC, et al: Studio randomizzato e controllato di fase III sul fattore ricombinante umano di stimolazione delle colonie di granulociti (filgrastim) per il trattamento della neutropenia cronica grave. Sangue 1993; 81(10): 2496-2502.
- Starkebaum G: Neutropenia cronica associata a malattia autoimmune. Seminari di ematologia 2002; 39(2): 121-127.
- Morjaria S, et al: L’effetto della neutropenia e del filgrastim (G-CSF) nei pazienti oncologici con infezione da COVID-19. medRxiv 2020.
- Nawar T, et al.: Fattore stimolante le colonie di granulociti in COVID-19: stimola più del midollo osseo? Am J Hematol 2020; 95(8): E210-E3.
- Taha M, Sharma A, Soubani A: deterioramento clinico durante il recupero della neutropenia dopo la terapia con G-CSF in un paziente con COVID-19. Respiratory medicine case reports 2020; 31: 101231.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(1): 5-9