Le malattie glomerulari sono cause importanti di insufficienza renale in fase terminale. Dal punto di vista patogenetico, i processi immuno-mediati sono in primo piano. Grazie alla conoscenza avanzata della fisiopatologia e ai moderni metodi di ingegneria genetica, c’è la speranza di una terapia il più possibile mirata e con pochi effetti collaterali. I nuovi approcci terapeutici per le malattie glomerulari sono brevemente evidenziati in questo articolo e alcune sostanze sono presentate come esempi.
Le glomerulopatie (GP) sono una causa importante di insufficienza renale cronica e terminale. Negli Stati Uniti, la nefropatia diabetica è al primo posto e la GP non diabetica al terzo posto nell’eziologia dell’insufficienza renale terminale (TNV). La patogenesi di questo gruppo eterogeneo di malattie è per lo più immuno-mediata. I principi terapeutici generali includono la terapia di supporto e la terapia specifica in alcuni casi. In genere si tratta di immunosoppressori relativamente poco mirati, con una tossicità talvolta cumulativa, che si rivela problematica nella GP, che spesso recidiva. Grazie alla crescente delucidazione dei processi patogenetici di diverse GP negli ultimi decenni e ai moderni metodi di ingegneria genetica, c’è la speranza di una terapia mirata orientata al pato-meccanismo.
Questa panoramica intende citare i nuovi sviluppi nella terapia delle malattie glomerulari, senza pretendere di essere completa. Verranno evidenziati argomenti rilevanti per la pratica, nonché approcci e concetti terapeutici innovativi.
Terapia di supporto
Come per tutte le malattie renali croniche, è essenziale una terapia di supporto ottimale. In alcuni casi, è possibile evitare i trattamenti immunosoppressivi e migliorare la prognosi renale e/o generale. È qui che il fornitore di cure primarie ha un ruolo chiave da svolgere. I capisaldi terapeutici sono riportati nella Tabella 1.
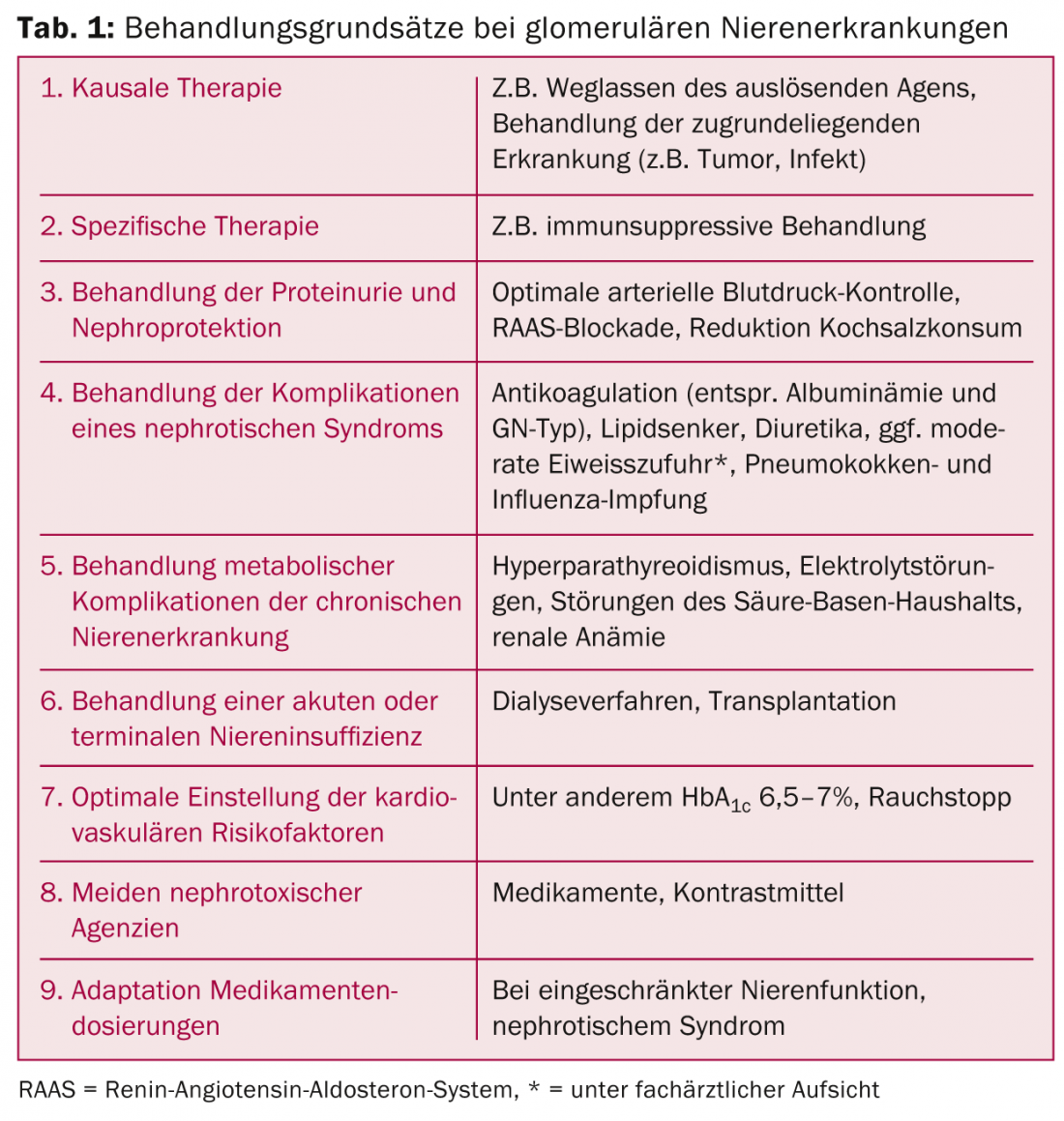
Nel trattamento della proteinuria, oltre al controllo rigoroso dei valori della pressione arteriosa (<130/90 mmHg per i non diabetici, <130/ 85 mmHg per i diabetici) [1] e al consumo limitato di sale (5-6 g/d), è indicata l’inibizione farmacologica del sistema renina-angiotensina-aldosterone (RAAS). Gli ACE-inibitori e i sartani vengono esauriti dopo la tolleranza (dose massima più elevata rispetto al trattamento dell’ipertensione). L’evidenza degli ultimi anni ha messo in dubbio il valore del doppio blocco del RAAS [2,3]. Infatti, i diabetici in particolare mostrano un rischio maggiore di iperkaliemia e di insufficienza renale acuta, con una prognosi cardiovascolare concomitante non migliorata, nonostante un effetto additivo sulla proteinuria. Pertanto, la nuova introduzione di questi farmaci nei pazienti con reni non può più essere generalmente raccomandata. La combinazione di un ACE inibitore o di un sartano con gli antagonisti dell’aldosterone ha un effetto sinergico sulla proteinuria, ma aumenta il rischio di episodi di iperkaliemia grave, soprattutto in caso di funzionalità renale compromessa.
Terapia diretta alle cellule B
A causa del loro ruolo centrale nella patogenesi delle malattie autoimmuni (produzione di autoanticorpi patogeni, presentazione dell’antigene, produzione di citochine proinfiammatorie), negli ultimi anni i linfociti B sono stati esplorati come bersaglio terapeutico in vari GP.
Rituximab
Il rituximab (RTX) è un anticorpo monoclonale chimerico (topo/umano) diretto contro l’antigene di superficie CD20 dei linfociti B (Tab. 2) . Il legame con questo antigene induce la lisi cellulare e porta alla deplezione delle cellule B nel sangue periferico. Dalla sua introduzione per il trattamento del linfoma non-Hodgkin nel 1997, l’uso di RTX è stato esteso alle malattie autoimmuni come l’artrite reumatoide e alla medicina dei trapianti. Il RTX è stato utilizzato nel trattamento di varie GP [4]. Le indicazioni più importanti attualmente in fase di studio sono la vasculite associata ad ANCA, la nefrite lupica e la glomerulopatia membranosa idiopatica.
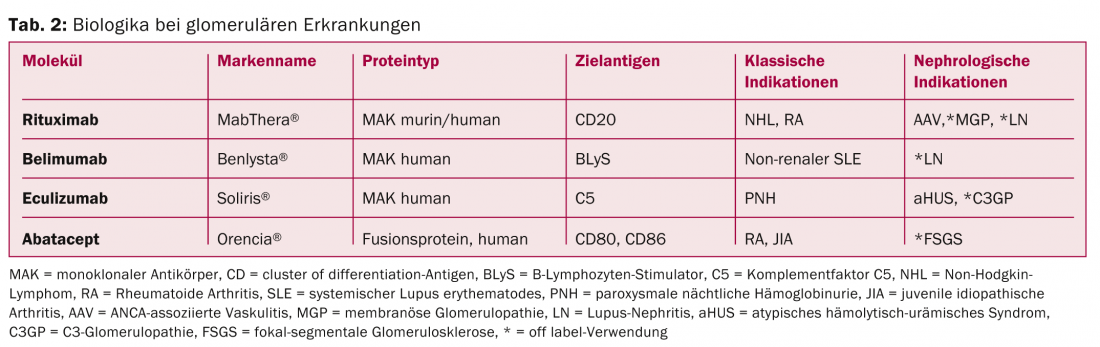
Vasculite associata agli ANCA (AAV): La terapia dell’AAV con RTX è stata approvata in Svizzera nel 2012. L’approvazione si basa su due studi randomizzati e controllati (RCT) che includevano pazienti con coinvolgimento renale dell’AAV; gli studi hanno dimostrato un’efficacia comparabile (forse anche maggiore nelle recidive) con tassi di effetti collaterali (inaspettatamente) comparabili alla terapia standard con ciclofosfamide e steroidi ad alte dosi [5,6]. Secondo le linee guida internazionali, questa terapia può essere considerata un’alternativa alla terapia standard. A causa della mancanza di dati a lungo termine, la sostanza viene attualmente utilizzata nella pratica soprattutto nelle controindicazioni alla terapia convenzionale (ad esempio, il desiderio dei bambini), nelle ricadute o nei casi refrattari.
Nefrite da lupus (LN): l’RTX è stato utilizzato con successo per trattare la LN in numerosi studi osservazionali e serie di casi (soprattutto nelle recidive gravi, nelle ricadute, nelle situazioni refrattarie e nelle controindicazioni alla terapia convenzionale). Due RCT con RTX come terapia aggiuntiva in pazienti con lupus eritematoso sistemico attivo renale o extrarenale mostrano tassi di remissione comparabili alla terapia con placebo [7,8]. Nonostante questi risultati deludenti, che gli esperti attribuiscono tra l’altro al disegno dello studio, e incoraggiati dai dati di follow-up e dall’esperienza pratica, molti medici continuano a trattare off-label con RTX, soprattutto nelle situazioni menzionate. Sono previsti ulteriori studi di valutazione del RTX per il trattamento della LN in base a diversi regimi immunosoppressivi.
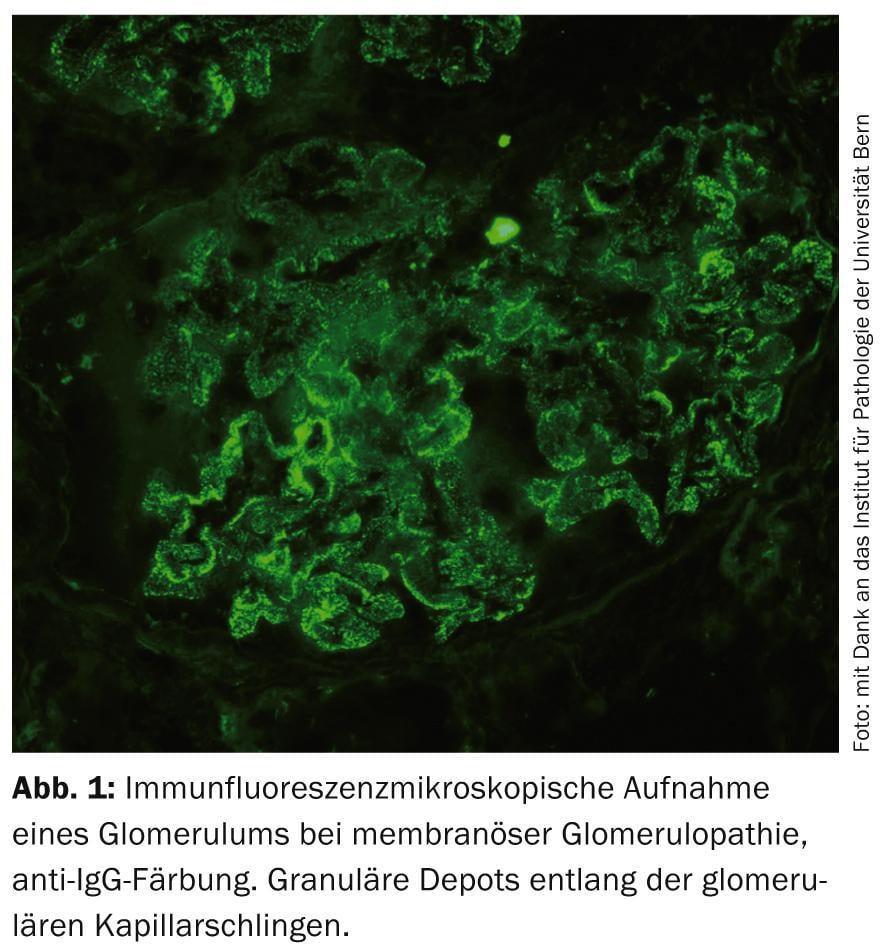
Glomerulopatia membranosa idiopatica (MGP): la MGP è una delle GP primarie più comuni (Fig. 1) . I risultati di ricerche rivoluzionarie dell’ultimo decennio hanno fornito la prova che la MGP è una malattia autoimmune con la formazione di autoanticorpi contro gli antigeni podocitari [9]. In questo contesto, la terapia con RTX è interessante dal punto di vista fisiopatologico. L’RTX è stato finora utilizzato con successo in numerosi studi osservazionali con un’ampia varietà di regimi di somministrazione per trattare principalmente i casi refrattari [10]. Attualmente mancano dati controllati e a lungo termine, ma sono in corso diversi RCT che confrontano questa sostanza con terapie di supporto o altre terapie immunosoppressive. In pratica, l’RTX viene attualmente utilizzato off-label nella MGP soprattutto nei casi di autoanticorpi rilevati.
L’uso diffuso di RTX mostra una tollerabilità generalmente buona. Gli effetti collaterali più frequenti includono reazioni all’infusione (per cui è necessaria la somministrazione di una premedicazione), neutropenia, ipogammaglobulinemia e infezioni; sono stati descritti singoli casi di leucoencefalopatia multifocale progressiva.
Le plasmacellule non vengono depauperate dall’RTX, mentre le cellule B derivate dai tessuti possono essere depauperate solo parzialmente. Un effetto limitato esiste ancora nella sindrome nefrosica, nei polimorfismi del recettore Fc-γ e nei livelli elevati di fattore di stimolazione delle cellule B (BLyS). Inoltre, anche una piccola parte dei linfociti B, i linfociti B regolatori con effetti antinfiammatori, si sta esaurendo.
Belimumab
Belimumab (BEL) è un anticorpo monoclonale umanizzato che si lega alla BLyS solubile, inibendo la sopravvivenza delle cellule B e la loro differenziazione in plasmacellule. BEL è stato recentemente approvato per il trattamento del LES extrarenale. Le analisi post-hoc dei dati mostrano un tasso forse ridotto di recidiva renale nei pazienti trattati con BEL [11]. Gli studi sul LES renale con o senza somministrazione di RTX (come immunomodulazione sinergica delle cellule B) contribuiranno a definire il ruolo di BEL per i nefrologi.
Eculizumab
Eculizumab (ECU) è un anticorpo monoclonale umanizzato contro il fattore C5 del complemento, che si trova all’estremità comune della cascata di attivazione del complemento. Inizialmente utilizzato per il trattamento dell’emoglobinuria parossistica notturna, il preparato è stato approvato dal 2011 per il trattamento della sindrome emolitico-uremica atipica. Un’altra entità patologica basata sulla disregolazione della via alternativa del complemento sono le glomerulopatie da C3 (C3GP), che sono state recentemente distinte dalle classiche glomerulonefriti membranoproliferative mediate da immunocomplessi (ad esempio nelle infezioni, nelle neoplasie) grazie alle recenti scoperte [12]. In questo contesto, il successo dell’uso dell’ECU è stato documentato nelle descrizioni dei casi. A causa del danno frequentemente mediato dal complemento, l’ECU è stato testato anche in altre GN come la nefropatia IgA, la LN e la MGP. Le speranze di un uso diffuso sono attualmente smorzate dai costi estremamente elevati di una terapia potenzialmente a vita.
Abatacept
La proteina di fusione Abatacept (ABT) si lega all’antigene CD80 sulle cellule T e quindi inibisce la costimolazione delle cellule T da parte delle cellule presentanti l’antigene. Finora, esistono dati soprattutto in LN (RCT, negativo) e AAV (osservazionale, positivo). È interessante notare che l’induzione delle molecole di superficie CD80 nei podociti è stata recentemente dimostrata nel caso della malattia renale proteinurica. L’ABT è stato quindi utilizzato con successo in cinque pazienti con glomerulosclerosi focale segmentaria primaria (FSGS) e con FSGS ricorrente dopo il trapianto di rene [13]. Questi dati promettenti attendono di essere confermati da ulteriori studi.
Steroidi topici per la nefropatia IgA
La nefropatia IgA (IgA-NP) è la GP più comune a livello mondiale. I depositi mesangiali di anticorpi IgA insufficientemente glicosilati, insieme agli autoanticorpi indotti, portano all’infiammazione glomerulare. Si presume che la causa sia una disregolazione del sistema immunitario mucoso, che porta a una tolleranza immunitaria difettosa nei confronti, ad esempio, di antigeni alimentari o batterici. In uno studio svedese di prova di principio, la budesonide in una nuova formulazione con rilascio nella regione ileocecale è stata utilizzata per trattare i pazienti con IgA-NP ed è stata osservata una riduzione della proteinuria. Interessante, oltre al nuovo concetto terapeutico, è la minimizzazione degli effetti sistemici indotti dagli steroidi [14]. Attualmente è in corso uno studio di fase II.
Ormone adrenocorticotrofico
L’ormone adrenocorticotropo (ACTH) è stato utilizzato per trattare la sindrome nefrosica già negli anni ’50, ma poi è stato abbandonato a favore dei glucocorticoidi orali, più facili da somministrare. Grazie a una riscoperta accidentale in uno studio sui lipidi in pazienti nefrosici con MGP, negli ultimi anni è stato sempre più utilizzato nella GP proteinurica (ACTH sintetico in Europa, ACTH di origine animale in forma di gel negli Stati Uniti). Il meccanismo d’azione sembra andare oltre l’induzione della produzione di cortisolo ed essere mediato dal legame con i recettori della melanocortina sui podociti. Esistono dati osservazionali per la malattia a variazione minima e la FSGS primaria, mentre per la MGP esiste un RCT pilota con risultati promettenti [15]. Sono stati descritti effetti collaterali simili agli steroidi. Anche in questo caso, i costi elevati della terapia sono un fattore limitante.
Eprodisate
L’amiloidosi AA è una malattia multisistemica che può verificarsi nelle infezioni croniche o nelle malattie infiammatorie ed è caratterizzata da depositi fibrillari di amiloide A sierica, una proteina della fase acuta. Il frequente coinvolgimento renale si manifesta con proteinuria e insufficienza renale. Oltre al trattamento della malattia di base, un nuovo bersaglio terapeutico sono i depositi fibrillari. L’eprodisato è una molecola solfonata con somiglianza strutturale all’eparan solfato che si lega ai siti di legame del glicosaminoglicano sulla proteina amiloide A del siero e inibisce la polimerizzazione delle fibrille. Un recente RCT ha mostrato un rallentamento del declino della funzione renale [16].
Ulteriori studi devono confermare questi risultati.
Conclusione per la pratica
- Non esiste un’indicazione generale per il doppio blocco del RAAS per il trattamento della proteinuria.
- Il rituximab è approvato per la terapia di induzione della vasculite associata ad ANCA e viene utilizzato off-label nella nefrite lupica e nella glomerulopatia membranosa idiopatica.
- Eculizumab è approvato per il trattamento della sindrome emolitica uremica e sono in corso le prime sperimentazioni per l’uso nelle glomerulopatie C3.
- Recentemente è stato descritto il successo dell’uso di abatacept nella glomerulosclerosi focale segmentale primaria e dell’ormone adrenocorticotropo nelle glomerulopatie proteinuriche.
- Esistono interessanti risultati di studi iniziali sulla somministrazione di steroidi topici nella nefropatia IgA.
Letteratura:
- Mancia G, et al: Linee guida ESH/ESC 2013 per la gestione dell’ipertensione arteriosa. Blood Press 2014; 23(1): 3-16.
- Mann JF, et al: Esiti renali con telmisartan, ramipril, o entrambi, in persone ad alto rischio vascolare (studio ONTARGET): uno studio multicentrico, randomizzato, in doppio cieco, controllato. Lancet 2008; 372(9638): 547-553.
- Parving HH, et al: Punti finali cardiorenali in uno studio sull’aliskiren per il diabete di tipo 2. N Engl J Med 2012; 367(23): 2204-2213.
- Mani LY, et al: [Rationale and clinical evidence for the use of rituximab in glomerular diseases]. Rev Med Suisse 2011; 7(290): 819-824.
- Specks U, et al: Efficacia dei regimi di induzione della remissione per la vasculite associata ad ANCA. N Engl J Med 2013; 369(5): 417-427.
- Jones RB, et al: Rituximab rispetto alla ciclofosfamide nella vasculite renale associata ad ANCA. N Engl J Med 2010; 363(3): 211-220.
- Rovin BH, et al: Efficacia e sicurezza del rituximab nei pazienti con nefrite lupica proliferativa attiva: lo studio Lupus Nephritis Assessment with Rituximab. Arthritis Rheum 2012; 64(4): 1215-1226.
- Merrill JT, et al: Efficacia e sicurezza del rituximab nel lupus eritematoso sistemico moderatamente-severo attivo: lo studio randomizzato, in doppio cieco, di fase II/III SLE evaluation of rituximab. Arthritis Rheum 2010; 62(1): 222-233.
- Beck LH, et al: Il recettore della fosfolipasi A2 di tipo M come antigene bersaglio nella nefropatia membranosa idiopatica. N Engl J Med 2009; 361(1): 11-21.
- Ruggenenti P, et al: Rituximab nella nefropatia membranosa idiopatica. J Am Soc Nephrol 2012; 23(8): 1416-1425.
- Dooley MA, et al: Effetto del trattamento con belimumab sugli esiti renali: risultati degli studi clinici di fase 3 con belimumab nei pazienti con LES. Lupus 2013; 22(1): 63-72.
- Fakhouri F, et al: Glomerulopatia C3: una nuova classificazione. Nat Rev Nephrol 2010; 6(8): 494-499.
- Yu CC, et al: Abatacept nella malattia renale proteinurica B7-1-positiva. N Engl J Med 2013; 369(25): 2416-2423.
- Smerud HK, et al.: Nuovo trattamento per la nefropatia IgA: la budesonide enterica mirata alla regione ileocecale migliora la proteinuria. Nephrol Dial Transplant 2011; 26(10): 3237-3242.
- Ponticelli C, et al: Uno studio pilota randomizzato che confronta l’etilprednisolone più un agente citotossico rispetto all’ormone adrenocorticotropo sintetico nella nefropatia membranosa idiopatica. Am J Kidney Dis 2006; 47(2): 233-240.
- Dember LM, et al: Eprodisate per il trattamento della malattia renale nell’amiloidosi AA. N Engl J Med 2007; 356(23): 2349-2360.
CARDIOVASC 2015; 14(1): 9-12