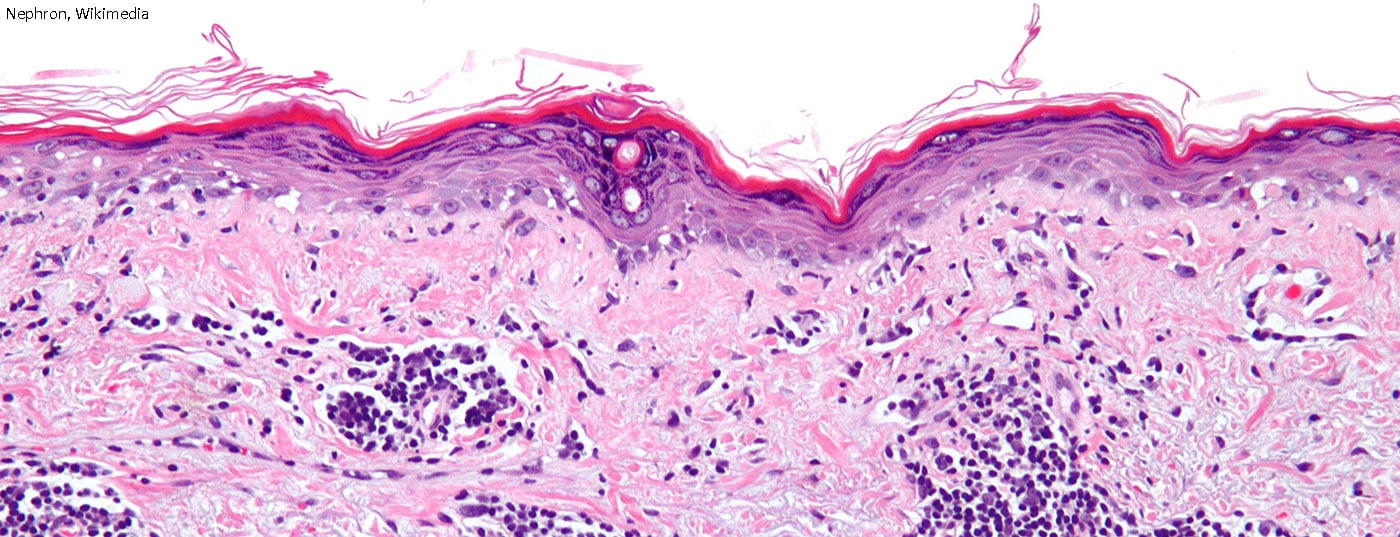
I precedenti criteri di classificazione del lupus eritematoso sistemico (LES) risalgono al 1982 e sono stati modificati solo leggermente nel 1997. È quindi giunto il momento di affrontare la questione e di incorporare lo stato attuale della ricerca e le nuove scoperte. In futuro, si può prevedere l’approvazione di diversi nuovi principi attivi.
Nel 2019, i nuovi criteri di classificazione del LES sono stati sviluppati e pubblicati congiuntamente dalla Lega Europea contro il Reumatismo (EULAR) e dall’American College of Rheumatology (ACR) [1]. Una differenza importante rispetto ai vecchi criteri è che il rilevamento degli anticorpi antinucleari (ANA) è ora considerato un criterio di ingresso migliore rispetto a un criterio di classificazione, a causa della loro elevata sensibilità ma limitata specificità. Inoltre, i singoli criteri, come l’indicazione di ulcere della mucosa orale rispetto alla nefrite lupica istologicamente confermata, devono essere ponderati in modo diverso a seconda della loro importanza.
Nuovi criteri, domini e pesi
“Come prerequisito per l’applicazione dei nuovi criteri, è necessaria la rilevazione positiva degli anticorpi antinucleari (ANA) sulle cellule HEp2, ma è sufficiente che siano stati rilevati una volta con un livello di titolo di 1:80”, ha spiegato il Prof. Dr Christof Specker, Direttore della Clinica di Reumatologia e Immunologia Clinica, Evangelisches Krankenhaus, Kliniken Essen-Mitte. Questo valore di titolo si basa su una meta-analisi di 64 pubblicazioni. Questo ha dimostrato che per un titolo di 1:80, c’era una sensibilità del 98% con una specificità del 75%. A 1:160, la specificità era chiaramente più alta, con l’86%, ma la sensibilità era solo del 96%. Per non escludere nessun paziente con LES, se possibile, è stato scelto il titolo con la sensibilità più elevata. “Bisogna tenere presente che praticamente non esiste un LES senza ANA, ma con una specificità del 75%, uno su quattro non ha affatto il lupus”, dice l’esperto. “E nota bene: oltre il 12% della popolazione normale presenta ANA fino a 1:320!”. Il valore dell’ANA è quindi un criterio di ingresso, ma certamente non è sufficiente da solo per ottenere una diagnosi.
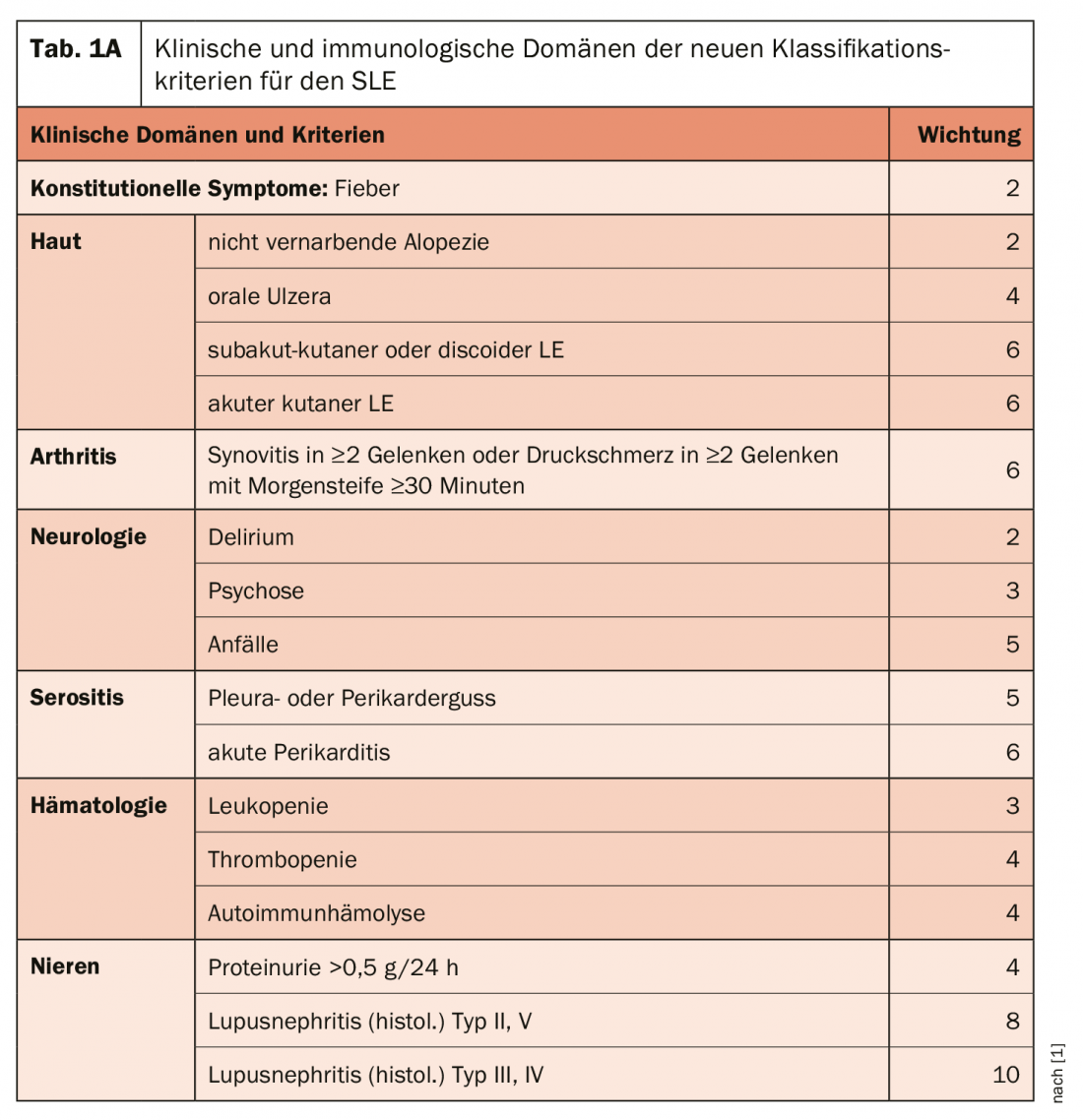
Il dominio dei sintomi costituzionali è nuovo: La febbre senza altra causa è elencata come un sintomo frequentemente riscontrato nel lupus e riceve una ponderazione del 2 Punti (Tab. 1a+b). All’interno di ogni dominio, solo il valore più alto viene incluso nel punteggio totale, il che consente di classificare un paziente come LES se ottiene 10 o più punti. “Quindi non è come in passato, quando si potevano ‘raccogliere’ punti con criteri diversi, ad esempio nell’ambito della pelle, e ottenere 10 o più punti. Uno dei fattori più importanti è, ovviamente, la situazione renale: l’evidenza istologica della nefrite lupica proliferativa (tipo III e IV) da sola dà già 10 punti. e quindi da soli sarebbero sufficienti (insieme alla rilevazione degli ANA) per classificare il lupus. Sul versante del dominio immunologico – sono richiesti un dominio clinico e uno immunologico, ma il dominio immunologico è già fornito con gli ANA – anche gli autoanticorpi altamente specifici hanno il punteggio più alto. Tuttavia, non si deve esprimere alcun giudizio se altri motivi (infezioni, farmaci, altre malattie) possono spiegare anche o meglio i sintomi.

I nuovi criteri di classificazione del LES, se utilizzati correttamente, dovrebbero essere migliori dei precedenti criteri ACR e SLICC, secondo il Prof. Specker. I vantaggi sono la ponderazione e la migliore integrazione dei parametri immunologici, che dovrebbero anche catturare meglio i casi precoci. D’altra parte, ci sono degli svantaggi, come una complessità un po’ più elevata e il titolo limitante molto basso per il rilevamento degli anticorpi antinucleari come criterio di ingresso. Il peso elevato dell’artrite (6 punti) è un motivo per prestare particolare attenzione al fatto che non deve essere causata da altre cause, ha avvertito il reumatologo.
Raccomandazioni di gestione
Nel 2019, è stato pubblicato un aggiornamento delle raccomandazioni EULAR sulla gestione del LES [2]. I “principi generali” che hanno preceduto le raccomandazioni includono l’affermazione che il trattamento del LES che mette a rischio gli organi o la vita consiste in una fase iniziale di terapia immunosoppressiva ad alta intensità per controllare l’attività della malattia, seguita da una fase più lunga di terapia meno intensiva per consolidare la risposta e prevenire le ricadute.
Il trattamento deve mirare alla remissione o a una bassa attività della malattia (livello di evidenza 2b/raccomandazione B) e alla prevenzione delle recidive (2b/B) in tutti gli organi, con il dosaggio più basso possibile di glucocorticoidi. Le ricadute del LES possono essere trattate modificando la dose delle terapie attuali (glucocorticoidi, immunomodulatori), passando a o aggiungendo nuove terapie, a seconda della gravità del coinvolgimento degli organi.
Il farmaco antimalarico idrossiclorochina (HCQ) è ancora il trattamento di base per i pazienti affetti da lupus. L’HCQ è raccomandato per tutti i pazienti con LES (a meno che non sia controindicato) ad una dose non superiore a 5 mg/kg di peso corporeo. A meno che non vi siano fattori di rischio per la tossicità retinica , un esame oftalmologico (esame del campo visivo e/o tomografia a coerenza ottica) deve essere eseguito all’inizio della terapia, dopo 5 anni e successivamente ogni anno.
A seconda del tipo e della gravità del coinvolgimento degli organi, i glucocorticoidi (GC) possono essere utilizzati in dosi e vie di somministrazione diverse. La terapia a impulsi di metilprednisolone per via endovenosa (di solito 250-1000 mg al giorno per 1-3 giorni) fornisce un effetto terapeutico immediato e consente di ridurre le dosi iniziali di GC orale. Nella terapia di mantenimento a lungo termine, la GC deve essere ridotta a meno di 7,5 mg/die (equivalente al prednisone) e, se possibile, interrotta del tutto.
Tra le terapie immunosoppressive, il metotrexato è passato in prima linea perché ora ha le migliori evidenze. Nei pazienti che non rispondono all’HCQ (da solo o in combinazione con il GC) o che non sono in grado di ridurre il GC al di sotto di un dosaggio accettabile per una terapia a lungo termine, si deve prendere in considerazione l’aggiunta di agenti immunomodulatori/immunosoppressivi come il metotrexato (1b/B), l’azatioprina (2b/C) o il micofenolato (2a/B). Nella malattia che mette a rischio gli organi, gli agenti immunomodulanti/immunosoppressivi possono già essere inclusi nella terapia iniziale. La ciclofosfamide può essere utilizzata per il LES grave, che mette in pericolo gli organi o la vita.
Tra i biologici, l’unico disponibile finora è belimumab, che può essere preso in considerazione in aggiunta nei pazienti con una risposta insufficiente alla terapia standard (combinazioni di HCQ e GC con o senza immunosoppressori). Nei decorsi che minacciano gli organi, refrattari o in presenza di intolleranze/controindicazioni agli immunosoppressori standard, può essere preso in considerazione il rituximab (off label).
Nuove opzioni terapeutiche
Belimumab è l’unica terapia mirata per il LES ad oggi. Tuttavia, ci sono relativamente molte sostanze in fase di sviluppo clinico. La voclosporina (VCS), ad esempio, è un nuovo inibitore della calcineurina che può essere utilizzato per trattare la nefrite da lupus. Il VCS è un immunosoppressore “progettato” per l’uso nel trapianto di organi e nelle malattie autoimmuni. Si dice che l’analogo abbia livelli d’azione più stabili e non sia nefrotossico come il CSA nel suo uso a lungo termine. Negli studi, è stato testato nelle indicazioni di nefrite lupica, psoriasi e trapianto di rene. In uno studio di fase 2 su 265 pazienti con LN attiva (III-IV), sono stati somministrati 23,7 o 39,5 mg di VCS vs. placebo due volte al giorno, in aggiunta a MMF (2 g/d) e GC. Dopo un anno di VCS 23.7, il 29,4% dei soggetti ha raggiunto la remissione renale completa (VCS 39.5: 39,8%), rispetto al 23,9% del braccio placebo. Si tratta quindi di un effetto aggiuntivo del CNI nel trattamento della LN con MMF, ha commentato il Prof. Specker. “Quindi, se il VCS arriva sul mercato, potrebbe ottenere l’autorizzazione all’immissione in commercio e sarebbe una buona alternativa al tacrolimus, che è fuori etichetta”.
Una nuova sostanza è obinutuzumab (OBI). Come il rituximab, anche questo è un anticorpo anti-CD20. Anche la somministrazione è simile, con 1000 mg due volte a intervalli di 14 giorni e una ripetizione dopo 6 mesi. L’OBI è già utilizzato in modo relativamente diffuso in ematooncologia. Anche in questo caso, c’era un endpoint primario di remissione renale completa in uno studio. Di conseguenza, c’è stato un miglioramento significativo della sierologia rispetto al placebo, nessun aumento del tasso di AE gravi (14,3% vs. 21,0%) e nessuna infezione grave (1,6% vs. 12,9%). Le reazioni correlate all’infusione erano naturalmente più frequenti con l’OBI (15,9% contro 9,7%). Si sta pianificando una sperimentazione di fase 3 “e non posso davvero immaginare, visti i risultati ottenuti finora, che non funzioni”, ha dichiarato fiducioso il Prof. Specker.
L’interferone-α (IFNα) è stato a lungo considerato un bersaglio promettente per la terapia del LES. Anifrolumab (ANFR) è un anticorpo monoclonale che non è diretto direttamente contro l’IFNα, ma contro il suo recettore (IFNAR1), che antagonizza non solo gli effetti dell’IFNα, ma anche quelli di altri interferoni. Con TULIP-1 e TULIP-2, sono stati condotti due studi di fase 3 sull’effetto di ANFR nel LES – con risultati quasi contraddittori. I due studi non differivano praticamente l’uno dall’altro: i criteri di inclusione ed esclusione, il disegno dello studio e persino le dimensioni dei gruppi erano praticamente identici. Tuttavia, l’endpoint primario di una risposta SRI-4, inizialmente definito nello stesso modo di TULIP-1, è stato poi modificato in TULIP-2 prima dello sblocco del vincolo e dopo aver consultato l’FDA, nella cosiddetta risposta BICLA alla settimana 52 con SOC stabile.
Lo studio TULIP-1 è stato uno di una serie di studi sul LES che non hanno avuto successo ed è stato quindi deludente. Tuttavia, nel TULIP-2, l’anifrolumab è stato superiore al placebo in quasi tutti gli endpoint, tra cui l’attività della malattia, il coinvolgimento cutaneo e la necessità di GC. Non ci sono stati nuovi segnali di sicurezza in nessuno dei due studi. La tendenza a favorire le infezioni da herpes zoster era già nota per le terapie anti-IFNα ed è stata confermata anche per l’ANFR in entrambi gli studi. Il successo della sperimentazione TULIP-2 – con una “procedura di approvazione accelerata” già promessa dalla FDA – porterà molto probabilmente all’approvazione di questo nuovo principio terapeutico per il LES, ha previsto il Prof. Specker. Tuttavia, rimane poco chiaro come si siano potute verificare le sorprendenti differenze nei risultati di questi due studi quasi identici. Secondo l’esperto, una successiva modifica dell’endpoint primario non sarebbe stata affatto necessaria, l’indice di risposta SRI-4 è stato raggiunto anche in TULIP-2, e se si confrontano gli studi in termini di differenza tra la risposta al placebo e la risposta SRI-4, si arriva a differenze di oltre 22 punti percentuali. (Tab. 2). “Non mi chieda come spiegarlo, non lo so nemmeno io”, ha detto l’esperto esprimendo la sua perplessità.

Belimumab con vantaggi nella LN
Ci sono anche novità sull’uso di belimumab per il mantenimento della remissione nella nefrite lupica (LN). Finora si è sempre detto che Belimumab è inutile per la nefrite, “e per la terapia di induzione lo è”, ha spiegato il Prof. Specker. Ma nello studio di fase 3 BLISS-LN, 448 pazienti affetti da LES con nefrite lupica attiva sono stati inizialmente trattati in modo convenzionale con glucocorticoidi ad alte dosi + ciclofosfamide i.v. (CYC) o glucocorticoidi + micofenolato mofetile (MMF) e sono entrati in remissione. Dopo questa terapia di induzione di due mesi, i pazienti sono stati randomizzati 1 a 1: Coloro che in precedenza avevano ricevuto CYC sono stati trattati con azatioprina (AZA). Coloro che hanno ricevuto l’MMF in precedenza hanno continuato a riceverlo. Per un periodo di 24 mesi, i pazienti in terapia di mantenimento in entrambi i bracci sono stati divisi in un gruppo ciascuno che ha ricevuto belimumab aggiuntivo (10 mg/kg/mese) o placebo come infusione.
L’endpoint primario è stato definito come eGFR ≥60 ml/min/1.73m2 o nessuna diminuzione dell’eGFR rispetto al basale pre-LN superiore al 20%, un rapporto urina-proteina-creatinina (uPCR) ≤0,7 e nessun fallimento del trattamento o ricaduta. L’endpoint secondario più rigoroso, la remissione completa del rene (CRR), è stato definito come un eGFR nell’intervallo normale o non più del 10% al di sotto del basale e un uPCR <0.5.
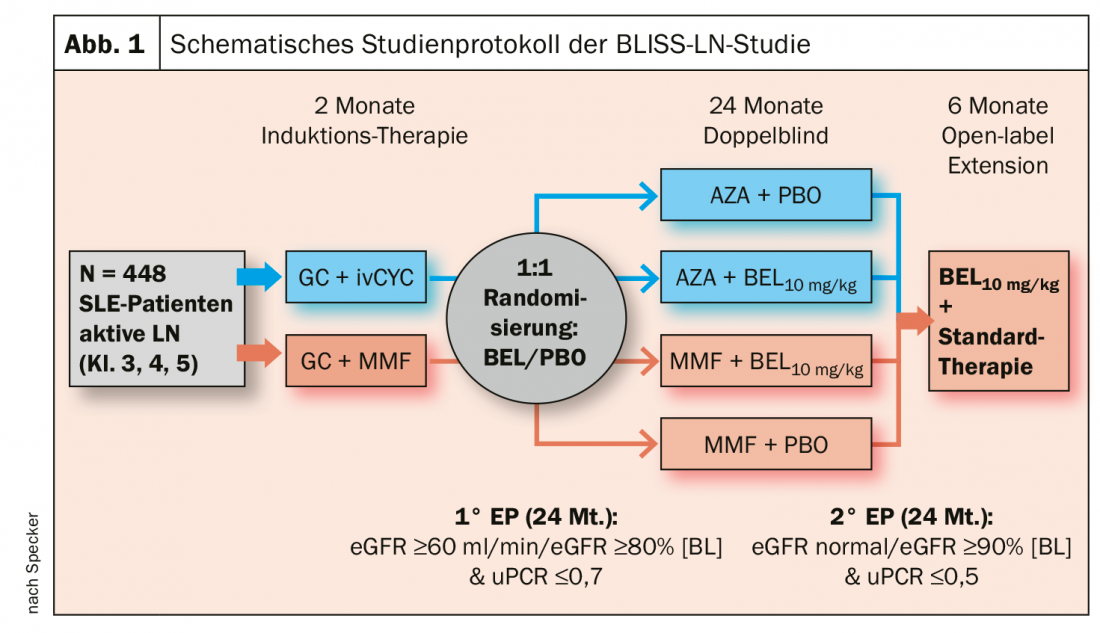
L’endpoint primario è stato raggiunto alla settimana 104 dal 43% di BEL + Standard of Care (SOC) e dal 32% di placebo. L’aumento dell’11% era statisticamente significativo (OR 1,44; 95% CI 1,04-2,32; p=0,03) (Fig. 1). Anche gli endpoint secondari più importanti hanno mostrato un vantaggio statisticamente significativo per belimumab rispetto al placebo, ha detto l’esperto. La sua conclusione: la somministrazione aggiuntiva di BEL nella terapia di mantenimento della nefrite lupica riduce il rischio di una ricaduta. Il Prof. Specker si aspetta quindi anche l’approvazione di belimumab come terapia aggiuntiva per questi casi di trattamento nel medio termine. Secondo lui, l’unica domanda che potrebbe rimanere aperta è se questo si applicherà anche alla terapia s.c., che ora è disponibile e più facile da gestire.
Fonte: Rheuma Update Wiesbaden (D)
Letteratura:
- Aringer M, et al: Ann Rheum Dis 2019; 78(9): 1151-1159.
- Fanouriakis A, et al: Ann Rheum Dis 2019; 78(6): 736-745.
InFo Dolore e Geriatria