I carcinomi bronchiali sono la causa più comune di decessi legati al cancro in tutto il mondo. Con lo sviluppo degli inibitori del checkpoint immunitario, il panorama terapeutico è cambiato in modo significativo.
La diagnosi e la terapia del carcinoma bronchiale è un campo in rapida evoluzione e di notevole interesse clinico a causa dell’elevata incidenza e mortalità di questi tumori in tutto il mondo. Il rapido aumento delle conoscenze nella biologia molecolare e nell’immunologia e i progressi nella diagnostica molecolare sono fattori trainanti nello sviluppo del trattamento personalizzato dei tumori (“medicina di precisione”). Questo sviluppo è lungi dall’essere completo.
In questo articolo, ci concentriamo sulle innovazioni attuali nel trattamento del carcinoma bronchiale, ponendo l’accento sulla terapia sistemica degli stadi avanzati del tumore nella prima linea di terapia. Si tratta di approcci terapeutici che stiamo attualmente perseguendo presso il nostro istituto. Non abbiamo alcuna pretesa di completezza o validità assoluta.
Nozioni di base
Nel 2018, i carcinomi bronchiali hanno registrato l’incidenza più alta (11,6%) e la mortalità più elevata (18,4%) di tutte le patologie tumorali a livello mondiale – al pari dei tumori al seno [1]. Nel periodo dal 2011 al 2015, i carcinomi bronchiali erano al terzo posto in Svizzera in termini di incidenza (circa 4300 nuovi casi all’anno) e al primo posto tra le cause di morte legate al cancro [2]. Il tasso di sopravvivenza relativa a 5 anni per il cancro al polmone in Svizzera è stato del 15% per gli uomini e del 19% per le donne [3]. Il fumo di tabacco continua ad essere la causa principale del cancro ai polmoni [4]. Circa il 20% dei carcinomi bronchiali si verifica nei “non fumatori” (<100 sigarette in totale). Il motivo principale è l’esposizione a sostanze nocive inalate (ad esempio, radon, amianto, vapori di catrame) [5].
Carcinoma polmonare a piccole cellule
Il 10-15% dei carcinomi bronchiali di nuova diagnosi sono tumori polmonari a piccole cellule (SCLC). Terapeuticamente rilevante è la distinzione tra malattia limitata LD (stadio I-III) e malattia estesa ED (stadio IV). Quest’ultima è molto più comune a causa della biologia aggressiva del tumore. La sopravvivenza globale (OS) mediana è di 15-20 mesi per LD-SCLC e di 8-13 mesi per ED-SCLC [6]. La maggior parte degli SCLC presenta mutazioni inattivanti dei geni soppressori tumorali TP53 e RB1, mentre le mutazioni “trattabili” delle tirosin-chinasi recettoriali sono solitamente assenti (a differenza dei carcinomi polmonari non a piccole cellule, NSCLC). Gli attuali standard terapeutici dipendenti dallo stadio possono essere riassunti come segue:
Stadio I: oltre alla chirurgia, la chemioterapia adiuvante a base di platino offre un beneficio in termini di OS nello stadio I (66,0 vs. 42,1 mesi) [7].
Stadio II, III: la chirurgia più la chemioterapia è un’opzione nello stadio II; in alternativa, l’intervento chirurgico può essere omesso e viene somministrata la radio-chemioterapia definitiva. Questo è anche il trattamento di scelta nello stadio III e dovrebbe, se possibile, essere eseguito contemporaneamente [8,9].
Stadio IV: la terapia sistemica palliativa è il trattamento di scelta per l’ED-SCLC. Nonostante una risposta inizialmente molto buona alla terapia, la sopravvivenza globale mediana è di soli 10 mesi. I protocolli standard sono cisplatino ed etoposide o carboplatino ed etoposide [10]. I protocolli differiscono principalmente in termini di effetti collaterali, meno in termini di effetto tumorale [11]. L’irradiazione del tumore toracico residuo non è uno standard, ma un’opzione individuale in caso di ottima risposta alla chemioterapia e di remissione completa delle metastasi extratoraciche [12].
Atezolizumab, un inibitore del ligando della morte programmata 1 (PD-L1) (inibitore del checkpoint immunitario, ICI), combinato con la chemioterapia e successivamente utilizzato come terapia di mantenimento, offre un beneficio di sopravvivenza in prima linea di terapia rispetto alla sola chemioterapia (12,3 vs. 10,3 mesi, HR 0,7, 95% CI 0,54-0,91), come dimostrato nello studio di fase III IMpower133. [13]. Anche lo studio di fase III CASPIAN con durvalumab e chemioterapia è stato positivo, come ha riferito recentemente il produttore [14]. Pertanto, l’ED-SCLC dispone ora di due nuovi approcci per la chemio-immunoterapia combinata, a condizione che i preparati siano ancora approvati dalle autorità competenti per questa indicazione.
L’irradiazione profilattica del cervello intero (PCI) è considerata “standard” in molte linee guida nello stadio II-IV dopo una buona risposta alla chemioterapia [15,16]. Uno studio giapponese, tuttavia, mette in discussione questo standard, in quanto non ha mostrato alcun beneficio in termini di sopravvivenza per la PCI rispetto alla sola risonanza magnetica (RM) del cranio [17]. Questi dati sembrano già portare a un parziale allontanamento dallo standard precedente nella pratica clinica quotidiana [18]. L’influenza dell’immunoterapia sull’indicazione per la PCI non è ancora chiara.
Molti pazienti con SCLC presentano una recidiva o una progressione entro 6-12 mesi. La ragione di ciò è probabilmente la presenza di “cellule staminali tumorali” resistenti al cisplatino [19]. L’ulteriore trattamento dipende dalle condizioni del paziente, dall’entità della recidiva del tumore, dalla terapia precedente e dall’intervallo libero da trattamento [15–17]. Se c’è una situazione refrattaria o una ricaduta resistente al platino, topotecan è superiore alla sola terapia di supporto [20] ed equivalente alla terapia multipla (ciclofosfamide, doxorubicina e vincristina) in termini di tasso di risposta globale (ORR), sopravvivenza libera da progressione (PFS) e OS, ma meglio tollerato [21]. Il topotecan somministrato per via endovenosa e quello somministrato per via perorale sono approssimativamente equivalenti in termini di efficacia e tollerabilità [22]. I pazienti in buone condizioni generali (ECOG 0-2) con una “recidiva sensibile al platino” possono essere trattati nuovamente con cisplatino/carboplatino ed etoposide [23].
A nostro avviso, l’uso degli inibitori del checkpoint immunitario dopo il fallimento della chemioterapia non è (ancora) uno standard. I dati migliori finora sono quelli di pembrolizumab (per i tumori PDL1-positivi) [24] e di nivolumab [25].
Carcinoma polmonare non a piccole cellule
Il carcinoma polmonare non a piccole cellule (NSCLC, circa l’85-90% di tutti i carcinomi bronchiali) è un termine clinico collettivo per gli adenocarcinomi (50-60%), i carcinomi a cellule squamose (20-25%), i carcinomi a grandi cellule, i carcinomi adenosquamosi, i carcinomi neuroendocrini (di cui il carcinoma polmonare a piccole cellule è escluso) e i carcinomi sarcomatoidi.
Stadio I/II: la terapia di scelta negli stadi I e II è la chirurgia radicale secondo gli standard oncologici (di solito una lobectomia con dissezione sistematica dei linfonodi mediastinici). A partire da un diametro del tumore di 4 cm, è indicata la chemioterapia adiuvante con 4 cicli di una combinazione contenente platino. Se c’è una controindicazione alla chirurgia, l’alternativa è la radiazione stereotassica.
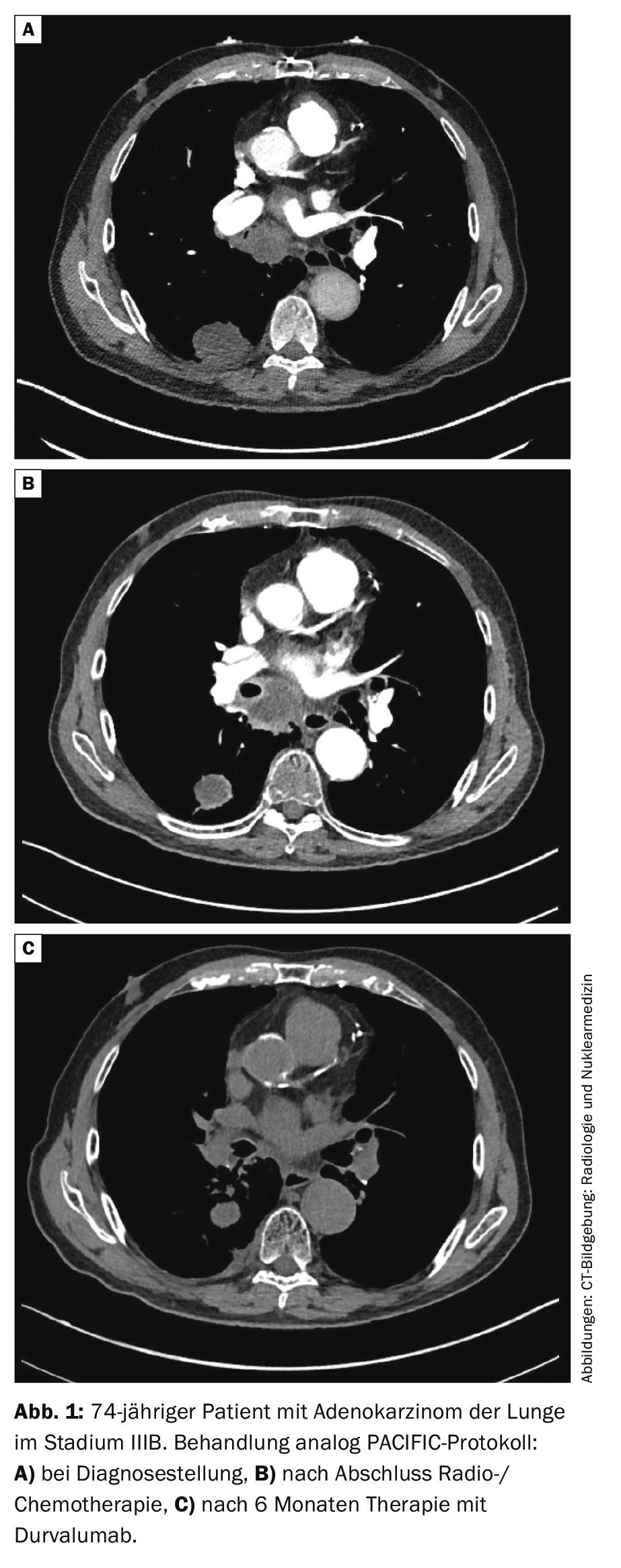
Stadio III: per i tumori resecabili nello stadio III, la chemioterapia è indicata in aggiunta alla chirurgia. Questo può essere fatto prima (neoadiuvante) o dopo (adiuvante) l’intervento chirurgico. Il beneficio della radioterapia aggiuntiva (“terapia trimodale”) è controverso. Lo studio svizzero di fase III SAKK16/00 è stato negativo per quanto riguarda l’irradiazione preoperatoria [26]. La radioterapia postoperatoria (PORT) non ha mostrato alcun chiaro beneficio in una meta-analisi retrospettiva [27], i dati dello studio randomizzato LungART sono ancora in attesa. Il NSCLC in stadio III non resecabile viene sottoposto a radio-chemioterapia seguita da un anno di immunoterapia “consolidativa” con l’anticorpo PD-L1 durvalumab. La base è lo studio prospettico randomizzato di fase III PACIFIC [28, 29]. Nello studio, la sopravvivenza a 2 anni è stata del 66,3% con durvalumab e del 55,6% con placebo (HR 0,68, 99,73% CI 0,47-0,997, p=0,0025). La PFS mediana è stata significativamente prolungata con durvalumab rispetto al placebo (17,2 contro 5,6 mesi, HR 0,51, 95% CI 0,41-0,63, p<0,001). Il consolidamento con durvalumab è quindi considerato oggi lo standard (Fig. 1).
Stadio IV: a parte i cosiddetti stadi “oligometastatici”, in cui la chirurgia e la radioterapia possono essere utilizzate con intento curativo, la maggior parte del NSCLC in stadio IV viene trattata esclusivamente con intento palliativo. Viene fatta una distinzione tra chemioterapia, terapia mirata e immunoterapia. La scelta della terapia dipende dal sottotipo istologico, dalla presenza di mutazioni driver (nei tumori non squamosi) e dall’espressione di PD-L1 del tumore. Il work-up patologico molecolare è la base per una terapia ottimale (Fig. 2).
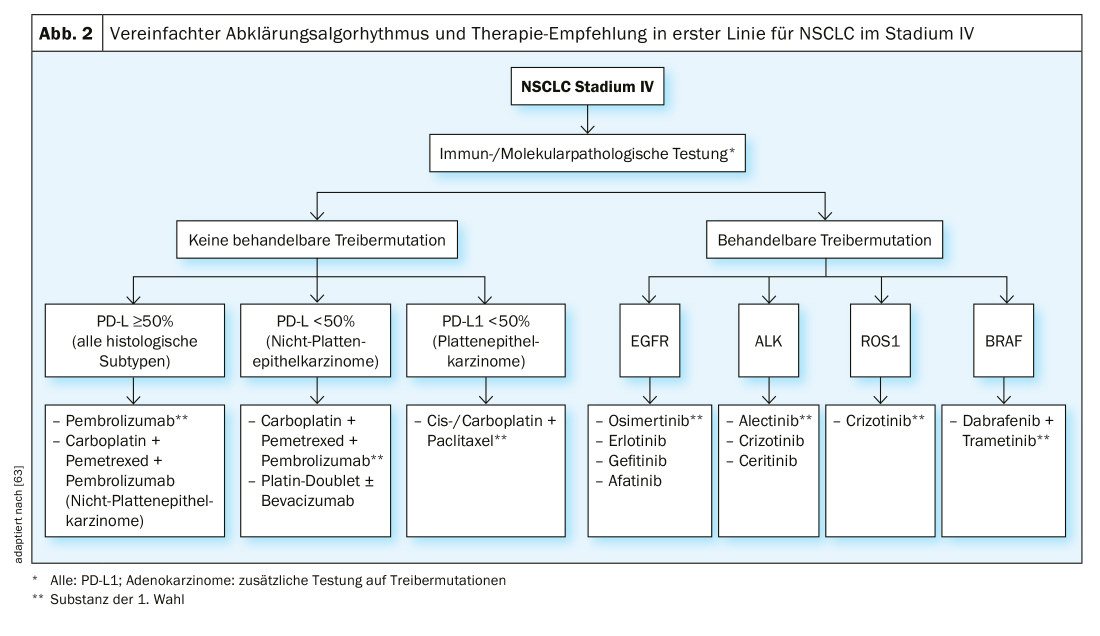
Se non ci sono “mutazioni driver” trattabili, il trattamento si basa principalmente sullo stato di espressione di PD-L1. Per il NSCLC (indipendentemente dal sottotipo istologico) con un’espressione di PD-L1 ≥50%, il trattamento con l’inibitore di PD-L1 pembrolizumab è superiore alla chemioterapia convenzionale in termini di OS e PFS secondo lo studio KEYNOTE 024 [30]. Per gli adenocarcinomi del polmone con un’espressione di PD-L1 ≤ 50%, una combinazione di chemioterapia e pembrolizumab è preferibile alla sola chemioterapia, analogamente allo studio KEYNOTE 189 [31]. Il tasso di risposta al trattamento nello studio con l’aggiunta di pembrolizumab è stato del 48%, senza pembrolizumab del 19%. Il tasso di sopravvivenza a 12 mesi è stato del 69% per pembrolizumab + chemioterapia e del 49% per il gruppo con sola chemioterapia. Un’alternativa è l’anticorpo PD-L1 atezolizumab in combinazione con carboplatino, paclitaxel e bevacizumab, in base ai risultati degli studi IMpower130 e -150 [32,33].
Per i carcinomi a cellule squamose con un’espressione di PD-L1 ≤50%, la combinazione di pembrolizumab con la chemioterapia è associata a un beneficio in termini di OS e PFS secondo lo studio KEYNOTE 407 [34].
Se non è stato utilizzato alcun inibitore del checkpoint immunitario nella prima linea di terapia, il loro impiego è indicato nella seconda linea. L’uso di nivolumab è associato a un beneficio statisticamente significativo in termini di ORR, OS e PFS rispetto al docetaxel, indipendentemente dall’espressione di PD-L1 sulle cellule tumorali [35].
Il trattamento di seconda linea con atezolizumab è stato confrontato con il docetaxel e si è riscontrato un vantaggio in termini di OS a favore di atezolizumab, indipendentemente dall’istologia del NSCLC [36,37]. Il pembrolizumab è stato studiato per i tumori con espressione di PD-L1 di almeno l’1%, dimostrando un significativo beneficio in termini di OS rispetto al docetaxel [38]. Il trattamento con gli inibitori del checkpoint immunitario deve essere somministrato fino a quando viene dimostrata una risposta o fino a quando il paziente tollera il trattamento senza effetti collaterali gravi.
Mutazioni del conducente: In un numero significativo di NSCLC, si trova una mutazione di un protooncogene in un oncogene, che codifica per una tirosin-chinasi recettoriale attivante (RTK). Questa mutazione causa un aumento della proliferazione cellulare, della resistenza all’apoptosi, dell’angiogenesi e delle metastasi. Tali mutazioni sono chiamate mutazioni driver. Di solito si tratta di mutazioni somatiche e non di mutazioni germinali [39]. Queste scoperte hanno portato allo sviluppo di inibitori orali della tirosin-chinasi (TKI), il cui effetto si basa su un’inibizione più o meno selettiva della corrispondente via di trasduzione del segnale. Tenendo conto della probabilità pre-test, il test per la presenza di mutazioni è attualmente obbligatorio per il NSCLC non squamoso di stadio IV, ma non per il carcinoma a cellule squamose e il SCLC. A causa dei vincoli di tempo, nel nostro istituto eseguiamo il test in due fasi. La prima fase comprende i test rapidi per EGFR, ALK, ROS1, KRAS e BRAF. Se è negativo, in una seconda fase testiamo HER2, MET, RET, NTRK1-3 e altri marcatori. Di seguito, discutiamo il trattamento mirato del NSCLC in stadio IV con mutazioni driver classiche.
EGFR: le mutazioni attivanti del protooncogene “recettore del fattore di crescita epidermico” (EGFR) si riscontrano nel 13-15% degli adenocarcinomi polmonari nell’Europa centrale, in un gruppo di non fumatori (prevalenza superiore al 50% a seconda dello studio) [40]. Circa il 90% dei casi presenta una delezione dell’esone 19 o una mutazione puntiforme dell’esone 21 L858R [41]. La terapia standard in prima linea è un EGFR TKI. Questa terapia è associata a un beneficio statisticamente significativo in termini di PFS rispetto alla chemioterapia a base di platino [42]. I TKI disponibili sono gefitinib ed erlotinib (prima generazione), afatinib e dacomtinib (seconda generazione) e osimertinib (terza generazione). Con i TKI EGFR di prima generazione, la resistenza al trattamento si manifesta in media dopo 10-14 mesi, nel 50-60% dei casi a causa di una seconda mutazione EGFR (T790M) [43]. Osimertinib, un TKI con una buona disponibilità ed efficacia sul SNC in presenza di una mutazione EGFR T790M, è stato valutato rispetto a gefitinib ed erlotinib nello studio FLAURA. I dati pubblicati nel 2017 hanno dimostrato un beneficio statisticamente significativo in termini di PFS a favore di osimertinib (18,9 mesi con osimertinib rispetto a 10,2 mesi con gefitinib ed erlotinib, rispettivamente, (HR 0,46; 95% CI 0,37-0,57; p<0,001) [44]. Osimertinib ha dimostrato di essere più efficace contro le metastasi cerebrali e meglio tollerato. Gli ultimi dati dello studio FLAURA, che saranno presentati al Congresso annuale ESMO 2019 a settembre, mostrano per la prima volta un beneficio di sopravvivenza statisticamente significativo di osimertinib dopo [45]. Osimertinib si affermerà quindi definitivamente come terapia di prima linea per tutti i pazienti con NSCLC mutato in EGFR, indipendentemente da T790M o metastasi cerebrali. La combinazione di un EGFR TKI con la chemioterapia, principalmente nel NSCLC mutato in EGFR, non è attualmente considerata standard, ma è stata esaminata in diversi studi. Lo studio giapponese di fase III NEJ009 ha confrontato gefitinib con gefitinib + chemioterapia (carboplatino e pemetrexed), mostrando un beneficio statisticamente significativo in termini di PFS (21 vs. 11 mesi; HR 0,49, 95% CI 0,39-0,63) e di OS (52 vs. 39 mesi; HR 0,70, 95% CI 0,52-0,93), ma accompagnato da un tasso più elevato di malattie di grado 3 Tossicità (65% vs. 31%) [46]. Ulteriori studi (con erlotinib e gefitinib) confermano questi risultati. La combinazione di EGFR TKI erlotinib con l’anticorpo VEGFR bevacizumab ha prodotto un beneficio in termini di PFS ma non di OS rispetto alla monoterapia con erlotinib [47].
ALK: le traslocazioni del proto-oncogene anaplastic lymphoma kinase (ALK) si trovano nel 3-5% degli adenocarcinomi polmonari [48], anche in questo caso in un gruppo di non fumatori [49]. Gli ALK-TKI disponibili sono crizotinib, ceritinib, alectinib, brigatinib e lorlatininb. L’agente di prima linea di scelta è alectinib, grazie alla sua buona mobilità sul SNC e alla superiorità rispetto a crizotinib nello studio ALEX [50,51]. La scelta degli ALK-TKI in ulteriori linee dipende in particolare dalla disponibilità, dall’infestazione cerebrale e dalle mutazioni di resistenza [52].
ROS1: le traslocazioni del proto-oncogene 1 ROS (ROS1) si trovano nell’1-2% degli adenocarcinomi polmonari, anche nei non fumatori. A causa della somiglianza strutturale delle chinasi ALK e ROS1, molti inibitori ALK diversi da alectinib sono adatti anche per inibire ROS1. Il trattamento dei tumori polmonari mutati in ROS1 con crizotinib è la terapia di scelta [53]. Lorlatinib ha mostrato un’ottima efficacia in uno studio di fase II, soprattutto nei casi di resistenza a crizotinib [54]. Ceritinib, entrectinib e repotrectinib sono altri potenti inibitori di ROS1.
BRAF: la mutazione puntiforme BRAF si trova nell’1-2% degli adenocarcinomi polmonari, sia nei fumatori che nei non fumatori. In circa due terzi dei casi, è presente una mutazione V600E tipica e trattabile. In questo caso, un trattamento combinato con dabrafenib e trametinib è la terapia di scelta, sia nei pazienti naïve alla terapia che in quelli pretrattati [55,56]. Tuttavia, il NSCLC con BRAF V600E risponde anche alla chemioterapia e all’immunoterapia. Per le mutazioni BRAF diverse da V600E, la terapia mirata al di fuori degli studi non è attualmente raccomandata.
KRAS: se è presente una mutazione attivante del proto-oncogene Kirsten ras (KRAS), questi NSCLC in precedenza non erano considerati specificamente trattabili e venivano sottoposti a chemio-immunoterapia. Il KRAS è stato testato comunque, perché un risultato positivo rendeva superflua la ricerca di ulteriori mutazioni driver. Nel 2019 sono stati riportati i primi risultati di uno studio clinico con l’inibitore specifico del KRAS G12C AMG510 [57]. Questi risultati sono molto incoraggianti e gli studi di follow-up sono in fase di apertura in molti centri per il reclutamento di un gran numero di pazienti. Sono in fase di sviluppo anche altri inibitori di KRAS.
RET: le traslocazioni riarrangiate durante la trasfezione (RET) si trovano in circa l’1-2% degli adenocarcinomi polmonari. I TKI meno selettivi, come cabozantinib, hanno mostrato qualche effetto, anche se molto limitato nel tempo [58]. Gli inibitori RET altamente selettivi come LOXO-292 e BLU-667 rappresentano quindi un importante progresso nel trattamento dei tumori polmonari RET-mutati. LOXO-292 è in fase di studio nello studio LIBRETTO-001 (NCT03157128). I risultati iniziali hanno mostrato un tasso di risposta del 65%, con una tollerabilità molto buona [59]. I nuovi dati saranno presentati al congresso annuale IASLC nel settembre 2019. I centri partecipanti includono Lucerna (CH) e Colonia (DE). L’inibitore RET BLU-667 è in fase di studio nello studio ARROW (NCT03037385). Il tasso di risposta pre-primario è stato del 56% [60]. I centri partecipanti includono Heidelberg (DE).
NTRK: le fusioni di uno dei proto-oncogeni “recettore neurotrofico della tirosina chinasi 1-3” (NTRK 1-3) si trovano nell’1% dei NSCLC. L’inibitore di TRK larotrectinib (LOXO-101) ha finora mostrato un ORR del 75% negli studi di fase I-II con una risposta sostenuta e un’ottima tollerabilità [61]. Finora è stato approvato negli Stati Uniti, mentre l’approvazione per l’Europa e la Svizzera è ancora in sospeso. Entrectinib (RXDX-101), un altro inibitore di TRK, ha mostrato un ORR del 57% nei tumori solidi con fusione NTRK accertata nell’analisi combinata di tre studi di fase I-II, con una tollerabilità molto buona [62].
Conclusione
Gli attuali sviluppi dell’immunoterapia e della terapia mirata mostrano che il potenziale di questi approcci nel carcinoma bronchiale è tutt’altro che esaurito. Il beneficio di queste terapie nella palliazione è indiscusso e sono in corso studi clinici anche nella situazione adiuvante. Indipendentemente da questo, è necessario compiere maggiori sforzi anche nelle aree della prevenzione e della diagnosi precoce, in modo da ottenere una diminuzione dei carcinomi bronchiali (soprattutto degli stadi metastatizzati).
Messaggi da portare a casa
- I carcinomi bronchiali sono la causa più comune di decessi legati al cancro in tutto il mondo e il fumo di tabacco è la causa principale.
- Il nuovo standard di cura per il carcinoma polmonare a piccole cellule (SCLC) in stadio IV è la combinazione di chemioterapia (carboplatino e
- etoposide) con l’inibitore del checkpoint immunitario atezolizumab.
- I pazienti con carcinoma polmonare non a piccole cellule (NSCLC) in stadio III traggono beneficio dal consolidamento dell’immunoterapia con durvalumab dopo la radio/chemioterapia definitiva.
- L’analisi del NSCLC non squamoso in fase avanzata per la presenza di mutazioni driver (in anticipo EGFR, ALK, ROS1 e BRAF) e il livello di espressione di PD-L1 stanno guidando la scelta della terapia.
- Il trattamento del NSCLC con mutazioni trattabili è principalmente mirato; il trattamento del NSCLC senza evidenza di una mutazione driver trattabile si basa principalmente sullo stato di espressione di PD-L1.
Letteratura:
- Bray F, et al: Statistiche globali sul cancro 2018: stime GLOBOCAN di incidenza e mortalità a livello mondiale per 36 tumori in 185 Paesi. CA Cancer J Clin, 2018. 68(6): p. 394-424.
- www.bfs.admin.ch/bfs/de/home/statistiken/kataloge-datenbanken/tabellen.assetdetail.6466432.html.
- Arndt V: Rapporto sul cancro in Svizzera 2015: stato e sviluppi. 2016: Office féderal de la statistique (OFS).
- Forman D, et al: L’onere globale e regionale del cancro. Rapporto mondiale sul cancro, 2014. 2014: 16-53.
- Sun S, Schiller JH, Gazdar AF: Il cancro al polmone nei non fumatori – una malattia diversa. Nat Rev Cancer, 2007. 7(10): 778-790.
- van Meerbeeck JP, Fennell DA, De Ruysscher DK: Carcinoma polmonare a piccole cellule. Lancet, 2011. 378(9804): 1741-1755.
- Yang CF, et al: Ruolo della terapia adiuvante in una coorte basata sulla popolazione di pazienti con cancro al polmone a piccole cellule in fase iniziale. J Clin Oncol, 2016. 34(10): 1057-1064.
- Warde P, Payne D: L’irradiazione toracica migliora la sopravvivenza e il controllo locale nel carcinoma a piccole cellule del polmone in stadio limitato? Una meta-analisi. J Clin Oncol, 1992. 10(6): 890-895.
- Pignon JP, et al: Una meta-analisi della radioterapia toracica per il cancro al polmone a piccole cellule. New England Journal of Medicine, 1992. 327(23): 1618-1624.
- Mascaux C., et al.: Una revisione sistematica del ruolo di etoposide e cisplatino nella chemioterapia del carcinoma polmonare a piccole cellule con valutazione metodologica e meta-analisi. Cancro al polmone, 2000, 30(1): 23-36.
- Rossi A, et al: Chemioterapia a base di carboplatino o cisplatino nel trattamento di prima linea del carcinoma polmonare a piccole cellule: la meta-analisi COCIS dei dati dei singoli pazienti. J Clin Oncol, 2012. 30(14): 1692-1698.
- Slotman BJ, et al: Uso della radioterapia toracica per il carcinoma polmonare a piccole cellule in stadio esteso: uno studio randomizzato controllato di fase 3. Lancet, 2015. 385(9962): 36-42.
- Horn L, et al: Atezolizumab più chemioterapia in prima linea nel carcinoma polmonare a piccole cellule in stadio esteso. N Engl J Med, 2018. 379(23): 2220-2229.
- www.astrazeneca.com/media-centre/press-releases/2019/imfinzi-improves-overall-survival-at-interim-analysis-in-the-phase-iii-caspian-trial-in-1st-line-extensive-stage-small-cell-lung-cancer-27062019.html.
- Auperin A, et al: Irradiazione cranica profilattica per i pazienti con carcinoma polmonare a piccole cellule in remissione completa. Gruppo di collaborazione per la panoramica sull’irradiazione cranica profilattica. N Engl J Med, 1999. 341(7): 476-484.
- Slotman B, et al: Irradiazione cranica profilattica nel carcinoma polmonare esteso a piccole cellule. N Engl J Med, 2007. 357(7): 664-672.
- Takahashi T, et al: Irradiazione cranica profilattica rispetto all’osservazione nei pazienti con carcinoma polmonare a piccole cellule con malattia estesa: uno studio multicentrico, randomizzato, open-label, di fase 3. Lancet Oncol, 2017. 18(5): 663-671.
- Gjyshi O, et al: Modelli di pratica in evoluzione nell’uso dell’irradiazione cranica profilattica per il carcinoma polmonare a piccole cellule in stadio estensivo Irradiazione cranica profilattica per il carcinoma polmonare a piccole cellule in stadio estensivo. JAMA Network Open, 2019. 2(8): e199135-e199135.
- Böttger F, et al.: L’eterogeneità tumorale è alla base della sensibilità differenziale al cisplatino nei modelli murini di cancro al polmone a piccole cellule. Rapporti sulle cellule, 2019. 27(11): 3345-3358. e4.
- O’Brien ME, et al: Studio di fase III che confronta la sola terapia di supporto con la terapia di supporto con topotecan orale nei pazienti con carcinoma polmonare a piccole cellule recidivato. J Clin Oncol, 2006. 24(34): 5441-5447.
- von Pawel J, et al: Topotecan rispetto a ciclofosfamide, doxorubicina e vincristina per il trattamento del carcinoma polmonare a piccole cellule ricorrente. J Clin Oncol, 1999. 17(2): 658-667.
- Eckardt JR, et al: Studio di fase III, multicentrico, randomizzato, in aperto, che confronta topotecan/cisplatino per via orale rispetto a etoposide/cisplatino come trattamento per i pazienti naïve alla chemioterapia con carcinoma polmonare a piccole cellule con malattia estesa. J Clin Oncol, 2006. 24(13): 2044-2051.
- Garassino MC, et al: Esiti dei pazienti con carcinoma polmonare a piccole cellule trattati con chemioterapia di seconda linea: un’analisi retrospettiva multi-istituzionale. Cancro al polmone, 2011. 72(3): 378-83.
- Chung HC, et al: Abstract CT073: Pembrolizumab dopo due o più linee di terapia precedente nei pazienti con carcinoma polmonare a piccole cellule (SCLC) avanzato: Risultati degli studi KEYNOTE-028 e KEYNOTE-158. Ricerca sul cancro, 2019. 79(13 Supplemento): CT073-CT073.
- Ready N, et al: Monoterapia nivolumab di terza linea nel SCLC ricorrente: CheckMate 032. J Thorac Oncol, 2019. 14(2): 237-244.
- Pless M., et al: Chemioradiografia di induzione nel carcinoma polmonare non a piccole cellule in stadio IIIA/N2: studio randomizzato di fase 3. The Lancet, 2015. 386(9998): 1049-1056.
- Burdett S, et al: Radioterapia postoperatoria per il carcinoma polmonare non a piccole cellule. Database Cochrane di revisioni sistematiche, 2016(10).
- Antonia SJ, et al: Durvalumab dopo la chemioradioterapia nel carcinoma polmonare non a piccole cellule in stadio III. N Engl J Med, 2017. 377(20): 1919-1929.
- Antonia SJ, et al: Sopravvivenza complessiva con Durvalumab dopo la chemioradioterapia nel NSCLC in stadio III. N Engl J Med, 2018. 379(24): 2342-2350.
- Reck M, et al: Pembrolizumab rispetto alla chemioterapia per il carcinoma polmonare non a piccole cellule PD-L1-positivo. N Engl J Med, 2016. 375(19): 1823-1833.
- Gandhi L, et al: Pembrolizumab più chemioterapia nel carcinoma polmonare non a piccole cellule metastatico. N Engl J Med, 2018. 378(22): 2078-2092.
- Socinski, M.A., et al: Atezolizumab per il trattamento di prima linea del NSCLC non squamoso metastatico. N Engl J Med, 2018. 378(24): 2288-2301.
- West H., et al: Atezolizumab in combinazione con la chemioterapia a base di carboplatino più nab-paclitaxel rispetto alla sola chemioterapia come trattamento di prima linea per il carcinoma polmonare non a piccole cellule metastatico non squamoso (IMpower130): uno studio multicentrico, randomizzato, in aperto, di fase 3. Lancet Oncol, 2019. 20(7): 924-937.
- Paz-Ares L, et al: Pembrolizumab più chemioterapia per il carcinoma polmonare squamoso non a piccole cellule. N Engl J Med, 2018. 379(21): 2040-2051.
- Vokes EE, et al: Nivolumab rispetto a docetaxel nel carcinoma polmonare non a piccole cellule avanzato precedentemente trattato (CheckMate 017 e CheckMate 057): aggiornamento a 3 anni ed esiti nei pazienti con metastasi epatiche. Ann Oncol, 2018. 29(4): 959-965.
- Rittmeyer A, et al: Atezolizumab rispetto a docetaxel in pazienti con carcinoma polmonare non a piccole cellule precedentemente trattato (OAK): uno studio randomizzato controllato di fase 3, in aperto, multicentrico. Lancet, 2017. 389(10066): 255-265.
- Fehrenbacher L, et al: Analisi di efficacia aggiornata che include i risultati della popolazione secondaria per OAK: uno studio randomizzato di fase III di Atezolizumab rispetto a Docetaxel nei pazienti con carcinoma polmonare non a piccole cellule avanzato precedentemente trattato. J Thorac Oncol, 2018. 13(8): 1156-1170.
- Herbst RS, et al: Pembrolizumab rispetto a docetaxel per il carcinoma polmonare non a piccole cellule avanzato, precedentemente trattato, PD-L1-positivo (KEYNOTE-010): uno studio randomizzato controllato. Lancet, 2016. 387(10027): 1540-1550.
- Alexandrov LB, et al.: Caratteristiche dei processi mutazionali nel cancro umano. Natura, 2013. 500(7463): 415.
- Shi Y, et al: Uno studio prospettico di epidemiologia molecolare delle mutazioni EGFR nei pazienti asiatici con carcinoma polmonare non a piccole cellule in stadio avanzato con istologia di adenocarcinoma (PIONEER). J Thorac Oncol, 2014. 9(2): 154-162.
- Mitsudomi T, Yatabe Y: Il recettore del fattore di crescita epidermico in relazione allo sviluppo del tumore: gene EGFR e cancro. La rivista FEBS, 2010. 277(2): 301-308.
- Lee CK, et al: Impatto dell’inibitore di EGFR nel carcinoma polmonare non a piccole cellule sulla sopravvivenza libera da progressione e sulla sopravvivenza globale: una meta-analisi. J Natl Cancer Inst, 2013. 105(9): 595-605.
- Wu SG, Shih J-Y, Gestione della resistenza acquisita alla terapia mirata con EGFR TKI nel carcinoma polmonare non a piccole cellule in fase avanzata. Cancro molecolare, 2018. 17(1): 38.
- Soria JC, et al: Osimertinib nel carcinoma polmonare non a piccole cellule avanzato EGFR-mutato non trattato. New England journal of medicine, 2018. 378(2): 113-125.
- Tagrisso migliora significativamente la sopravvivenza globale nello studio di fase III FLAURA per il carcinoma polmonare non a piccole cellule mutato in EGFR di prima linea [press release]. Wilmington, DE: AstraZeneca; 9 agosto 2019. https://bit.ly/2ZGF7gZ.
- Nakamura A, et al: Studio di Fase III che confronta la monoterapia con gefitinib (G) con la terapia di combinazione con gefitinib, carboplatino e pemetrexed (GCP) per i pazienti non trattati (pts) con carcinoma polmonare non a piccole cellule (NSCLC) avanzato con mutazioni EGFR (NEJ009). Journal of Clinical Oncology, 2018. 36(15_suppl): 9005-9005.
- Saito H, et al: Erlotinib più bevacizumab rispetto a erlotinib da solo nei pazienti con carcinoma polmonare non a piccole cellule avanzato non squamoso positivo all’EGFR (NEJ026): analisi ad interim di uno studio di fase 3 in aperto, randomizzato, multicentrico. Lancet Oncol, 2019. 20(5): 625-635.
- Soda M, et al: Identificazione del gene di fusione trasformante EML4-ALK nel carcinoma polmonare non a piccole cellule. Natura, 2007. 448(7153): 561.
- Shaw AT, et al: Caratteristiche cliniche ed esito dei pazienti con carcinoma polmonare non a piccole cellule che ospitano EML4-ALK. Giornale di oncologia clinica, 2009. 27(26): 4247.
- Peters S, et al: Alectinib rispetto a crizotinib nel carcinoma polmonare non a piccole cellule ALK-Positivo non trattato. N Engl J Med, 2017. 377(9): 829-838.
- Hida T, et al: Alectinib rispetto a crizotinib nei pazienti con carcinoma polmonare non a piccole cellule ALK-positivo (J-ALEX): studio randomizzato di fase 3 in aperto. Lancet, 2017. 390(10089): 29-39.
- Ryser CO, Diebold J, Gautschi O: Trattamento del carcinoma polmonare non a piccole cellule positivo al linfoma anaplastico chinasi: aggiornamento e prospettive. Curr Opin Oncol, 2019. 31(1): 8-12.
- Shaw AT, et al: Crizotinib nel carcinoma polmonare non a piccole cellule ROS1-arrangiato. New England Journal of Medicine, 2014. 371(21): 1963-1971.
- Ou S, et al: OA02. 03 Attività clinica di Lorlatinib nei pazienti con tumore al polmone non a piccole cellule avanzato ROS1+: coorte di studio di fase 2 EXP-6. Journal of Thoracic Oncology, 2018. 13(10): S322-S323.
- Planchard D, et al: Dabrafenib più trametinib in pazienti con carcinoma polmonare non a piccole cellule metastatico BRAF(V600E)-mutante precedentemente trattato: uno studio multicentrico di fase 2 in aperto. Lancet Oncol, 2016. 17(7): 984-993.
- Planchard D, et al: Dabrafenib più trametinib in pazienti con carcinoma polmonare non a piccole cellule metastatico BRAF(V600E)-mutante precedentemente non trattato: uno studio di fase 2 in aperto. Lancet Oncol, 2017. 18(10): 1307-1316.
- Fakih M, et al: Studio di fase 1 che valuta la sicurezza, la tollerabilità, la farmacocinetica (PK) e l’efficacia di AMG 510, un nuovo piccolo inibitore molecolare di KRASG12C, nei tumori solidi avanzati. Journal of Clinical Oncology, 2019. 37(15_suppl): 3003-3003.
- Gautschi O, et al: Il targeting di RET nei pazienti con tumori polmonari RET-arrangiati: risultati del Registro RET globale, multicentrico. J Clin Oncol, 2017. 35(13): 1403-1410.
- Drilon AE, et al: Uno studio di fase 1 di LOXO-292, un inibitore di RET potente e altamente selettivo, in pazienti con tumori alterati da RET. Journal of Clinical Oncology, 2018, 36(15_suppl): 102-102.
- Gainor JF, et al: Attività clinica e tollerabilità di BLU-667, un inibitore RET altamente potente e selettivo, nei pazienti (pts) con carcinoma polmonare non a piccole cellule (NSCLC) avanzato con fusione RET+. Journal of Clinical Oncology, 2019. 37(15_suppl): 9008-9008.
- Drilon A, et al: Efficacia di larotrectinib nei tumori positivi alla fusione TRK negli adulti e nei bambini. New England Journal of Medicine, 2018. 378(8): 731-739.
- Demetri GD, et al: LBA17Efficacia e sicurezza di entrectinib nei pazienti con tumori positivi alla fusione NTRK (NTRK-fp): analisi in pool di STARTRK-2, STARTRK-1 e ALKA-372-001. Annals of Oncology, 2018. 29(suppl_8).
- “DeVita”, Cancer: Principles & Practice of Oncology di Hellman e Rosenberg, 11a edizione; Wolters Kluwer, 2019.
InFo ONCOLOGIA & EMATOLOGIA 2019; 7(4): 12-17.