I sarcomi sono rari tumori maligni del tessuto connettivo. La terapia è multidisciplinare e dovrebbe essere effettuata presso i centri per i sarcomi. In Svizzera, tutte le discipline del sarcoma si sono organizzate a livello nazionale (www.sarcoma.ch). Qui vengono pubblicate le linee guida terapeutiche, vengono istituiti un registro, uno studio di coorte e una banca dei tessuti. L’asportazione chirurgica completa del tumore è la misura terapeutica più importante, sia per i tumori ossei che per quelli dei tessuti molli. Nel complesso, l’intervento chirurgico viene eseguito con la conservazione dell’arto, per quanto possibile; nel caso di tumori ossei, la ricostruzione viene effettuata preferibilmente con un’endoprotesi (tumore modulare) o in combinazione con un allotrapianto. La radioterapia viene spesso utilizzata per i tumori dei tessuti molli, soprattutto quando il tumore è adiacente a strutture neurovascolari, per migliorare il controllo locale. La chemioterapia sistemica additiva, per lo più a base di doxorubicina, viene utilizzata principalmente per l’osteosarcoma, il sarcoma di Ewing, il rabdomiosarcoma e le metastasi per migliorare la prognosi.
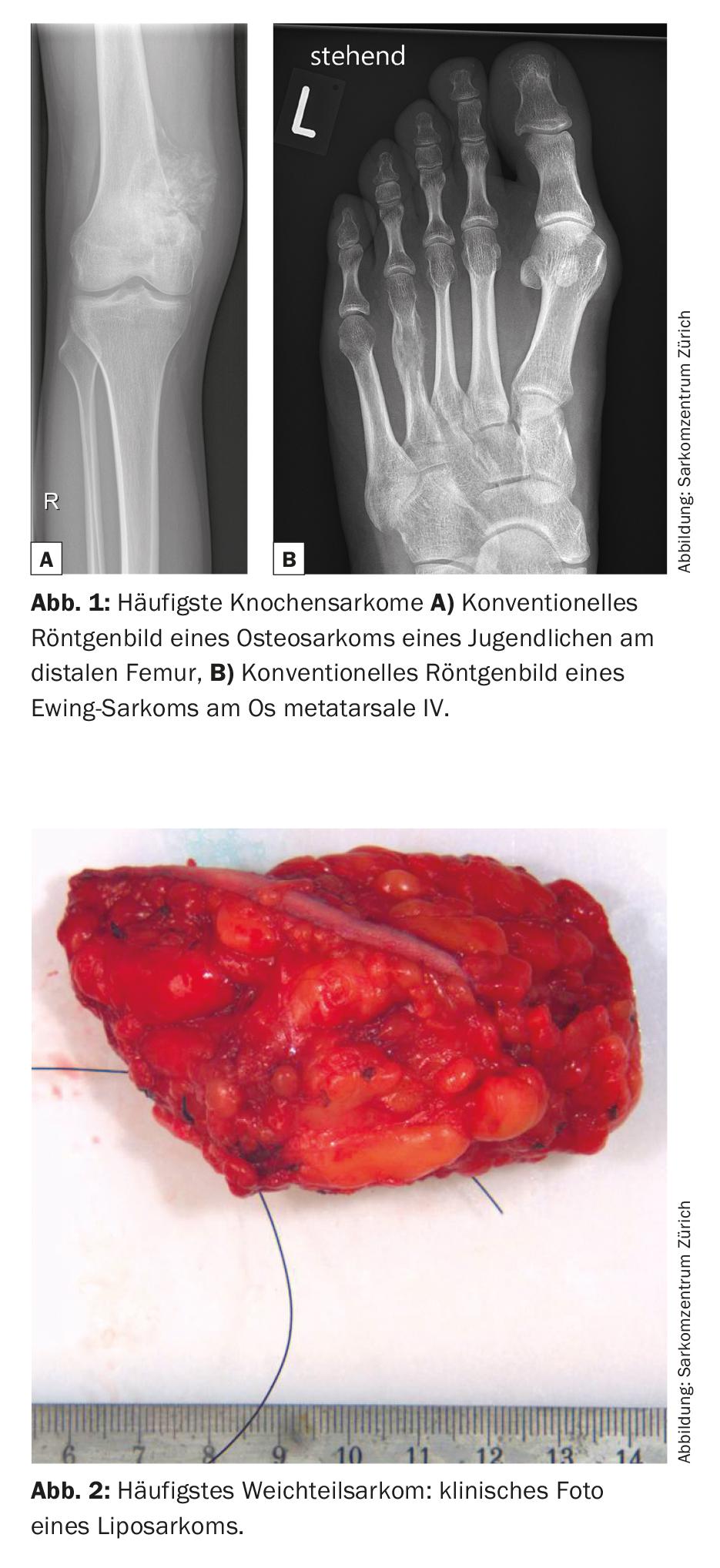
I sarcomi sono tumori maligni rari del tessuto connettivo che rappresentano il 6% di tutti i tumori infantili [1]. Esistono numerosi sottotipi, più di 50 in totale, che possono essere generalmente suddivisi in sarcomi delle ossa e dei tessuti molli. L’osteosarcoma metafisario e il sarcoma di Ewing diafisario sono i sarcomi ossei più comuni, mentre il liposarcoma è uno dei sarcomi dei tessuti molli più comuni (Fig. 1 e 2) .
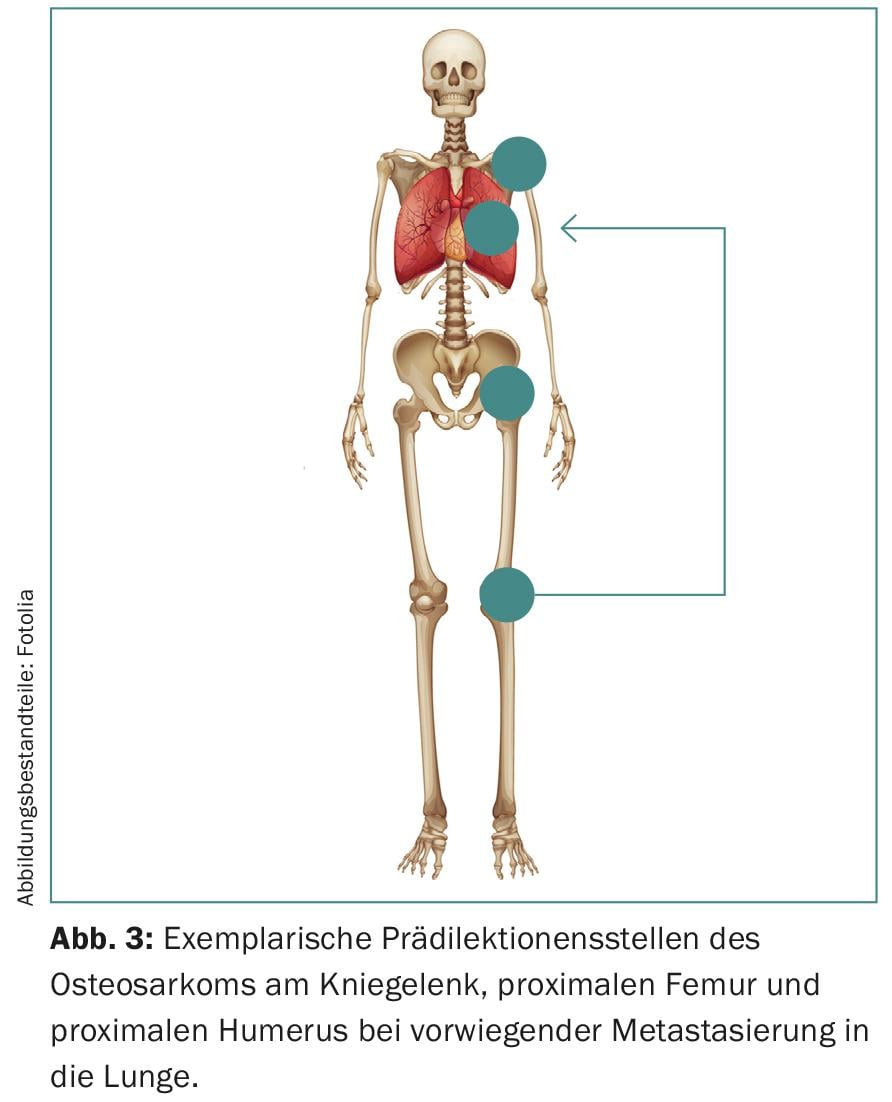
Inoltre, i sarcomi mostrano una predilezione per determinati gruppi di età e strutture anatomiche (Fig. 3) . Si manifestano con una distribuzione bimodale dell’età, soprattutto nelle estremità e nello scheletro assiale. La regione del ginocchio degli adolescenti è particolarmente colpita, anche se possono essere interessati anche la testa, il collo e l’addome.
Diagnostica
Nella maggior parte dei casi, la diagnosi viene fatta sulla base di un reperto incidentale, anche se occasionalmente possono essere presenti gonfiore e dolore. Questi ultimi hanno classicamente un carattere locale e progressivo che si verifica prevalentemente di notte e non può essere influenzato dai FANS (farmaci antinfiammatori non steroidei) [2]. Nell’esame clinico, il tessuto tumorale con la pelle sovrastante e i linfonodi adiacenti devono essere prima ispezionati e palpati localmente. Successivamente, la ricerca di metastasi può essere estesa alla tiroide, all’addome, alla prostata o alla mamma. La sintomatologia sistemica B è molto rara.
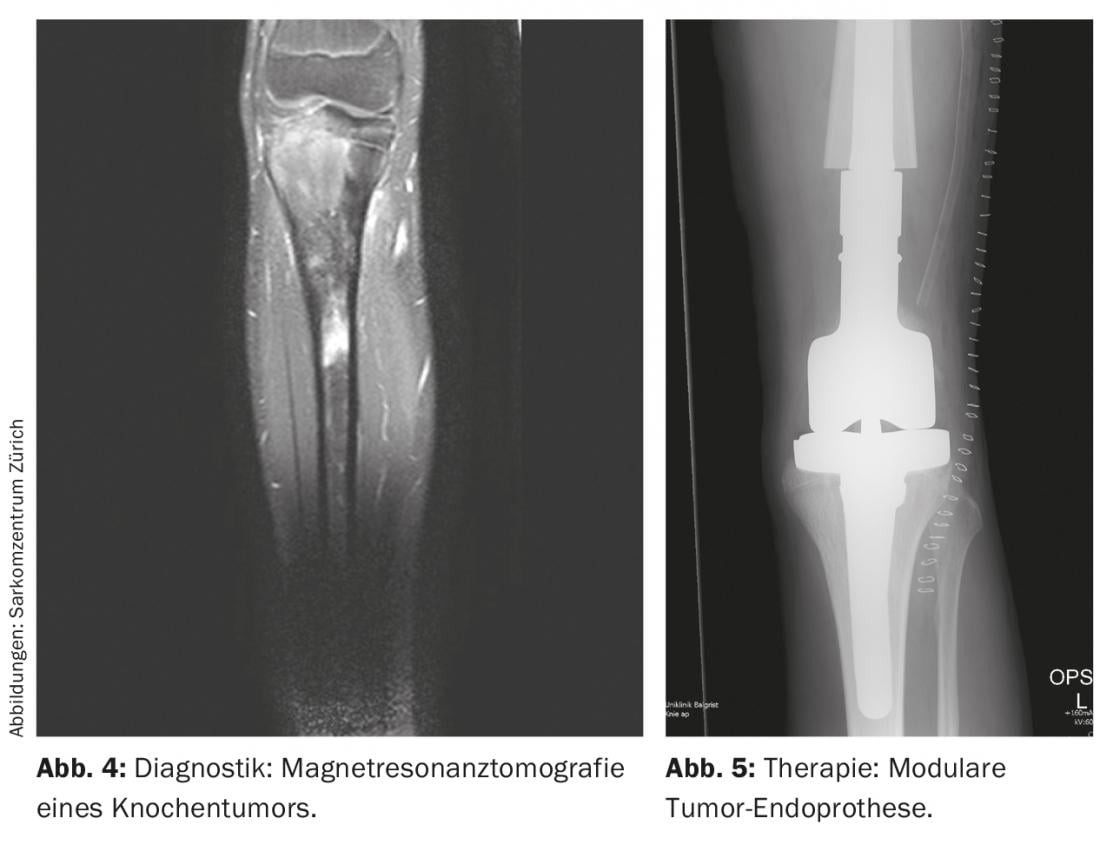
Per localizzare il tumore si ricorre all’imaging radiologico, che comprende immagini radiografiche locali e toraciche in due piani e, se necessario, TAC (tomografia computerizzata), RMN (risonanza magnetica) locale ( Fig. 4 ) e scintigrafia scheletrica con Tc (tecnezio) sistemica o, in alternativa, PET-TC. In generale, va notato che le radiografie convenzionali delle ossa lunghe devono sempre mostrare entrambe le articolazioni adiacenti. Inoltre, vengono esaminati anche i polmoni, perché sono i più frequentemente colpiti dalle metastasi, in circa il 10% dei casi. Al momento della diagnosi, gli osteosarcomi e i sarcomi di Ewing presentano in genere uno sperone periostale noto come triangolo di Codman e calcificazioni periostali simili a una cipolla. Fondamentalmente, si devono registrare le dimensioni (≤ o >10 cm), la localizzazione (epi- o sottofasciale) e lo stato metastatico del tumore. Inoltre, gli esami chimici di laboratorio di routine e la determinazione della lattato deidrogenasi e della fosfatasi alcalina sono utili per escludere le malattie generalizzate e per stimare il peso della malattia, anche se sono relativamente aspecifici.
Infine, una biopsia oggi spesso minimamente invasiva, guidata dalla TAC o dagli USA, può fornire informazioni sul sottotipo specifico di sarcoma attraverso esami microscopici, immunologici e di genetica molecolare. Si fa attenzione a scegliere il tratto bioptico in modo che possa essere rimosso in toto in qualsiasi intervento chirurgico successivo. Se la biopsia con punch dà risultati equivalenti, si esegue una biopsia aperta. Si tratta di evitare gli ematomi dovuti al rischio di disseminazione, utilizzando una chiusura della fascia muscolare o un inserto di redon. Intra-intervento, preparare sempre una prova fresca con ghiaccio. Inoltre, per sicurezza, è necessario effettuare un esame batteriologico. Pertanto, la somministrazione pre-intervento di antibiotici non è consigliabile per non complicare i risultati dell’esame e il trattamento orientato alla resistenza.
Il blocco di tessuto incluso in paraffina viene utilizzato per la classificazione istologica, per la quale esistono diverse possibilità. A seconda della classificazione, seguono poi esami biologici molecolari specifici. La stadiazione a sei stadi (IA-IIIB) secondo Enneking (Musculoskeletal Tumour Society) tiene conto delle metastasi (no vs. sì), del grado istologico (basso vs. alto) e delle dimensioni anatomiche del tumore (intra- vs. extracompartimentale). Nella stadiazione a sette stadi (IA-IVB) dell’AJCC (American Joint Commission on Cancer), un po’ più dettagliata, viene indicato anche il coinvolgimento linfonodale.
Terapia
Le terapie elaborate nei centri per sarcomi altamente specializzati portano a risultati relativamente buoni nel trattamento a lungo termine dei sarcomi localizzati, con tassi di sopravvivenza a 5 anni fino al 75% [3]. Al contrario, i tassi di sopravvivenza per i sarcomi metastatici sono solo del 25% circa. Poiché questi risultati si sono stabilizzati per oltre un decennio, i sarcomi continuano ad essere oggetto di diversi progetti di ricerca internazionali per ottenere una migliore comprensione genetica molecolare e quindi definire nuove opzioni terapeutiche.
La terapia richiede un team interdisciplinare di chirurghi ortopedici, radio-, oncologi, radiologi e patologi. In base alle loro entità demografiche, ogni paziente e anche ogni sottotipo di sarcoma, simile alle neoplasie ematopoietiche, deve ricevere una terapia unica, multidisciplinare e spesso multimodale, adattata ai cambiamenti biologici. In generale, l’obiettivo terapeutico curativo per i tumori localizzati è l’escissione chirurgica completa del tumore. Nei sarcomi ossei, in particolare, la chemioterapia e la radioterapia vengono utilizzate in aggiunta per ridurre le (micro)metastasi e le recidive locali. I sarcomi dei tessuti molli sono molto spesso trattati con una terapia combinata, con la radioterapia prima o dopo l’intervento chirurgico. Un approccio palliativo deve essere preso in considerazione non appena sono presenti metastasi alla diagnosi, che riguarda circa il 10% dei pazienti. Le linee guida per la valutazione, la diagnosi, le opzioni di trattamento e il follow-up sono state stabilite dal Comitato consultivo nazionale svizzero per il sarcoma e pubblicate sul sito web www.sarcoma.ch.
Operazione
Dalla sua introduzione, oltre 30 anni fa, l’asportazione chirurgica completa del tumore è emersa come l’opzione terapeutica più importante (Fig. 2) e ha la migliore “risposta terapeutica” di tutte le modalità di trattamento. In particolare, può essere utilizzato come terapia singolare per tumori piccoli (<5 cm), completamente rimossi e di basso grado dei tessuti molli [4]. La natura del margine di resezione è fondamentale per il tasso di recidiva, che è del 100% per un margine intralesionale, <50% per un margine marginale e <10% per un margine ampio (>1 cm). Se l’asportazione completa del tessuto tumorale non viene raggiunta durante l’intervento primario, si deve prendere in considerazione la chirurgia secondaria in termini di post-resezione, invece di sostituire altre opzioni terapeutiche. Inoltre, la metastasectomia curativa continua ad essere controversa.
La scelta del metodo chirurgico più adatto si basa principalmente sulla classificazione e sulla localizzazione del tumore. Di norma, le tecniche chirurgiche che preservano l’arto sono preferite quando è possibile. Questi includono la resezione iniziale del tumore in blocco e la successiva ricostruzione. L’obiettivo è ottenere una resezione del tumore equivalente all’amputazione classica, preservando la funzione nel modo più fisiologico possibile. Per quanto riguarda le localizzazioni assiali del tumore, la navigazione guidata dalla TAC può essere utile per risparmiare importanti strutture neurovascolari, soprattutto nelle operazioni pelviche difficili. Tuttavia, la prognosi dei tumori assiali è peggiore rispetto a quella delle estremità, a causa della difficile resecabilità [5].
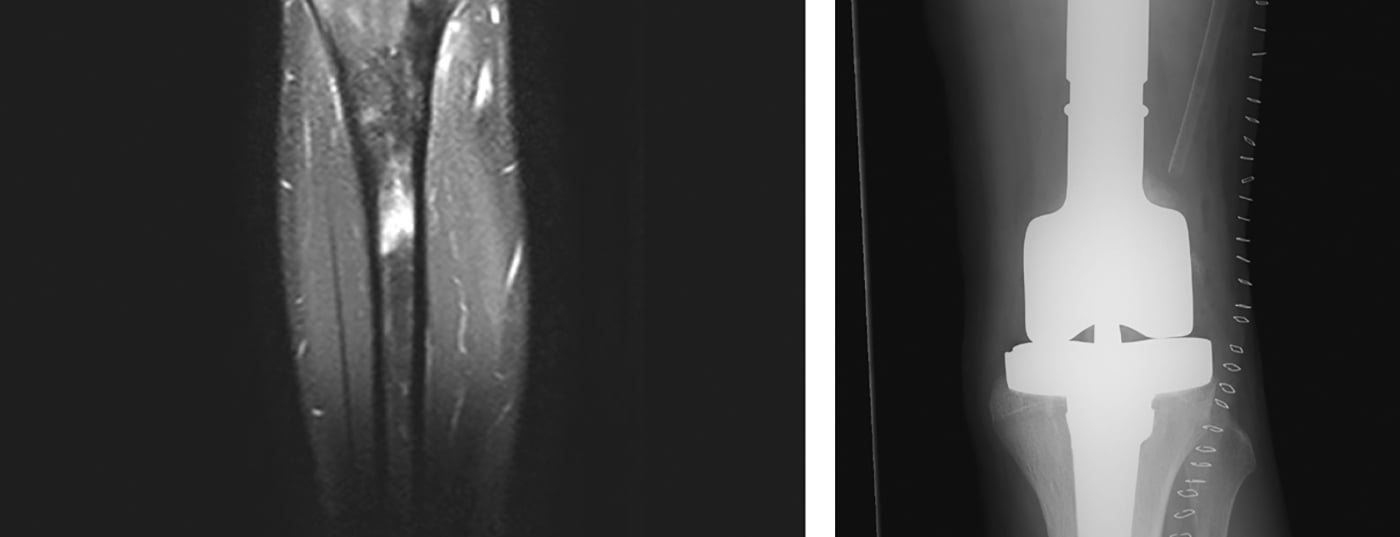
Di solito, si utilizzano allotrapianti e/o endoprotesi modulari (tumorali) (Fig. 5) [6]. Negli ultimi anni, gli allotrapianti sono diventati più disponibili attraverso le banche ossee, forniscono un mantello di tessuto molle adeguato e portano all’osteointegrazione nel corpo dopo diversi anni. Tuttavia, non c’è solo un aumento del rischio di frattura, ma anche il rischio di pseudoartrosi dovuta all’ossificazione della zona innesto-ospite, che dura fino a un anno. Le endoprotesi sono utilizzate principalmente per i tumori metafisari con la necessaria resezione articolare e/o epifisaria per preservare il range di movimento e compensare le differenze di lunghezza delle gambe. Offrono il vantaggio di un’assunzione di peso completa post-operatoria relativamente rapida, con un buon range di movimento. Tuttavia, ci sono i soliti svantaggi delle protesi, che possono allentarsi in circa il 5-10% dei pazienti. A questo proposito, mostrano tassi di sopravvivenza a 5 e 10 anni di circa l’80% e il 70%, rispettivamente. Un composito protesico allotrapianto offre il vantaggio di un migliore ancoraggio dei tessuti molli con un minor rischio di mobilizzazione rispetto al solo impianto di protesi ed è altrimenti in grado di combinare gli altri vantaggi e svantaggi di entrambi i metodi.
L’amputazione viene eseguita in meno del 10% dei casi e oggi viene utilizzata come ultima risorsa, in quanto non porta a tassi di sopravvivenza migliori rispetto alla chirurgia conservativa degli arti adeguatamente eseguita [7]. Si tratta di un’opzione terapeutica valida soprattutto per le recidive non ricostruibili che interessano le strutture neurovascolari e quindi limitano la funzione. A questo proposito, l’odierna protesizzazione offre buone e diverse possibilità, soprattutto per i monconi di amputazione che sono il più distali possibile. Inoltre, una plastica di inversione di Van Ness è un’amputazione intercalare di accorciamento dell’arto in cui la parte inferiore della gamba, compreso il piede, viene fissata all’arto prossimale. Questo permette all’articolazione superiore della caviglia di assumere la funzione dell’articolazione del ginocchio e di controllare meglio una protesi.
Chemioterapia
La chemioterapia sistemica può essere somministrata in concomitanza con l’intervento chirurgico, in fase preoperatoria o postoperatoria, o in entrambe le fasi, a seconda del tipo di tumore. Di solito consiste in una combinazione a base di doxorubicina [8], in cui la doxorubicina interferisce con la sintesi del DNA come intercalante e porta all’apoptosi attraverso la formazione di radicali liberi. Nel caso dell’osteosarcoma, questo consiste solitamente in diversi cicli di doxorubicina, metotrexato e cisplatino. Oltre agli osteosarcomi, i sarcomi di Ewing, i rabdomiosarcomi e le metastasi sono spesso trattati con la chemioterapia. Tuttavia, il loro effetto terapeutico e quindi prognostico è controverso, soprattutto nei sarcomi dei tessuti molli. A causa degli effetti collaterali non trascurabili, come la nefrotossicità o la cardiotossicità, è necessario effettuare un’analisi del rischio-beneficio in ogni singolo caso. Inoltre, l’applicazione è migliore nel contesto degli studi clinici.
Può essere somministrato prima dell’intervento, in modo neoadiuvante, o dopo l’intervento, in modo adiuvante, per circa sette mesi. Il vantaggio dell’uso neoadiuvante è la riduzione della massa tumorale, il trattamento di micrometastasi radiologicamente invisibili e la rilevanza prognostica. Le micrometastasi si trovano fino all’80% dei casi, soprattutto negli osteosarcomi. La prognosi dipende in modo cruciale dalla risposta alla chemioterapia e si riflette nel tasso di necrosi istologica (≥90% = buona vs. <90% = scarsa) secondo Salzer-Kuntschik.
Radioterapia
La radioterapia è un’altra opzione di trattamento, soprattutto per i sarcomi dei tessuti molli. Può ridurre il tasso di recidiva, che è inferiore al 10%. Non è chiaro se questo influisca anche sulla formazione di metastasi e sulla prognosi. Viene utilizzato principalmente per i sarcomi di grandi dimensioni, profondi, di alto grado, incompletamente escissi, neurovascolari, dei tessuti molli e metastatici [9]. In genere, porta a rotture tossiche del doppio filamento del DNA (acido desossiribonucleico) della cellula attraverso i radicali liberi e quindi all’apoptosi. L’uso preoperatorio è spesso preferito. Da un lato, ciò consente una dose terapeutica inferiore, pari a circa 50 Gy (Gray), grazie al contorno più dettagliato e al volume più piccolo; dall’altro, è possibile ottenere un risultato funzionale migliore a lungo termine. Tuttavia, c’è anche un rischio maggiore di disturbi reversibili della guarigione post-operatoria. L’uso adiuvante, invece, porta più spesso a complicazioni tardive irreversibili, come linfedema, fibrosi, rigidità articolare, fratture da stress e sarcomi post-radiazione, quindi è meglio evitarli.
Altre opzioni di trattamento
Oltre alle terapie standard consolidate già menzionate, esistono altre opzioni terapeutiche la cui efficacia o superiorità non è ancora stata sufficientemente dimostrata in studi randomizzati e controllati. Queste includono l’ipertermia regionale a livello locale, la perfusione ipertermica isolata dell’arto, l’infusione isolata dell’arto e la brachiterapia locale con catetere, e a livello sistemico gli anticorpi monoclonali, i bifosfonati, la terapia con cellule staminali e la nanotecnologia (fotodinamica) [10].
Controlli di follow-up
Oltre al follow-up clinico iniziale, che varia a seconda della procedura, il primo follow-up clinico-radiologico, che include un esame radiologico, ha luogo tre mesi dopo l’intervento. radiografia convenzionale locale e risonanza magnetica dell’area tumorale, nonché una TAC del torace per escludere le metastasi (vedere anche www.sarcoma.ch). Poiché la maggior parte delle recidive o delle metastasi tardive si verificano nei primi due o tre anni, le visite di follow-up vengono effettuate ogni tre mesi in questo periodo, prima di effettuare consultazioni semestrali fino al follow-up di cinque anni. Successivamente, lo schema viene adattato ai controlli da uno a due anni.
Conflitto di interessi: Gli autori dichiarano che non esiste alcun conflitto di interessi.
Letteratura:
- HaDuong JH, et al: Sarcomi. Pediatrica Clin Nord Am 2015; 62: 179-200
- Miller MD, et al. Revisione dell’ortopedia.6ª ed. Philadelphia, PA: Elsevier Saunders 2012; 623-674.
- Kager L, et al: Osteosarcoma primario metastatico: presentazione ed esito dei pazienti trattati con protocolli neoadiuvanti del Cooperative Osteosarcoma Study Group. J Clin Oncol 2003; 21: 2011-2018.
- Ferrone ML, Raut CP: La terapia chirurgica moderna: il salvataggio degli arti e il ruolo dell’amputazione per i sarcomi dei tessuti molli delle estremità. Surg Oncol Clin N Am 2012; 21: 201-213.
- Jentzsch T, et al.: Espressione di MSH2 e MSH6 su un microarray tissutale in pazienti con osteosarcoma. Anticancer Res 2014; 34: 6961-6972.
- Moore DD, Luu HH: Osteosarcoma. Cancer Treat Res 2014; 162: 65-92.
- Grimer RJ, et al: Esiti chirurgici nell’osteosarcoma. J Bone Joint Surg Br 2002; 84: 395-400.
- Whelan JS, et al: EURAMOS-1, uno studio randomizzato internazionale per l’osteosarcoma: risultati del trattamento pre-randomizzazione. Ann Oncol 2015 Feb; 26(2): 407-414.
- Yang JC, et al: Studio prospettico randomizzato sul beneficio della radioterapia adiuvante nel trattamento dei sarcomi dei tessuti molli dell’estremità. J Clin Oncol 1998; 16: 197-203.
- Wunder JS, et al: Opportunità per migliorare il rapporto terapeutico per i pazienti con sarcoma. Lancet Oncol 2007; 8: 513-524
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(5): 18-21