La gestione dell’hidradenitis suppurativa rimane una sfida clinica. Spesso è necessaria una combinazione di diverse modalità di trattamento per ottenere un grado sufficiente di controllo della malattia. Uno studio ha dimostrato che l’uso combinato di adalimumab in parallelo all’escissione chirurgica è efficace e sicuro. Finora, l’adalimumab è l’unico biologico approvato nell’HS, ma diversi altri candidati farmaci antinfiammatori sistemici sono attualmente in fase di studio nei programmi di sperimentazione clinica.
L’idradenite suppurativa (HS) è una malattia cronica recidivante, progressiva, immuno-mediata. I noduli, gli ascessi e le fistole si verificano preferibilmente a livello ascellare, inguinale e anogenitale e possono essere molto dolorosi. Se il trattamento non è abbastanza precoce, le infiammazioni possono trasformarsi in danni irreversibili ai tessuti, ha spiegato il Prof. Dr. med. Falk Bechara, medico senior di Dermatologia presso l’Ospedale Universitario dell’Università della Ruhr di Bochum (D) [1]. La HS può essere diagnosticata utilizzando i seguenti criteri [2–4]:
- morfologia caratteristica delle lesioni,
- distribuzione caratteristica delle lesioni,
- Cronicità e manifestazioni ricorrenti
Se un paziente soddisfa tutti e tre questi criteri diagnostici, si tratta di HS con una sensibilità del 90% e una specificità del 97% [2–4]. La gravità dell’HS viene solitamente valutata secondo la classificazione di Hurley [2–4] (lieve=stadio I, moderato=stadio II, grave=stadio III). Per quanto riguarda la fisiopatologia, ci sono ancora molte domande aperte, ha detto il relatore. Sembra che molti mediatori infiammatori e altri parametri siano regolati nei pazienti con HS.
Le opzioni di trattamento più importanti per l’HS oggi sono: antibiotici sistemici, chirurgia, biologici. Il Prof. Bechara ha aggiunto che di solito diversi di questi approcci terapeutici vengono combinati [1].
OP: Cambio di paradigma per quanto riguarda l’approccio
L’intervento chirurgico è solitamente necessario per i pazienti negli stadi Hurley II o III [11]. L’obiettivo principale è quello di rimuovere i tratti fistolosi e di prevenire la ricorrenza delle singole lesioni [12,13]. Una resezione anatomica completa per le fistole iniziali, come si praticava in passato, oggi non si farebbe più, ha spiegato il Prof. Bechara [1]. Invece, l’attenzione si concentra attualmente sull’identificazione del danno tissutale irreversibile. Il punto è resecare gli stadi cicatriziali fistolizzanti irreversibili e non semplicemente tutte le manifestazioni infiammatorie della malattia. Il docente ha spiegato che le lesioni piatte possono anche essere operate in piano e combinate con farmaci; non sempre è necessario un intervento radicale.
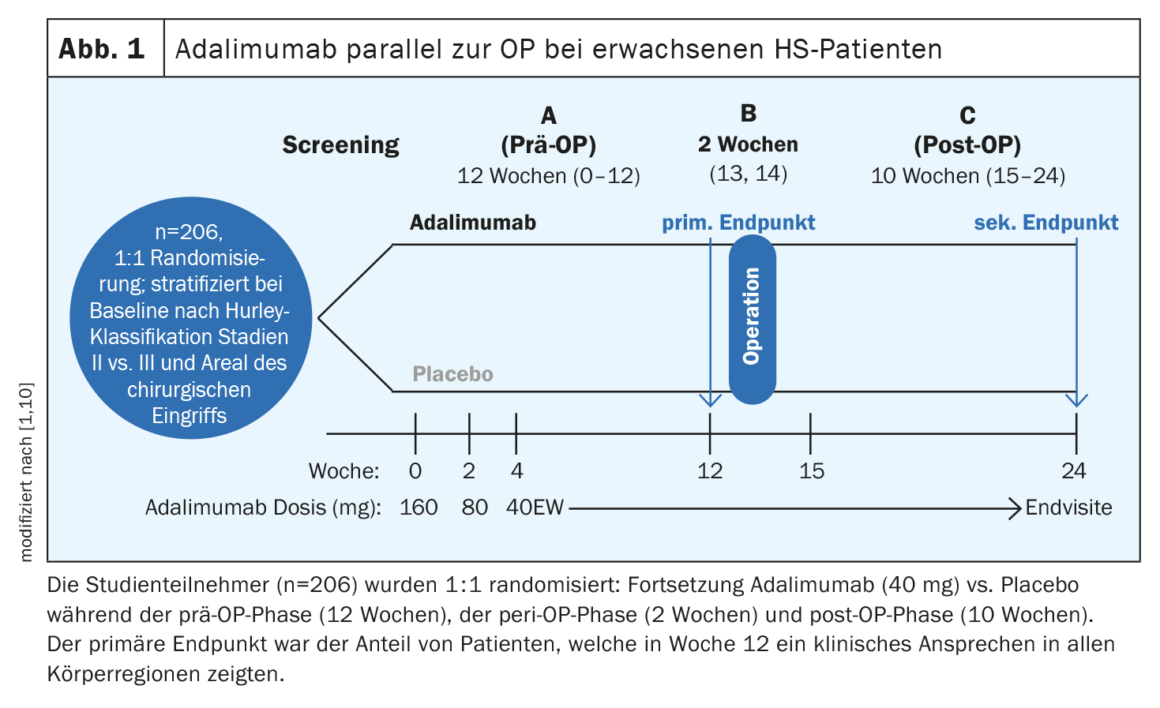
L’adalimumab parallelo all’intervento chirurgico si è rivelato efficace e sicuro
A parte l’adalimumab, nessun altro biologico ha superato gli ostacoli dell’approvazione finora. “Abbiamo una preparazione che funziona e stiamo anche lavorando con essa, ma c’è un ampio margine di miglioramento”, ha riassunto il relatore [1]. Negli studi PIONEER I e II, l’adalimumab ha raggiunto tassi di risposta HiSCR50 del 42% e 59%, rispettivamente, rispetto al 26% e 28% del placebo [5]. Prima di un intervento chirurgico, spesso si pone la domanda se interrompere o meno il farmaco biologico. In uno studio pubblicato nel 2021, è stato dimostrato che adalimumab è efficace in combinazione con un intervento chirurgico maggiore seguito da una guarigione secondaria, senza la necessità di interrompere il trattamento prima dell’intervento [10]. Lo studio SHARPS (Safety and Efficacy of Adalimumab for Hidradenitis Suppurativa Peri-Surgically) è stato uno studio di fase IV randomizzato, in doppio cieco, controllato con placebo, su adalimumab in combinazione con la chirurgia (Fig. 1) . Un totale di 103 pazienti sono stati randomizzati ad adalimumab e 103 a placebo. L’età media (SD) era di 37,6 (11,3) anni, il 51% dei partecipanti erano donne. Una risposta clinica all’HS in tutte le regioni del corpo è stata raggiunta alla settimana 12 nel 48% dei partecipanti allo studio che assumevano adalimumab e nel 34% che assumevano placebo (p=0,049). Gli eventi avversi correlati al trattamento sono stati segnalati nel 72% del braccio adalimumab e nel 69% del braccio placebo. Non è stato osservato un aumento del rischio di infezioni, complicazioni o emorragie post-operatorie con adalimumab rispetto al placebo.
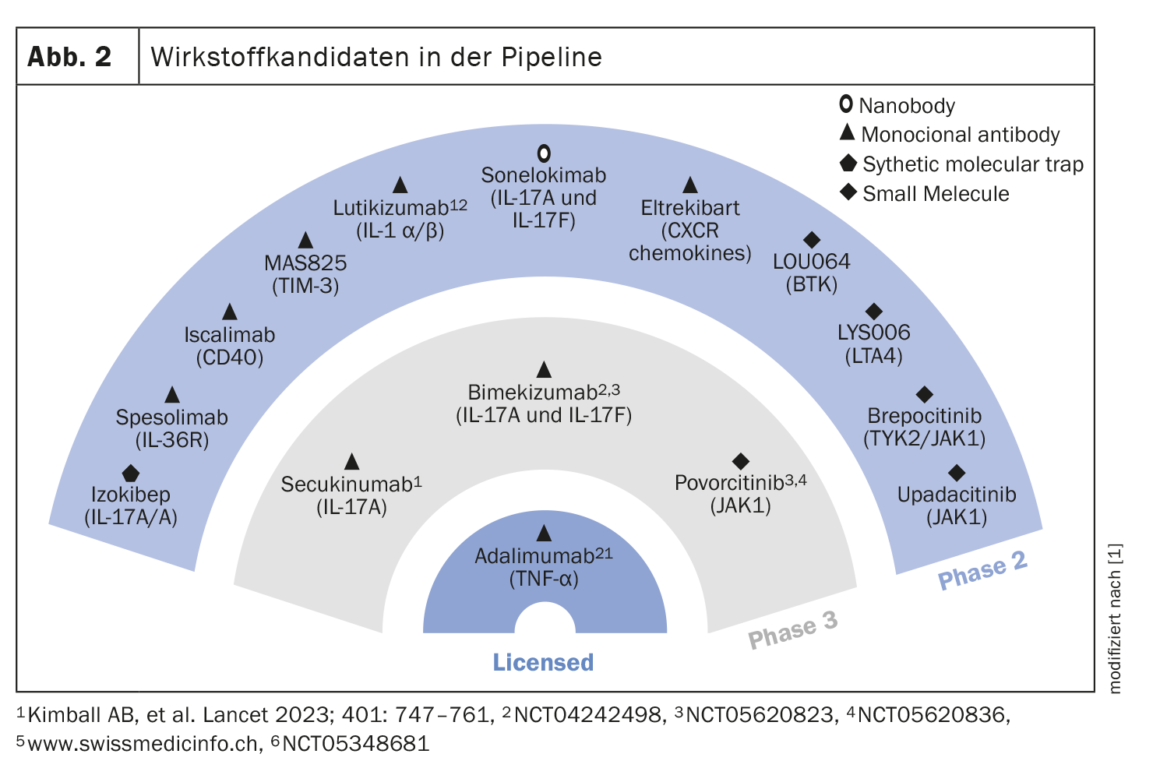
Altri candidati farmaci in cantiere
I candidati farmaci attualmente in fase di studio nella fase II e III sono mostrati nella Figura 2. In due studi clinici, l’inibitore dell’IL17A secukinumab a due dosi (300 mg ogni 2 settimane o ogni 4 settimane) ha dimostrato di avere tassi di risposta stabili fino alla settimana 52, con il 54,8% e il 55,3% in SUNSHINE e il 63,4% e il 58,6% in SUNRISE [6]. L’inibitore doppio dell’IL17A/F bimekizumab (320 mg q2w) ha raggiunto l’endpoint primario dell’HiSCR50 nello studio BE HEARD I rispetto al placebo, e ha anche raggiunto il livello di significatività nel BE HEARD II. Un anticorpo monoclonale con IL36R come bersaglio è lo spesolimab [7]. In uno studio proof-of-concept, spesolimab si è dimostrato molto efficace alla settimana 12, in particolare per quanto riguarda le fistole drenanti. La dose di carico è stata di 1200 mg (i.v.) alle settimane 0,1 e 2. Nella terapia di mantenimento, la stessa dose è stata somministrata alle settimane 4,6,8 e 10. Un altro candidato farmaco in fase di ricerca per l’uso nell’HS è Izokibep. Il suo bersaglio è l’omodimero IL17A. Le dimensioni ridotte della molecola consentono una migliore penetrazione nei tessuti. In uno studio in aperto non controllato con placebo su 30 pazienti, una percentuale del 71% ha ottenuto una risposta HiSCR50 alla settimana 12 con Izokibep 160 mg [8]. Un inibitore selettivo di JAK1 per il quale sono disponibili dati di fase II per l’area di indicazione HS è povorcitinib. Alla dose più alta (90 mg), oltre l’80% dei 9 pazienti ha raggiunto l’HiSCR50 alla settimana 8 [9].
Congresso: Conferenza annuale DDG
Letteratura:
- «Acne inversa: Medikamente, Messer, Mischung», Prof. Dr. med. Falk Bechara, DDG-Jahrestagung, 26.–29.04.2023.
- Johnston LA, et al.: Practical Guidelines for Managing Patients With Hidradenitis Suppurativa: An Update. J Cutan Med Surg 2022; 26(2_suppl): 2S–24S.
- Daxhelet M, et al.: Proposed definitions of typical lesions in hidradenitis suppurativa. Dermatology 2020; 236(5): 431–438.
- Revuz JE, Jemec GBE: Diagnosing hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 1–5.
- Kimball AB, et al.: Two Phase 3 Trials of Adalimumab for Hidradenitis Suppurativa. NEJM 2016; 375: 422–434.
- Kimball AB, et al.: Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023; 401(10378): 747–761.
- Alavi et al. Spesolimab for Hidradenitis Suppurativa: a proof-of-concept study in patients with Hidradenitis suppurativa. AAD 2023; Poster 43019
- Papp K, et al.: Izokibep, a novel IL17A-inhibitor demnstrates HiSCR100 Responses in moderate-to-severe Hidradenitis suppurativa: week 12 results of open-label par A of a Phase 2b/3-study. AAD 2023; Late-breaking oral.
- Alavi A, et al.: Janus kinase 1 inhibitor INCB054707 for patients with moderate-to-severe hidradenitis suppurativa: results from two phase II studies. Br J Dermatol 2022; 186(5): 803–813.
- Bechara FG, et al.: Efficacy and Safety of Adalimumab in Conjunction With Surgery in Moderate to Severe Hidradenitis Suppurativa: The SHARPS Randomized Clinical Trial. JAMA Surg 2021; 156(11): 1001–1009.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Akt Dermatol 2019; 45: 277–287.
- Melendez Gonzalez MDM, Sayed CJ. Surgery is an essential aspect of managing patients with hidradenitis suppurativa. J Am Acad Dermatol 2020; 83(3): 979–980.
- Janse I, et al.: Surgical procedures in hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 97109.
DERMATOLOGIE PRAXIS 2023; 33(3): 28–29