Il carcinoma a cellule di Merkel è una forma rara ma aggressiva di cancro della pelle. A essere colpite sono soprattutto le persone anziane; l’età media alla diagnosi è di 75 anni. Dopo l’escissione chirurgica del tumore primario, si raccomanda la radioterapia adiuvante. In uno stadio avanzato o in caso di metastasi a distanza, si deve prendere in considerazione l’immunoterapia. L’unico anticorpo PD-L1 approvato finora in Svizzera ha rivoluzionato le opzioni di trattamento.
“Il carcinoma a cellule di Merkel è estremamente eterogeneo nella presentazione clinica”, ha riferito Anja Wysocki, MD, Co-Capo della Dermatologia dell’Ospedale Cantonale di Lucerna [1]. Oltre alla forma nodulare più comune, raramente si verificano varianti simili a placche, che si trovano principalmente sul tronco e sulle estremità prossimali.
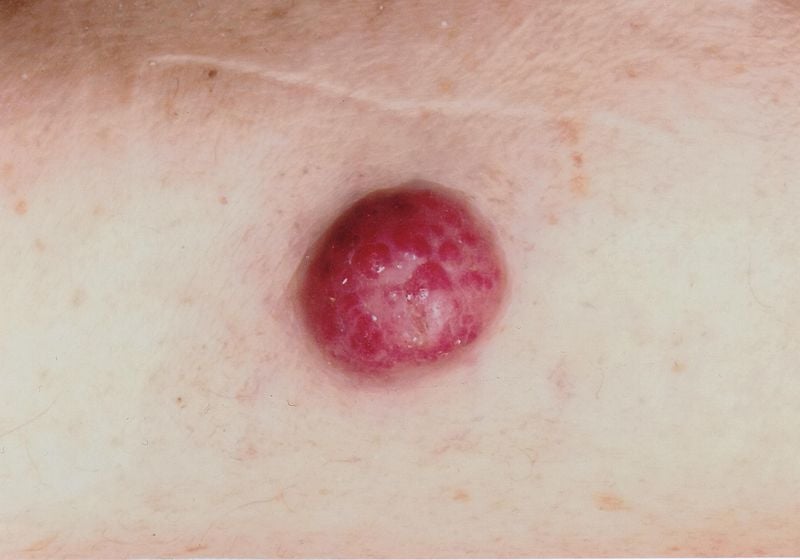
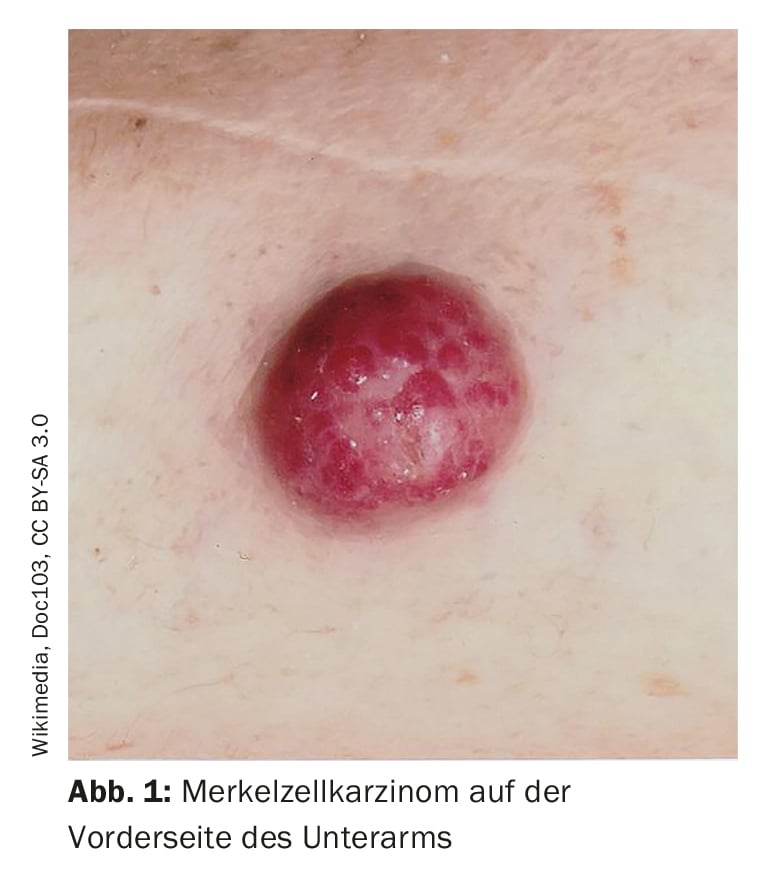
Le diagnosi errate sono relativamente comuni, ha sottolineato il relatore. C’è confusione con follicolite, dermatofibromi, lipomi o angiomi, per esempio, e a volte un carcinoma a cellule di Merkel viene erroneamente interpretato come un carcinoma a cellule basali, spinalioma, melanoma o sarcoma. Il carcinoma a cellule di Merkel (MCC) si sviluppa rapidamente, di solito nell’arco di settimane o pochi mesi, come un tumore asintomatico, rigonfio, di colore rosso-violaceo, con una superficie liscia, di solito lucida. (Fig. 1). Alla dermoscopia, l’MCC si presenta come aree rosa, prive di struttura, con linee sottili bianche; negli stadi avanzati si possono vedere anche delle ulcerazioni, mentre le metastasi satellitari si trovano più frequentemente. La localizzazione preferita della MCC è la pelle cronicamente danneggiata dal sole della regione della testa e del collo (più della metà dei casi) e delle estremità distali (circa un terzo dei casi) [2]. Oltre all’esposizione ai raggi UV come fattore di rischio significativo di MCC, esiste un’associazione con il poliomavirus delle cellule di Merkel (MCPyV) in più della metà dei pazienti [2].
Oltre alla linea guida s2k in lingua tedesca sul carcinoma a cellule di Merkel di Becker et al. Una linea guida in lingua inglese è stata pubblicata anche nel 2022 [2,3]. Il relatore ha approfondito alcune importanti raccomandazioni delle linee guida sulla diagnostica e sulla terapia.
Come si riconosce un MCC ad alto rischio?
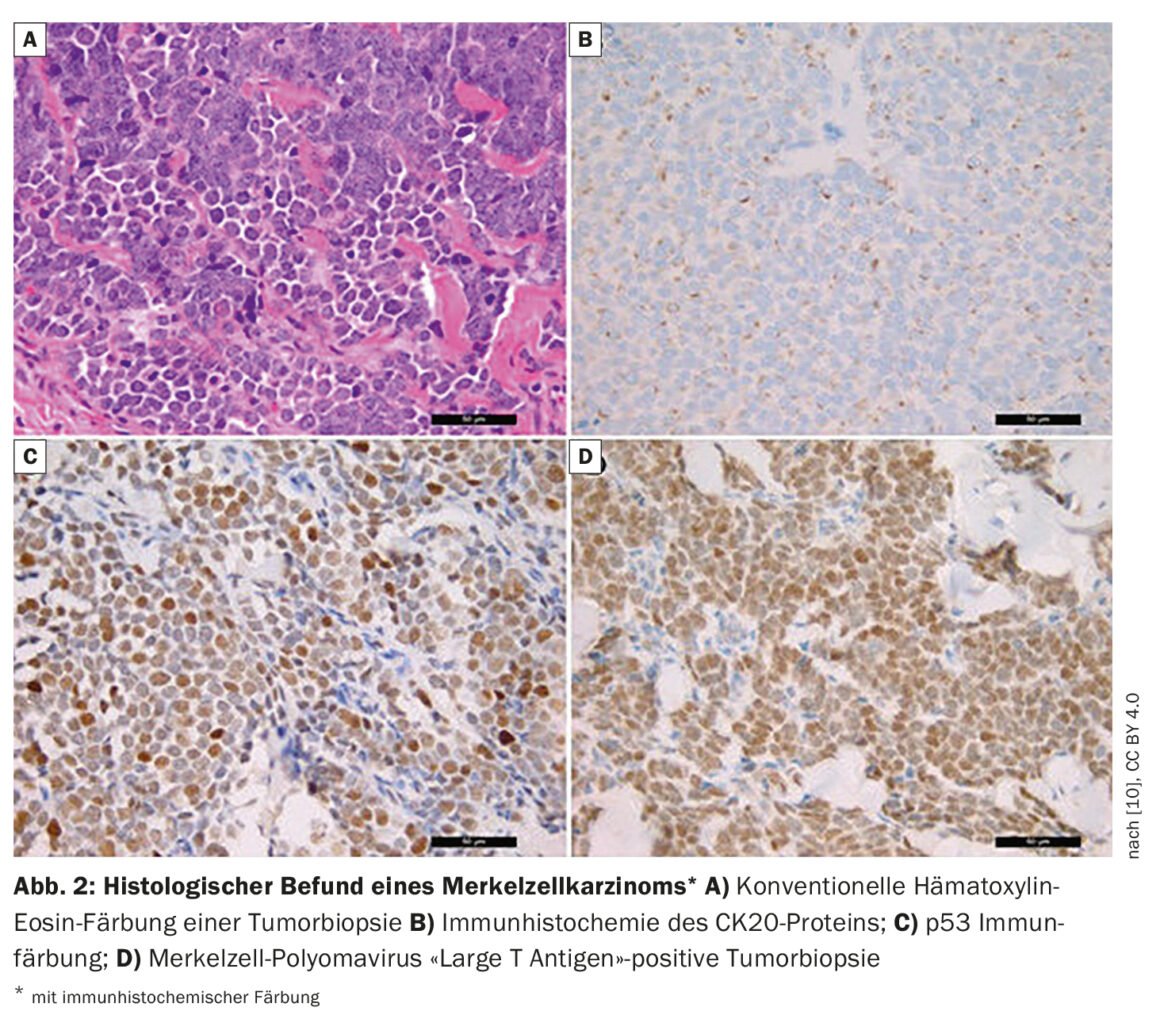
“Un quarto dei pazienti ha già metastasi linfonodali al momento della diagnosi iniziale e l’8% ha metastasi a distanza”, afferma il dottor Wysocki [1]. Nei pazienti con sospetto di MCC, oltre all’ispezione si esegue una biopsia o un’escissione totale. Se è stata riscontrata un’evidenza istologica di MCC (riquadro, Fig. 2) , viene eseguita una FDG-PET/CT. Se i risultati sono negativi, cioè il paziente non presenta metastasi nei linfonodi o in altri organi, viene eseguita una biopsia del linfonodo sentinella. Le caratteristiche del paziente per la MCC ad alto rischio includono l’età superiore a 77 anni e l’esposizione ai raggi UV (l’anamnesi di PUVA causa un rischio aumentato di 100 volte). Gli uomini hanno un rischio 2,5 volte superiore e anche le persone immunosoppresse (HIV, neoplasie ematologiche, riceventi di trapianti d’organo) hanno un rischio maggiore. Ulteriori criteri per un MCC ad alto rischio sono le dimensioni del tumore >2 cm e l’invasione profonda oltre il tessuto adiposo sottocutaneo. Il relatore ritiene importante che lo spessore del tumore e la profondità di penetrazione siano documentati nei referti patologici. Spesso i pazienti hanno già linfonodi rilevabili dal punto di vista patologico o c’è un’invasione linfovascolare. Secondo le linee guida NCCN (National Comprehensive Cancer Network)2021, quest’ultimo è un criterio ad alto rischio [4].
Escissione: la distanza di sicurezza ottimale è difficile da definire.
Quanto prima il carcinoma a cellule di Merkel viene individuato e completamente rimosso durante l’intervento chirurgico, tanto migliore è la prognosi. “La definizione del margine di sicurezza nel carcinoma a cellule di Merkel è controversa”, ha sottolineato il dottor Wysocki [1]. Alcuni esperti suggeriscono di prendere una distanza di sicurezza di 1 cm e poi di fare un trattamento adiuvante post-radiazione. Anche le distanze di incisione <1 cm sono tollerabili se successivamente viene somministrata la radioterapia adiuvante. La chirurgia Mohs è sicura quanto la scelta di ampi margini di sicurezza per un’escissione locale standard. Questo è il risultato di una pubblicazione di Carrasquillo et al. pubblicata nel 2022. è emerso [5]. Se non si utilizza un adiuvante post-radiazione, è necessario mantenere una distanza di sicurezza di circa 2 cm. “Ma la distanza di sicurezza ottimale è difficile da definire e deve essere determinata nel consiglio del tumore in ogni singolo caso”, ha sottolineato il relatore [1].
Gli esperti consigliano la radioterapia adiuvante
Dopo l’intervento chirurgico, la radioterapia adiuvante del letto tumorale e delle vie di drenaggio linfatico circostanti può ridurre il rischio di recidiva della malattia. Tuttavia, la radioterapia adiuvante non è solo importante per prevenire una recidiva, ma migliora anche la sopravvivenza globale (OS), la sopravvivenza libera da malattia e contrasta la comparsa di metastasi a distanza, ha dichiarato il Dr. Wysocki [1,3]. L’irradiazione adiuvante del letto tumorale primario deve essere eseguita entro 8 settimane dall’escissione chirurgica con una dose totale di 50-55 Gy per la localizzazione del tumore nella regione della testa e del collo o 60-66 Gy per i margini microscopici e macroscopicamente positivi. “Quando rieseguiamo il tumore primario, eseguiamo anche la biopsia del linfonodo sentinella nello stesso momento, se la stadiazione non era rilevante”, ha riferito il relatore [1]. Questo perché circa un quarto dei pazienti con MCC presenta già metastasi linfonodali microscopiche al momento del tumore primario. Tuttavia, questo viene deciso su base individuale, a seconda delle condizioni generali del paziente, della capacità di essere anestetizzato e della posizione. All’Ospedale Cantonale di Lucerna, tutti i casi di MCC vengono discussi dal comitato interdisciplinare per i tumori. La radioterapia può anche essere utilizzata per integrare la chirurgia e la terapia sistemica per i tumori a cellule di Merkel metastatici. Una raccomandazione basata sul consenso afferma che in caso di biopsia positiva del linfonodo sentinella, la radioterapia adiuvante deve essere eseguita nella regione linfonodale o combinata con la dissezione linfonodale completa.
L’anticorpo anti-PDL-1 avelumab – risultati migliori rispetto alla chemioterapia
In passato, le chemioterapie avevano una OS mediana di soli 9 mesi nella situazione metastatica. Gli anticorpi anti-PDL-1 rappresentano un importante passo avanti in questo senso, ha sottolineato il dottor Wysocki [1]. L’anticorpo anti-PD-L1 avelumab (Bavencio®) è stato approvato in Svizzera per l’MCC metastatico (mCC) dal 2017 [6]. Nello studio di fase II JAVELIN Merkel 2000, avelumab è stato valutato in pazienti che avevano già ricevuto almeno una terapia citostatica precedente per la MCC [7,8].
Negli 88 pazienti studiati con avelumab di seconda linea, è stato raggiunto un tasso di risposta obiettiva del 33% dopo un follow-up mediano di 65 mesi; la durata mediana della risposta è stata di 40,5 mesi [7]. La sopravvivenza mediana libera da progressione (PFS) è stata di 2,7 mesi e il tasso di PFS dopo 24 mesi è stato del 26%. La OS mediana era di 12,6 mesi e il tasso di OS era del 31% dopo 42 mesi. Si tratta di risultati molto buoni rispetto alla chemioterapia, ha riassunto il relatore [2]. Lo studio è stato successivamente esteso per includere i pazienti in prima linea di terapia [9]. Su 116 pazienti trattati con avelumab come prima linea (follow-up mediano: 21,2 mesi), 35 pazienti hanno risposto in un periodo ≥6 mesi, corrispondente a un tasso di risposta durevole (DRR) del 30,2%. Il tasso di risposta globale (ORR) è stato del 39,7%. La PFS mediana è stata di 4,1 mesi e la OS a 1 anno è stata di circa il 60%, leggermente superiore a quella di avelumab come terapia di prima linea, ha spiegato il relatore [1,2]. Gli effetti collaterali indotti dalla terapia si sono verificati nell’81% dei pazienti trattati con avelumab, ma sono stati per lo più lievi (affaticamento, debolezza, prurito). Gli effetti collaterali gravi (per lo più di grado 3 o 4) sono stati documentati nel 14,7% dei partecipanti allo studio.
Nel complesso, la conclusione su avelumab come opzione terapeutica è estremamente positiva. “Possiamo davvero offrire ai pazienti una buona terapia di sistema”, ha riassunto il dottor Wysocki [1]. Il dosaggio consigliato è di 10 mg/kg ogni due settimane. Il trattamento viene somministrato fino alla progressione o alla comparsa di effetti collaterali gravi. “Purtroppo, non esiste ancora un’approvazione per il trattamento adiuvante o neoadiuvante”, ha detto il relatore [1].
Congresso: Swiss Derma Day
Letteratura:
- «Update Merkel cell carcinoma», Dr. med. Anja Wysocki, Swiss Derma Day 12.01.2023
- Becker JC, et al.: S2k-Leitlinie – Merkelzellkarzinom – Update 2022. J Dtsch Dermatol Ges 2023; 21(3): 305–317.
- Gauci ML, et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). Diagnosis and treatment of Merkel cell carcinoma: European consensus-based interdisciplinary guideline – Update 2022. Eur J Cancer 2022; 171: 203–231.
- NCCN Clinical Practice Guidelines in Oncology: Merkel Cell Carcinoma, Version 1.2021 — February 18, 2021, https://merkelcell.org/wp-content/uploads/2021/02/NCCN-2021.pdf, (ultimo accesso 21.03.2023)
- Carrasquillo OY, et al.: Mohs Micrographic Surgery Versus Wide Local Excision in the Treatment of Merkel Cell Carcinoma: A Systematic Review. Dermatol Surg 2022; 48(2): 176–180.
- Informazioni sui farmaci, www.swissmedicinfo.ch,(ultimo accesso 21.03.2023)
- D’Angelo SP, et al: Avelumab in pazienti con carcinoma a cellule di Merkel metastatico precedentemente trattato (JAVELIN Merkel 200): dati aggiornati sulla sopravvivenza globale dopo >5 anni di follow-up. ESMO Open. 2021; 6(6): 10029.
- Kaufman HL, et al: Efficacia aggiornata di avelumab nei pazienti con carcinoma a cellule di Merkel metastatico precedentemente trattato, dopo ≥ 1 anno di follow-up: JAVELIN Merkel 200, uno studio clinico di fase 2. J Immunother Cancer 2018; 6(1): 7.
- D’Angelo SP, et al: Avelumab in prima linea in una coorte di 116 pazienti con carcinoma a cellule di Merkel metastatico (JAVELIN Merkel 200): analisi primaria e dei biomarcatori di uno studio di fase II. J Immunother Cancer 2021; 9(7): e002646.
- Mokánszki A, et al.: Profilazione molecolare del carcinoma a cellule di Merkel associato al Polyomavirus e del melanoma cutaneo. Diagnostica 2021, 11, 212. https://doi.org/10.3390/diagnostics11020212, www.mdpi.com/2075-4418/11/2/212,(ultimo accesso 21.03.2023).
DERMATOLOGIE PRAXIS 2023; 33(2): 45–46
InFo ONKOLOGIE & HÄMATOLOGIE 2023; 11(2): 22–23