L’immunofluorescenza diretta e indiretta sono ancora il gold standard per la rilevazione di anticorpi specifici e autoanticorpi nel pemfigoide bolloso. Gli steroidi topici o i corticosteroidi sistemici altamente efficaci sono raccomandati come terapia di prima linea. In caso di mancata risposta o di controindicazioni, si possono utilizzare farmaci immunomodulatori e immunosoppressivi. Secondo diversi case report, omalizumab e dupilumab hanno dimostrato di essere opzioni di trattamento efficaci e altri biologici sono attualmente in fase di ricerca.
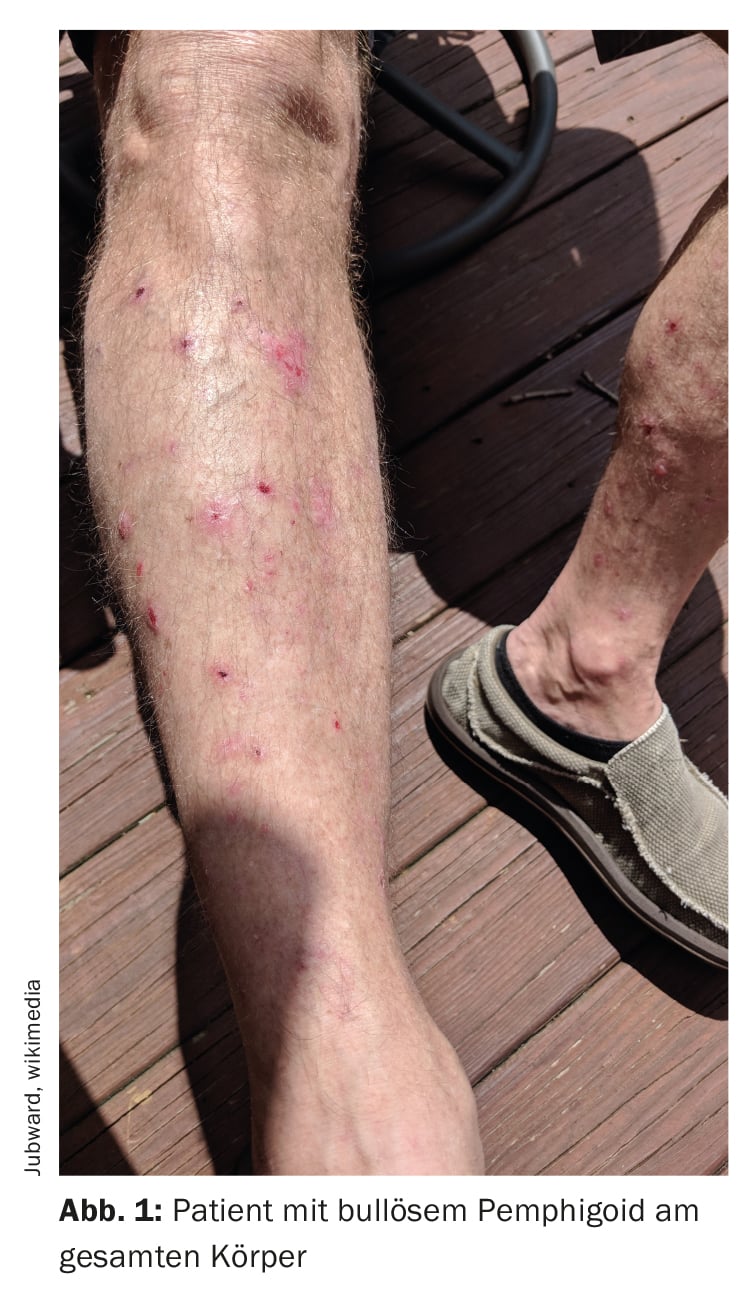
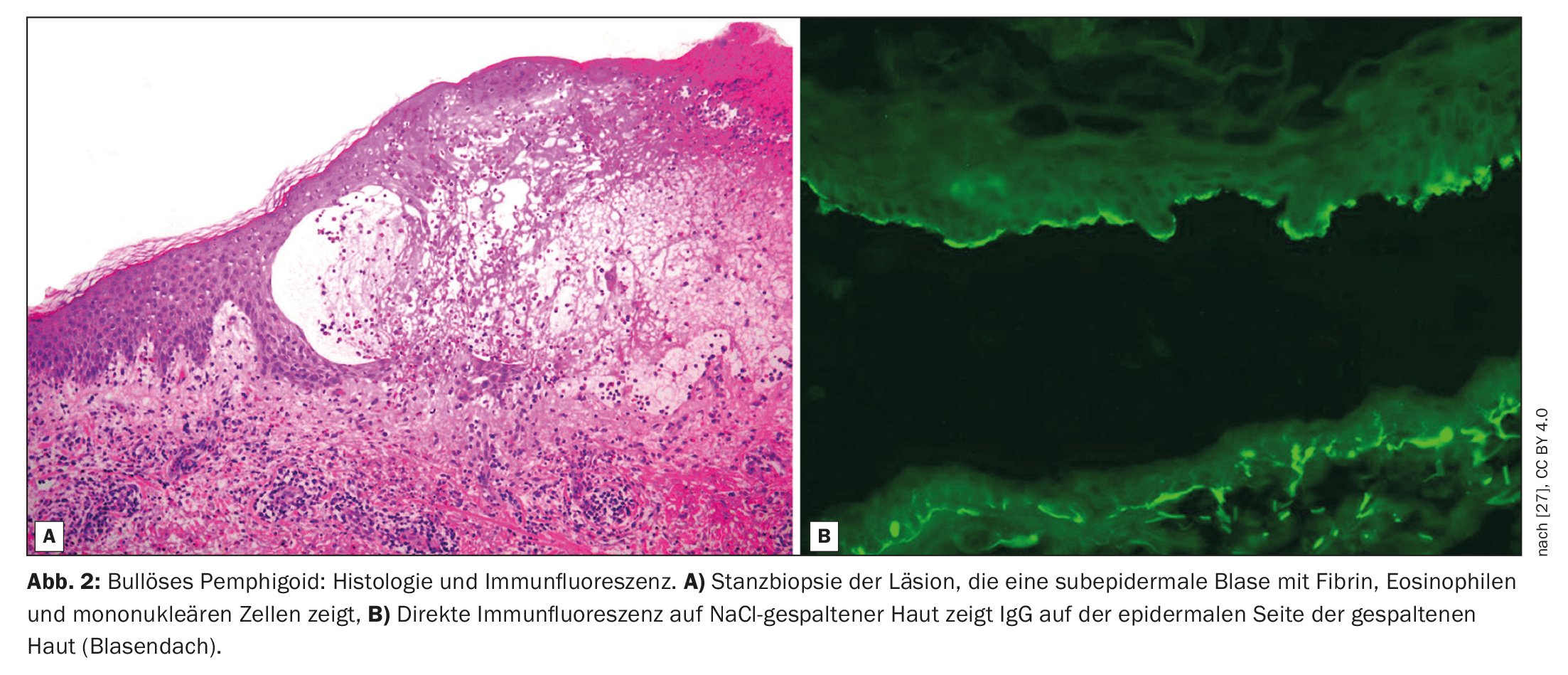
Il pemfigoide bolloso (BP) è caratterizzato da vesciche subepidermiche, cioè vesciche all’interno della zona di giunzione dermoepidermica (Fig. 1, Fig. 2) [1]. Si tratta della dermatosi autoimmune bollosa più comune in Svizzera e in Europa, ha riferito il Prof. Dr. Luca Borradori, Direttore della Clinica e Medico Capo della Clinica Universitaria di Dermatologia dell’Inselspital di Berna [2]. Negli ultimi decenni, è stato osservato un aumento dell’incidenza della BP anche in questo Paese. Tra le possibili cause di questo fenomeno vi sono l’invecchiamento della popolazione, l’associazione con malattie neurologiche sempre più comuni e con alcuni farmaci, nonché una maggiore consapevolezza delle varianti atipiche senza vescicole [28]. Il trattamento della BP mira a tenere sotto controllo la malattia, ad alleviare i sintomi del prurito e a migliorare la qualità di vita delle persone colpite. I metodi di trattamento dipendono principalmente dalla gravità della malattia. Occorre prestare attenzione a un profilo rischio-beneficio favorevole del rispettivo trattamento, dice il Prof. Borradori.
Sospetto clinico di BP: la sierologia fornisce certezza
La diagnosi di BP si basa su una combinazione di diversi criteri, tra cui le caratteristiche cliniche, i risultati al microscopio ottico e il rilevamento degli autoanticorpi nella pelle mediante immunofluorescenza diretta (DIF) [3]. La manifestazione clinica classica della BP è un’eruzione cutanea molto pruriginosa con vesciche generalizzate (vesciche rigonfie e pruriginose di dimensioni variabili, piene di liquido sieroso). Nelle fasi iniziali o nelle varianti atipiche, tuttavia, possono essere presenti solo lesioni escoriate, eczematose o orticarioidi localizzate o generalizzate [4]. Le membrane mucose sono colpite dal 10-30%. Il reperto tipico dell’immunofluorescenza diretta è il rilevamento di immunoglobuline (Ig)G lineari legate alla zona di giunzione dermo-epidermica, più raramente anche IgM e IgA. Questi autoanticorpi legano principalmente le proteine BP180 e BP230, che sono componenti degli emidesmosomi. Questi rappresentano un’importante connessione cellulare e hanno una funzione essenziale per la stabilità meccanica della pelle [1].
Per confermare il sospetto diagnostico di BP, le seguenti fasi di chiarimento diagnostico di laboratorio sono raccomandate nelle linee guida s2K di un gruppo di esperti dell’EADV, aggiornate nel 2022 [3]:
- Rilevamento degli autoanticorpi IgG circolanti contro la zona della membrana basale (BMZ) mediante microscopia a immunofluorescenza indiretta (IIF), utilizzando la pelle umana normale scollata con soluzione di NaCl.
- Rilevazione degli autoanticorpi anti-BP180-NC16A IgG e/o degli autoanticorpi anti-BP230 IgG mediante ELISA (enzyme-linked immunosorbent assay).
- I nuovi test “multivariati” sono consigliati anche per il rilevamento degli autoanticorpi IgG anti-BMZ circolanti. Questi saggi a mosaico BIOCHIP combinano diversi substrati antigenici. Nei rari casi di BP in cui gli anticorpi anti-BMZ circolanti non sono rilevabili né con la microscopia a immunofluorescenza indiretta né con l’ELISA disponibile in commercio, si raccomanda di eseguire ulteriori test per aumentare la sensibilità diagnostica ed escludere altre malattie autoimmuni della giunzione dermo-epidermica (in particolare il pemfigoide anti-P200 o l’epidermolisi bollosa acquisita). Una panoramica dei test corrispondenti si trova nelle linee guida s2K pubblicate in JEADV [3].
Fisiopatologia: sono coinvolti anche meccanismi indipendenti dal complemento.
Le relazioni fisiopatologiche nella BP sono molto complesse [4]. Da un lato, l’attivazione del sistema del complemento con la produzione di anafilatossine e l’attivazione della risposta immunitaria innata con il conseguente reclutamento e l’attivazione di basofili, eosinofili, neutrofili, monociti/macrofagi e mastociti svolgono un ruolo chiave nella BP [5,6, 28-31]. D’altra parte, negli ultimi anni i ricercatori hanno scoperto sempre più meccanismi infiammatori indipendenti dal complemento in relazione agli anticorpi BP. I cheratinociti, in particolare, sembrano essere in grado di secernere un gran numero di citochine proinfiammatorie di rilevanza patogenetica [4,7,32].
Uno studio ha dimostrato che sia la BP-IgG che la BP-IgE sono in grado di legarsi direttamente alla superficie dei cheratinociti umani coltivati, con conseguente perdita di emidesmosomi nella zona della membrana basale [8]. Gli eosinofili sono coinvolti nella patogenesi della BP, mediando gli effetti degli anticorpi IgE anti-BP180 e contribuendo alla separazione dermo-epidermica. In presenza di IgG o IgE, gli eosinofili possono mediare direttamente la separazione dermo-epidermica [9,10]. Freire et al. ha trovato livelli elevati di IgE anti-BP180 e anti-BP230 utilizzando l’ELISA e l’immunofluorescenza rispetto ai controlli sani [11].
Gli autoanticorpi IgE anti-BP180 sono presenti nella maggior parte dei pazienti con BP e i loro livelli sono correlati all’attività della malattia [12–15]. Inoltre, gli studi di immunofluorescenza diretta hanno dimostrato che la maggior parte dei pazienti con BP aveva cellule IgE+ nella pelle, a differenza dei controlli sani. Nel complesso, le prove suggeriscono che esiste un ulteriore percorso indipendente dal complemento, Th2-dipendente e mediato dagli eosinofili, che contribuisce al danno tissutale e alle caratteristiche cliniche nella BP [4].
| “Trattamenti su bersaglio” con monitoraggio dei progressi e follow-up |
| – Il gruppo di esperti dell’EADV raccomanda generalmente una durata del trattamento tra i 9 e i 12 mesi per la BP [3]. |
| – L’interruzione del trattamento è raccomandata nei pazienti che sono stati liberi da sintomi per almeno 1-6 mesi con una terapia minima con prednisone orale (0,1 mg/kg/die), clobetasolo propionato (10 g/settimana) o immunosoppressori. L’interruzione del trattamento è influenzata anche dalle condizioni generali del paziente e dalla presenza di alcune comorbidità. |
| – anti-BP180 ELISA (cioè >27 U/mL come determinato dal test MBL**) e in misura minore gli studi DIF$ hanno riportato un valore predittivo per il verificarsi di una ricaduta dopo l’interruzione del trattamento [24]. Può valere la pena di considerare l’uso di questi test prima di interrompere il trattamento. |
| – Inoltre, occorre prestare attenzione alla possibile insufficienza surrenale causata dall’uso di corticosteroidi esogeni (CS) (anche dopo l’uso di CS topici). |
| Si raccomanda un esame di follow-up nel terzo mese dopo l’interruzione del trattamento. Questo periodo sembra essere sufficiente per riconoscere la maggior parte delle ricadute della BP [24–26]. A prescindere da questo, le recidive di prurito, escoriazioni e/o lesioni cutanee infiammatorie devono sempre essere chiarite da un medico. |
| ** MBL= Laboratori medici e biologici $ DIF=Immunofluorescenza diretta |
Nuove opzioni di trattamento: I biologici come terapia alternativa
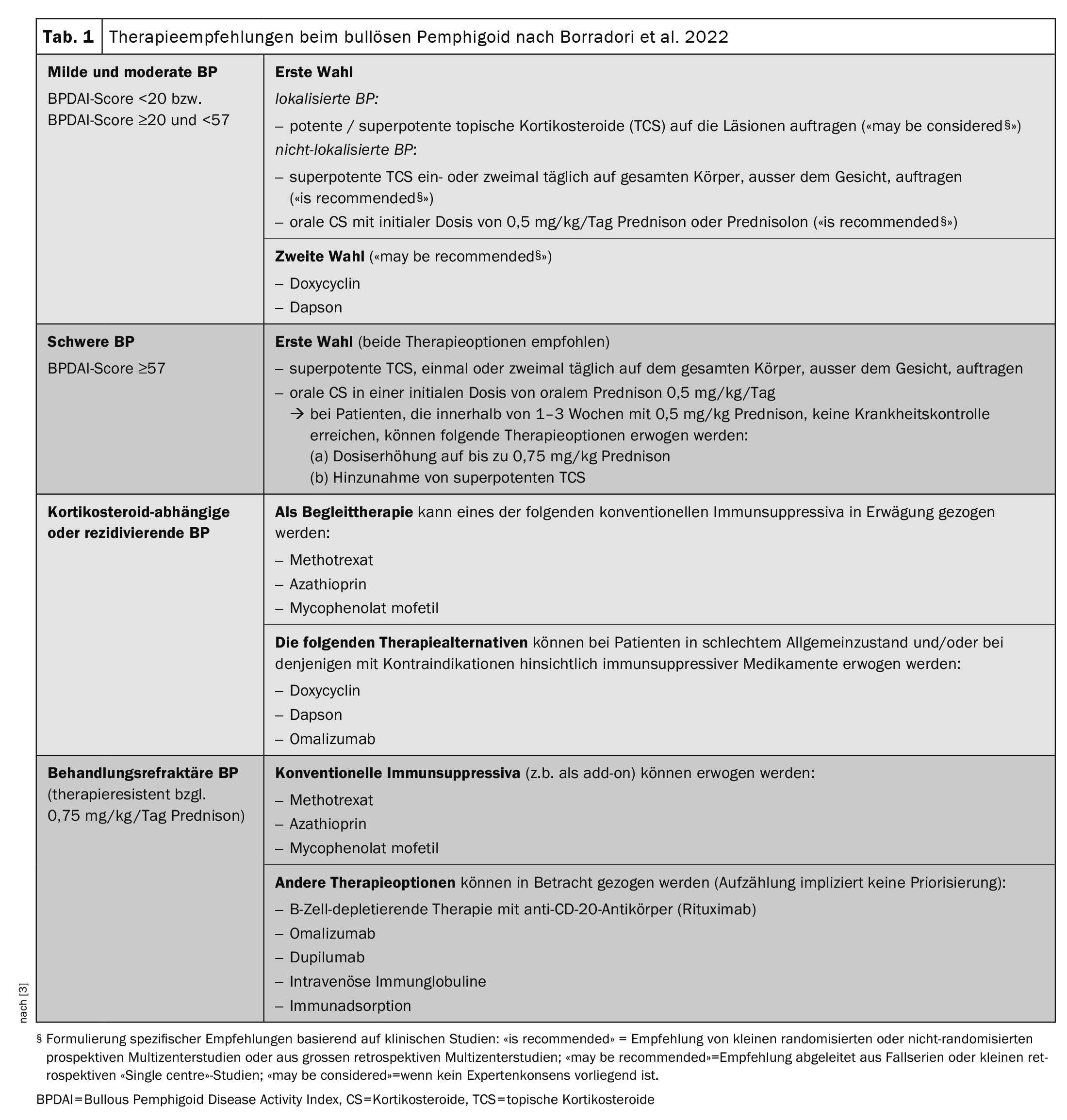
La Tabella 1 [3] offre una panoramica delle opzioni terapeutiche attualmente disponibili. Le linee guida continuano a raccomandare l’uso di corticosteroidi topici superpotenti (TCS) o di steroidi sistemici (prednisolone 0,5 mg/kg/d) come terapia di prima linea. In molti casi, i sintomi possono essere contenuti in questo modo, ma “bisogna avere pazienza”, ha spiegato il Prof. Borradori [2]. La durata stimata del trattamento è di 9-12 mesi. Tuttavia, ci sono anche pazienti per i quali la terapia standard non è efficace o è controindicata. “Abbiamo bisogno di terapie valide, nuove ed efficaci”, ha sottolineato il relatore [2]. L’osservazione che i pazienti con BP hanno spesso livelli elevati di IgE nel siero e autoanticorpi circolanti IgE specifici per BP180 e BP230 supporta l’idea che le IgE giochino un ruolo nella patogenesi della BP [16,17]. L’uso di omalizumab, un anticorpo monoclonale umanizzato che inibisce il legame delle IgE al suo recettore ad alta affinità (FcεRI), è quindi una scelta ovvia. I rapporti sui casi dimostrano che la terapia con omalizumab porta a una forte diminuzione dell’espressione di FcεRI sui basofili circolanti e a una forte riduzione delle cellule FcεRI + nella pelle dei pazienti trattati [16].
Altre terapie biologiche mirate che si sono rivelate promettenti nella BP includono il dupilumab, un anticorpo monoclonale IgG4 umano che si lega alla subunità α del recettore dell’IL-4, inibendo così le vie di segnalazione dell’IL-4/IL-13 [18–21]. “Abbiamo molte serie di casi che dimostrano che dupilumab ha un buon effetto nei pazienti con pemfigoide bolloso”, ha riferito il Prof. Borradori [19,22]. Il biologico si è dimostrato efficace sia come monoterapia che in combinazione con una terapia standard. Dopo il successo dei test clinici di Fase II, l’efficacia e la sicurezza di dupilumab nella BP sono attualmente oggetto di studio nello studio di Fase III LIBERTY-BP (NCT04206553) [23].
Congresso: Formazione avanzata congiunta BE-BS-ZH
Letteratura:
- Diagnosi e trattamento del pemfigo vulgaris/foliaceo e del pemfigoide bolloso, linea guida AWMF S2k 2019, Società Dermatologica Tedesca e.V. (DDG), registro AWMF n.: 013-071.
- “Terapia del pemfigoide bolloso: procedura pratica”, Prof. Dr. Luca Borradori, Formazione continua congiunta delle cliniche dermatologiche di Berna, Basilea, Zurigo, Inselspital di Berna, 25.05.2023.
- Borradori L, et al: Linee guida aggiornate S2 K per la gestione del pemfigoide bolloso avviate dall’Accademia Europea di Dermatologia e Venereologia (EADV). J Eur Acad Dermatol Venereol 2022; 36(10): 1689-1704.
- Cole C, et al: Approfondimenti sulla patogenesi del pemfigoide bolloso: il ruolo dei meccanismi indipendenti dal complemento. Compass Dermatol 2022; 10 (4): 171-180.
- Liu Z, et al: La vescica subepidermica indotta dagli autoanticorpi umani contro il BP180 richiede i giocatori dell’immunità innata in un modello di topo di pemfigoide bolloso umanizzato. J Autoimmun 2008; 31(4): 331-338.
- Liu Z, et al: Sinergia tra una cascata di plasminogeno e MMP-9 nella malattia autoimmune. J Clin Invest 2005; 115(4): 879-887.
- Bao L, et al: La reattività subunità-specifica degli autoanticorpi contro la laminina-332 rivela meccanismi infiammatori diretti sui cheratinociti. Front Immunol 2021; 12: 775412.
- Messingham KN, et al: Effetti FcR-dipendenti degli autoanticorpi IgE e IgG nel pemfigoide bolloso. J I 2011; 187(1): 553-560.
- Ambra KT, et al: Il ruolo degli eosinofili nel pemfigoide bolloso: un modello di sviluppo della patogenicità degli eosinofili nella malattia mucocutanea. Front Med (Lausanne). 2018; 5: 201.
- de Graauw E, et al: Prove di un ruolo degli eosinofili nella formazione di vesciche nel pemfigoide bolloso. Allergia 2017; 72(7): 1105-1113.
- Freire PC, Munoz CH, Stingl G: Autoreattività delle IgE nel pemfigoide bolloso: Eosinofili e mastociti come bersagli principali dei reagenti immunitari patogeni. Br J Dermatol 2017; 177(6): 1644-1653.
- Hashimoto T, et al: Rilevamento di autoanticorpi IgE verso BP180 e BP230 e loro relazione con le caratteristiche cliniche nel pemfigoide bolloso. Br J Dermatol 2017; 177(1): 141-151.
- van Beek N, et al: Correlazione dei livelli sierici di autoanticorpi IgE contro BP180 con l’attività della malattia del pemfigoide bolloso. JAMA Dermatol 2017; 153(1): 30-38.
- Bing L, et al: I livelli di IgE anti-BP180 NC16A non correlano con la gravità della malattia nelle fasi iniziali del pemfigoide bolloso. Arch Dermatol Res 2015; 307(9): 849-854.
- Salz M, et al: Livelli sierici elevati di IL-31 in pazienti con pemfigoide bolloso correlano con il numero di eosinofili e sono associati a BP180-IgE. J Dermatol Sci 2017; 87(3): 309-311.
- Seyed Jafari SM, et al: Effetti di Omalizumab sull’espressione di FcεRI e IgE nella pelle lesionata del pemfigoide bolloso. Front Immunol 2019; 10: 1919.
- Messingham KN, Crowe TP, Fairley JA: L’intersezione tra autoanticorpi IgE ed eosinofilia nella patogenesi del pemfigoide bolloso. Front Immunol. 2019;10: 2331.
- Abdat R, et al: Dupilumab come nuova terapia per il pemfigoide bolloso: una serie di casi multicentrici. J Am Acad Dermatol 2020; 83(1): 46-52.
- Zhang Y, et al: Efficacia e sicurezza di Dupilumab nel pemfigoide bolloso da moderato a grave. Front Immunol 2021; 12: 738907.
- Seyed Jafari SM, et al: Caso clinico: combinazione di Omalizumab e Dupilumab per il pemfigoide bolloso recalcitrante. Front Immunol 2020; 11: 611549.
- Kaye A, et al: Dupilumab per il trattamento del pemfigoide bolloso recalcitrante. JAMA Dermatol 2018; 154(10): 1225-1256.
- Klepper EM, Robinson HN: Dupilumab per il trattamento del pemfigoide bolloso indotto da nivolumab: un rapporto di caso e una revisione della letteratura. Dermatol Online J. 2021; 27(9): 1-6.
- Biblioteca Nazionale di Medicina degli Stati Uniti. Uno studio per valutare l’efficacia e la sicurezza di Dupilumab nei pazienti adulti con pemfigoide bolloso (LIBERTY-BP). Bethesda, MD: US National Library of Medicine (2019).
- Bernard P, et al: Fattori di rischio per la ricaduta nei pazienti con pemfigoide bolloso in remissione clinica: uno studio di coorte prospettico multicentrico. Arch Dermatol 2009; 145: 537-542.
- Joly P, et al: Un confronto tra due regimi di corticosteroidi topici nel trattamento di pazienti con pemfigoide bolloso: uno studio multicentrico randomizzato. J Invest Dermatol 2009; 129: 1681-1687.
- Fichel F, et al: Fattori clinici e immunologici associati alla recidiva di pemfigoide bolloso durante il primo anno di trattamento: uno studio prospettico multicentrico. JAMA Dermatol 2014; 150: 25-33.
- Michelerio A, Tomasini C: Vesciche e milia intorno al catetere per dialisi peritoneale: Un caso di pemfigoide bolloso localizzato. Dermatopatologia 2022; 9(3): 282-286. www. mdpi.com/2296-3529/9/3/33,(ultimo accesso 10/08/2023).
- Holtsche MM, Boch K, Schmidt E: J Dtsch Dermatol Ges 2023; 21(4): 405-413.
- Chen R, et al: J Clin Invest 2001; 108(8): 1151-1158.
- Nelson KC, et al: J Clin Invest 2006; 116(11): 2892-900.
- Leighty L, et al: Arch Dermatol Res 2007; 299(9): 417-422.
- Schmidt E, et al: J Invest Dermatol 2000; 115(5): 842-848.
DERMATOLOGIE PRAXIS 2023; 33(5): 50-52 (pubblicato il 30.10.23, prima della stampa)