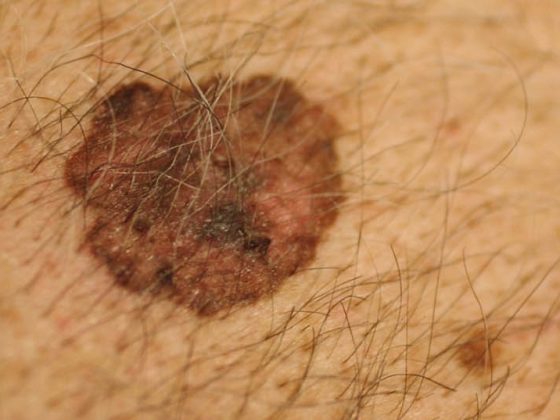
L’incidenza del cancro della pelle bianca è da tre a cinque volte superiore nelle persone infette da HIV. I carcinomi a cellule squamose e a cellule basali si manifestano in età più giovane nelle persone con infezione da HIV, portano più frequentemente a recidive e più spesso alla morte. Il melanoma ha anche un’incidenza leggermente maggiore nelle persone con infezione da HIV. Inoltre, la prognosi è significativamente peggiore rispetto a quella della popolazione normale. Mentre il sarcoma di Kaposi, il linfoma non-Hodgkin e il carcinoma cervicale sono significativamente meno comuni con la HAART, l’incidenza della maggior parte dei tumori non AIDS-defining è aumentata. Oltre al cancro al fegato, il linfoma di Hodgkin e il carcinoma anale in particolare mostrano un forte aumento con la HAART. Anche il tumore della pelle bianca e il melanoma mostrano un aumento, seppur più debole. Un motivo per cui molti tumori aumentano anziché diminuire nel corso della HAART potrebbe essere che i pazienti con HIV sono spesso diagnosticati in giovane età, vivono più a lungo con la HAART e “crescono” nel gruppo a più alto rischio di tumori.
È noto da tempo che i pazienti immunosoppressi, soprattutto quelli sottoposti a trapianto d’organo, sviluppano il cancro della pelle con una frequenza significativamente maggiore rispetto ai pazienti immunocompetenti. Quindi, in questa popolazione, lo spinalioma è 65 volte più comune, il carcinoma basocellulare dieci volte più comune e il melanoma tre volte più comune. Anche il rischio di cancro della pelle aumenta nelle persone con infezione da HIV, anche se non nella stessa misura.
È interessante vedere come la frequenza dei diversi tipi di cancro sia cambiata con la HAART (“terapia antiretrovirale altamente attiva”). Dall’introduzione della HAART, i pazienti sieropositivi hanno una prognosi di sopravvivenza significativamente migliore rispetto al passato. Allo stesso modo, le malattie che definiscono l’AIDS sono diminuite in modo massiccio, tanto che le vediamo molto meno spesso nella pratica quotidiana. Le malattie che definiscono l’AIDS comprendono anche i tumori maligni (“tumori che definiscono l’AIDS”, ADC). Questi includono il sarcoma di Kaposi, il carcinoma cervicale e il linfoma non-Hodgkin ( Tabella 1).

Tuttavia, è stata descritta tutta una serie di altri tumori che si verificano più frequentemente nelle persone con infezione da HIV, i cosiddetti tumori non-AIDS-defining (NADC) (Tab. 2) . Questo include anche il cancro della pelle non melanoma (NMSC). Con questo termine intendiamo il carcinoma a cellule squamose della pelle (spinalioma, carcinoma a cellule fusate) e il carcinoma a cellule basali (basalioma). La malattia di Bowen (intera epidermide) e le cheratosi attiniche (solo strato basale) sono chiamate carcinoma in situ. Altri tumori maligni cutanei sono il rarissimo carcinoma a cellule di Merkel e il melanoma.

Questo rapporto si concentra sull’incidenza e sul cambiamento dei tumori che definiscono l’AIDS e non definiscono l’AIDS, prima e dopo l’era della HAART.
Fatti
In generale, i tumori sono diminuiti in modo significativo con la terapia HAART, ma in media c’è ancora un rischio aumentato da 1,5 a 2 volte rispetto alla popolazione normale.In uno studio francese, sono stati diagnosticati i seguenti tipi di tumore nelle persone con infezione da HIV, con frequenza decrescente: Linfoma non Hodgkin 21,5%, sarcoma di Kaposi 16,0%, cancro ai polmoni 9,4%, cancro anale 8,2%, linfoma di Hodgkin 7,6%, NMSC 6,8% e cancro al fegato 5,6%. I tumori non AIDS-defining hanno rappresentato un totale del 68% di tutti i tumori.
Cancro della pelle bianca (NMSC)
L’incidenza della NMSC è da tre a cinque volte superiore nelle persone infette da HIV. Il rapporto tra il carcinoma basocellulare e il carcinoma a cellule squamose è di 1:7. Questo è in netto contrasto con i pazienti sottoposti a trapianto di rene, dove il rapporto si inverte a 1,8:1. I fattori di rischio per lo sviluppo della NMSC sono gli stessi della popolazione normale, primo fra tutti l’esposizione ai raggi UV. La misura in cui i papillomavirus umani (HPV) contribuiscono allo sviluppo del carcinoma a cellule squamose nelle persone infette da HIV non è chiara. Le NMSC si manifestano chiaramente in età più giovane nelle persone con infezione da HIV, sono più inclini alla recidiva e portano più frequentemente alla morte. La conseguenza di ciò dovrebbe essere un trattamento aggressivo delle lesioni precancerose in questo collettivo.
Melanoma
Il melanoma ha un’incidenza leggermente maggiore nelle persone con infezione da HIV. A seconda della fonte, il rapporto d’incidenza standardizzato (SIR) è compreso tra 1,1 e 2,6. Si discute se questo lieve aumento dell’incidenza possa essere correlato a una maggiore vigilanza dei pazienti nei confronti delle lesioni cutanee o a un controllo medico più intensivo di questi pazienti. Tuttavia, si può affermare che le persone con infezione da HIV e melanoma hanno una prognosi significativamente peggiore rispetto ai pazienti con melanoma nella popolazione normale. Più bassa è la conta delle cellule CD4, peggiore è la prognosi. Tuttavia, la profondità di penetrazione di Breslow, il marcatore prognostico più importante, è indipendente dalla conta delle cellule CD4.
Sarcoma di Kaposi
Il sarcoma di Kaposi è uno dei tumori che definiscono l’AIDS. Si tratta di una proliferazione vascolare. Prima dell’era della HAART, il sarcoma di Kaposi di solito portava alla morte, con una sopravvivenza mediana di 18 mesi, poiché il sarcoma di Kaposi associato all’HIV è una variante aggressiva. Con la HAART, l’incidenza potrebbe essere ridotta in modo massiccio (Tab. 1) . Il sarcoma di Kaposi può colpire non solo la pelle, ma anche gli organi interni. Il responsabile è il virus dell’herpes umano 8 (HHV8). La terapia consiste principalmente nella ricostituzione immunitaria.
Carcinoma anale
Il carcinoma anale è associato all’HPV. L’incidenza è particolarmente elevata negli uomini omosessuali. I fattori di rischio sono una bassa conta di cellule CD4, l’infezione con tipi di HPV ad alto rischio (HPV-16, -18, -31 e -33) e l’infezione con più tipi di HPV. La patogenesi è paragonabile a quella del carcinoma cervicale. Le persone con infezione da HIV, indipendentemente dalle pratiche sessuali, mostrano un aumento da due a sei volte della colonizzazione da HPV nell’area dell’ano rispetto alle persone sieronegative. Gli uomini omosessuali con HIV hanno l’HPV nella zona anale nel 93% dei casi, rispetto al 61% degli uomini omosessuali non infettati dall’HIV.
Linfomi cutanei
I linfomi cutanei hanno un ruolo minore a causa della loro rarità, ma devono essere menzionati qui per completezza. I tipi possibili includono il linfoma cutaneo a grandi cellule T CD30+, la micosi fungoide e la sindrome di Sézary, nonché le forme cutanee del linfoma di Hodgkin.
ADC e NADC nel corso della HAART
La HAART è stata introdotta nel 1996 e ha avuto un impatto importante sullo sviluppo dei vari tumori maligni nelle persone con infezione da HIV. Per esempio, i tumori che definiscono l’AIDS, il sarcoma di Kaposi e il linfoma non-Hodgkin, si verificano in modo massiccio, mentre il carcinoma cervicale è molto meno frequente sotto HAART. Nello Swiss HIV Cohort Study, che ha raccolto dati prospettici sulle persone infette da HIV per oltre 20 anni, il SIR per tutti i tumori che definiscono l’AIDS è sceso da 136 a 14,7.
Al contrario, il SIR per la maggior parte dei tumori non AIDS-defining è aumentato. Oltre al cancro al fegato, il linfoma di Hodgkin e il carcinoma anale in particolare mostrano un forte aumento con la HAART. Anche i tumori della pelle bianca sono aumentati, con un SIR prima della HAART di 1,7 e sotto la HAART di 3,3. Il melanoma mostra un incremento più debole, da 1,2 a 2,0. Tuttavia, anche alcuni tumori non AIDS-defining hanno registrato una diminuzione con la HAART, come il mieloma multiplo (da 14,8 a 5,1) o i tumori della testa e del collo (da 4,3 a 2,2) (Tabella 2).
È interessante confrontare la frequenza dei tumori associati all’HPV tra i riceventi di trapianti d’organo e le persone con infezione da HIV. Nell’ambito dei tumori cutanei, c’è un chiaro aumento di NMSC tra i riceventi di trapianti d’organo, con un SIR di 28. Tra le persone infettate dall’HIV, c’è solo un SIR di 4 I melanomi mostrano una relazione simile, la loro incidenza è appena aumentata nelle persone infette da HIV, ma raddoppiata o triplicata nei pazienti sottoposti a trapianto di organi. Nel caso del carcinoma anale, i rapporti sono invertiti: in questo caso, le persone infette da HIV mostrano un SIR di 28, mentre i pazienti con trapianto d’organo mostrano un SIR di 5 Inoltre, non sono inclusi altri tumori indotti da virus, dovuti a infezioni da HHV8, virus di Epstein-Barr (EBV) o virus dell’epatite B o dell’epatite B (EBV). C, più frequentemente nelle persone infette da HIV che nei riceventi di trapianti d’organo.
Discussione
La ragione esatta del parziale aumento del rischio di cancro nelle persone con infezione da HIV non è ancora chiara. È noto che le linfopenie CD4 in genere aumentano il rischio di cancro. Con la HAART, i pazienti vivono molto più a lungo anche con una bassa conta di cellule CD4. In questo contesto, è interessante notare che la durata della malattia da HIV – ma non la gravità – aumenta il rischio di cancro. C’è anche una disfunzione delle cellule CD4 e CD8, che porta a una diminuzione della sorveglianza immunologica del tumore. I virus oncogeni come HHV8, HPV, EBV o il virus linfotropico delle cellule T umane (HTLV1/2) possono proliferare più facilmente. Inoltre, l’infezione da HIV determina una predominanza di citochine Th2. Questo ha un’influenza consecutiva su angiogenesi, apoptosi, presentazione dell’antigene, evasione immunitaria e trascrizione di vari oncogeni.
Inoltre, alcune proteine dell’HIV svolgono un ruolo nello sviluppo di alcuni tumori maligni. Quindi, l’HIV può avere effetti diretti a livello cellulare o addirittura genico. L’HIV può attivare i protooncogeni, interferire con il ciclo cellulare, inattivare i geni soppressori del tumore (ad esempio, p53) e contribuire alla stabilizzazione o all’alterazione dei geni.
Perché molti tumori aumentano e non diminuiscono con la HAART?
È interessante notare che le NADC sono in aumento solo tra i caucasici, non tra gli africani neri o altri gruppi etnici. Tuttavia, potrebbe esserci un pregiudizio in questo caso, in quanto la qualità dei rapporti sul cancro potrebbe essere diversa. Va inoltre notato che questo aumento è stato osservato solo tra gli uomini infetti da HIV, non tra le donne infette da HIV. Il fattore di rischio maggiore, come nella popolazione normale, è l’età. Il fatto che la maggior parte dei pazienti con infezione da HIV siano giovani, che vivano significativamente più a lungo con la HAART e che quindi “crescano” in un gruppo a rischio più elevato, rende comprensibile che alcuni tumori, che si manifestano per lo più in età avanzata, aumentino durante il corso della HAART, o nonostante la HAART. Soprattutto nel caso di NMSC come lo spinalioma, questo è probabilmente il fattore decisivo, a causa dell’aumento della dose cumulativa di UV ad un’età superiore. Non è stata trovata alcuna correlazione tra i fattori istologicamente sfavorevoli (né nel carcinoma basocellulare né nello spinalioma) e la conta delle cellule CD4, la viremia HIV, la durata della HAART, la durata della malattia da HIV o il nadir dei CD4.
Si ipotizza anche che le persone con infezione da HIV abbiano una maggiore tolleranza al rischio e forse anche uno stile di vita diverso (più malsano). La misura in cui la terapia vera e propria ha un’influenza negativa non è ancora stata chiarita in modo definitivo. Alcuni farmaci anti-HIV sono almeno fotosensibilizzanti.
Prospettiva
Sono stati proposti programmi di screening per alcuni ADC e NADC (carcinoma anale, carcinoma del collo dell’utero, carcinoma mammario, carcinoma del colon-retto, carcinoma epatico e carcinoma della prostata). Ad oggi, non esiste alcuna raccomandazione per lo screening dei tumori della pelle. Anche se i tumori della pelle non sono così comuni nelle persone con infezione da HIV, si manifestano in età più giovane, il che giustificherebbe un programma di screening per analogia con i riceventi di trapianti di organi.
Letteratura:
- Franceschi S, et al: Br J Canc 2010; 103: 416-422.
Ulteriori letture:
- Wilkins K, et al: J Am Acad Dermatol 2006; 54: 189-206.
- Deeken JF, et al: CID 2012; 55(9): 1228-1235.
- Grulich AE, et al: Lancet 2007; 370: 59-67.
- Silverberg MJ, et al: J Natl Cancer Inst 2013; 105: 350-360.
- Guiguet M, et al: Lancet Oncol 2009; 10: 1152-1159.
- Lanoy E, et al: Int J Cancer 2011; 129: 467-475.
- Schulz TF: Int J Cancer 2009; 125(8): 1755-1763.
- Garlassi E, et al: J Acquir Immune Defic Syndr 2012; 60(2): e63-65.
- Hofbauer GFL, et al: Swiss Med Wkly 2009; 139(29-30): 407-415.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(11-12): 25-27
PRATICA DERMATOLOGICA 2016; 26(5): 12-14