L’intolleranza all’istamina è un’intolleranza alimentare che comporta una serie di reazioni avverse come risultato dell’istamina accumulata o ingerita. È causata da uno squilibrio tra l’istamina rilasciata dal cibo e la capacità dell’organismo di scomporre questa quantità. Rilevare un hit, tuttavia, non è così facile.
Una scomposizione disturbata dell’istamina può portare a numerosi problemi. L’intolleranza all’istamina (HIT) è quindi diventata oggetto di una crescente attenzione da parte del pubblico negli ultimi anni. Per i medici, spesso si pone la domanda se o quando questa condizione debba essere presa sul serio. HIT è il nome di un’intolleranza alimentare che comprende una serie di reazioni avverse come risultato dell’istamina accumulata o ingerita. È accompagnata da una riduzione dell’attività dell’enzima DAO, che porta ad un aumento della concentrazione di istamina nel plasma e alla comparsa di reazioni avverse [1]. La HIT deve essere distinta dall’intossicazione da istamina, chiamata anche sindrome scrombroidale, scombroidosi o avvelenamento da istamina. Il termine deriva dal nome della famiglia degli sgombri (Scombridae), dopo il cui consumo l’intossicazione è stata osservata con maggiore frequenza. La famiglia degli Scombridae comprende il tonno, l’aringa e lo sgombro. L’avvelenamento da istamina è considerato uno dei più comuni avvelenamenti a livello mondiale causati dal consumo di pesce [2]. Nella HIT, la quantità di istamina assorbita è molto più bassa rispetto all’avvelenamento da istamina. Le manifestazioni della HIT sono anche più lievi rispetto all’intossicazione.
Aspetto eterogeneo
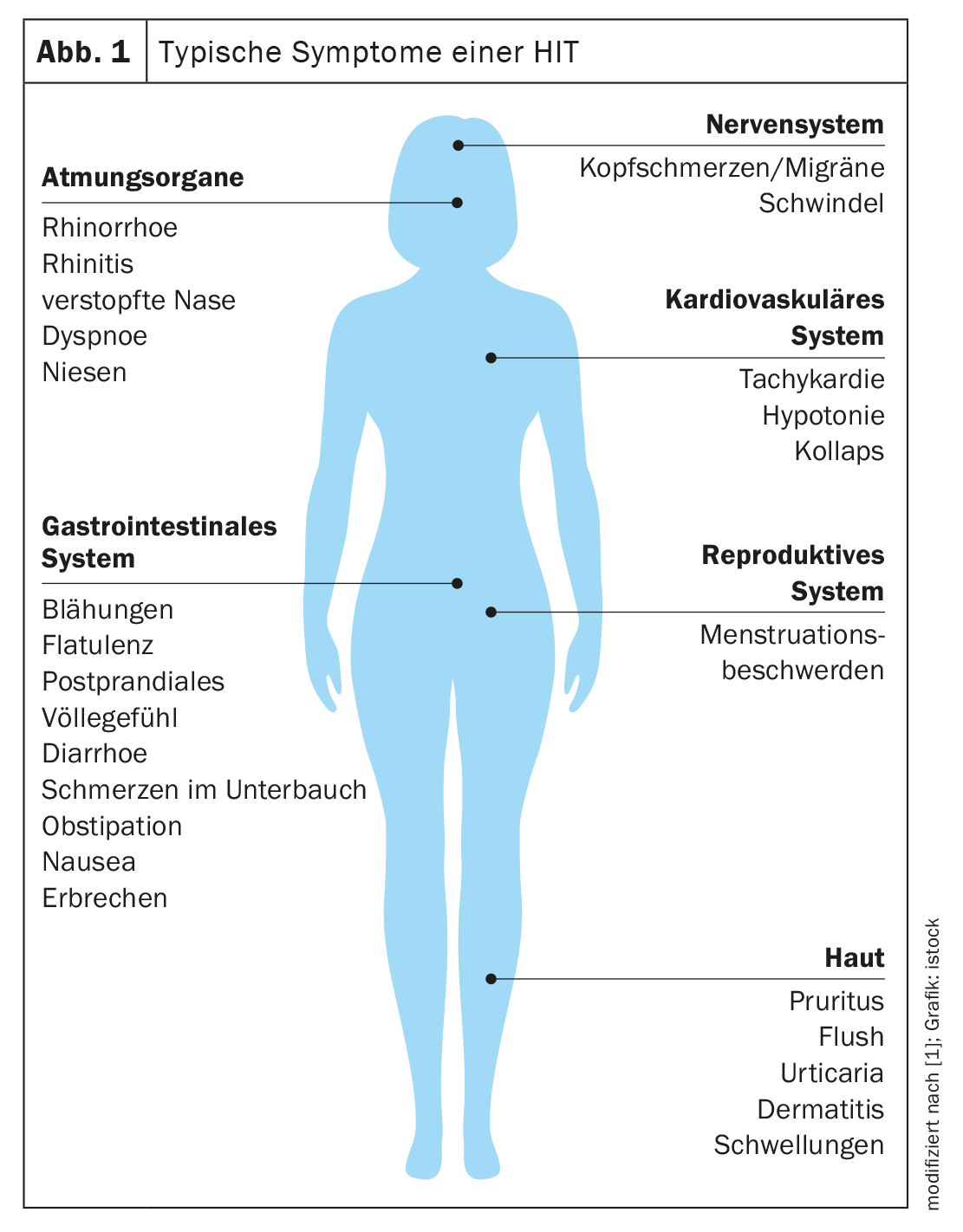
Le manifestazioni della HIT possono essere causate da diversi meccanismi fisiopatologici o da una loro combinazione. I sintomi complessi si basano sul fatto che i recettori dell’istamina si trovano in molti organi del corpo [1]. Questo dimostra un’elevata diversità, ma anche un’incoerenza delle manifestazioni in una stessa persona dopo stimoli simili. I segni tipici sono i sintomi cutanei, ad esempio arrossamento del viso (flush), prurito o eruzione orticaria sul corpo. I sintomi gastrointestinali includono diarrea, ma anche costipazione e dolore addominale. Si osservano manifestazioni nel sistema cardiovascolare, come pressione bassa e tachicardia, oltre a disturbi nel sistema nervoso e respiratorio. Questi includono mal di testa, emicrania e vertigini (Fig. 1) [1,3].
Contenuto di istamina nel corpo
La comparsa dei sintomi dipende dal contenuto di istamina nel corpo. L’istamina si forma in modo endogeno e viene immagazzinata prevalentemente nei mastociti e nei basofili. Mastociti, basofili, cellule simil-enterocromaffini dello stomaco e neuroni istaminergici sono le fonti cellulari di istamina meglio descritte. Ma anche altri tipi di cellule, ad esempio le piastrine, le cellule dendritiche (DC) e le cellule T, possono esprimere l’istidina decarbossilasi (HDC) dopo la stimolazione. L’espressione di HDC e il rilascio di istamina sono influenzati da citochine come IL-1, IL-3, IL-12, IL-18, GM-CSF, fattore di stimolazione delle colonie macrofagiche e fattore di necrosi tumorale (TNF)-α 1, 11, 12 [4].
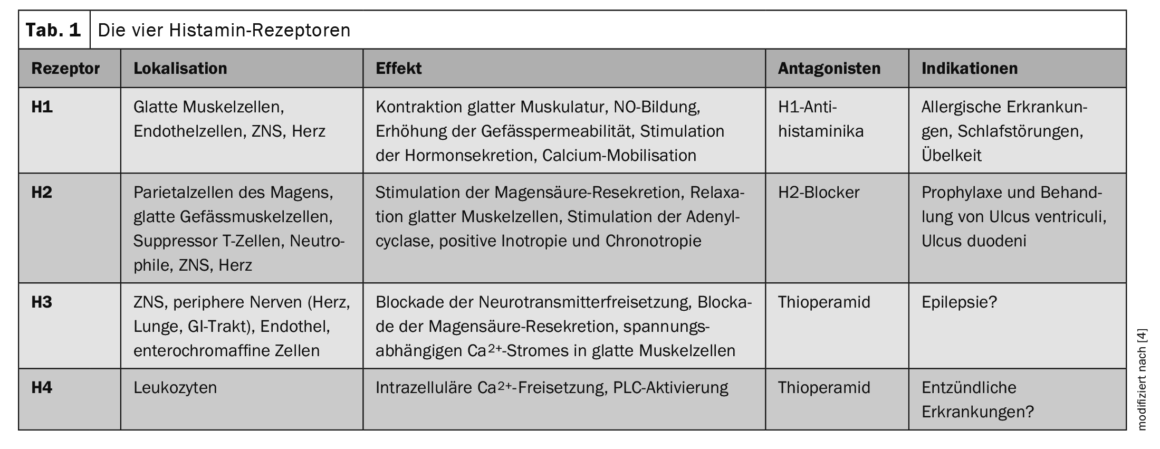
L’istamina influisce sull’intero spettro di funzioni fisiologiche di vari tessuti e cellule, compresa l’immunità [1,4]. Da un punto di vista chimico, si tratta di un’ammina biogena ubiquitaria. Nell’organismo, la sua sintesi è assicurata dalla decarbossilazione dell’aminoacido L-istidina da parte dell’enzima L-istidina decarbossilasi. L’istamina agisce nell’organismo come agonista dei recettori dell’istamina H1, H2, H3 e H4 [1]. I diversi effetti dipendono dai sottotipi di recettori e dalla loro diversa espressione (Tab. 1) [4]. I recettori H1 e H2 sono presenti in modo ubiquitario, mentre l’H2 è presente soprattutto nel tratto digestivo (stomaco, duodeno, intestino tenue). I recettori H3 sono abbondanti nel sistema nervoso e i recettori H4 in alcuni tessuti (pelle, tonsille), ma in piccole quantità.
I recettori H1 sono quelli meglio studiati. Sono espressi in molte cellule, tra cui i mastociti, e sono coinvolti nelle reazioni di ipersensibilità di tipo 1. Simile a H1R, H2R è espresso in una varietà di tessuti e cellule, tra cui il cervello, le cellule parietali gastriche, le cellule muscolari lisce, le cellule T e B e il tessuto cardiaco. L’H2R può modulare una serie di attività del sistema immunitario, come la degranulazione dei mastociti, la sintesi degli anticorpi, la produzione di citochine e la polarizzazione dei linfociti T. H3R è un autorecettore presinaptico nel sistema nervoso periferico e centrale e ha dimostrato di essere coinvolto nel ritmo sonno-veglia, nella cognizione, nella regolazione omeostatica dei livelli energetici e nell’infiammazione. L’H4R è il recettore scoperto più di recente e condivide alcune proprietà molecolari e farmacologiche con l’H3R. Tuttavia, a differenza di H3R, H4R è espresso da una varietà di cellule, tra cui cheratinociti, cellule di Langerhans, DC, neutrofili e linfociti [4].
Degradazione dell’istamina
L’istamina viene degradata tramite deaminazione ossidativa (diamina ossidasi, DAO) o tramite metilazione dell’anello (istamina N-metiltransferasi, HNMT) [5]. La DAO è immagazzinata in strutture vescicolari associate alla membrana plasmatica nelle cellule epiteliali e viene secreta nel flusso sanguigno dopo la stimolazione. L’istamina N-metiltransferasi, invece, è un enzima citosolico che può convertire l’istamina solo nello spazio intracellulare. L’istamina N-metiltransferasi è ampiamente distribuita nei tessuti umani. L’espressione più forte si trova nel rene e nel fegato, seguita da milza, colon, prostata, ovaie, cellule del midollo spinale, bronchi e trachea. L’istamina N-metiltransferasi è quindi considerata anche l’enzima chiave per la degradazione dell’istamina nell’epitelio bronchiale [4,6]. L’espressione di DAO nei mammiferi, invece, è limitata a tessuti specifici come l’intestino tenue, il colon, la placenta e il rene [5]. La funzione fisiologica dell’enzima DAO comprende la regolazione dei processi infiammatori, della proliferazione, delle reazioni allergiche e dell’ischemia [1]. L’effetto della DAO può essere inibito dall’alcol e dai farmaci.
Diagnostica multidisciplinare
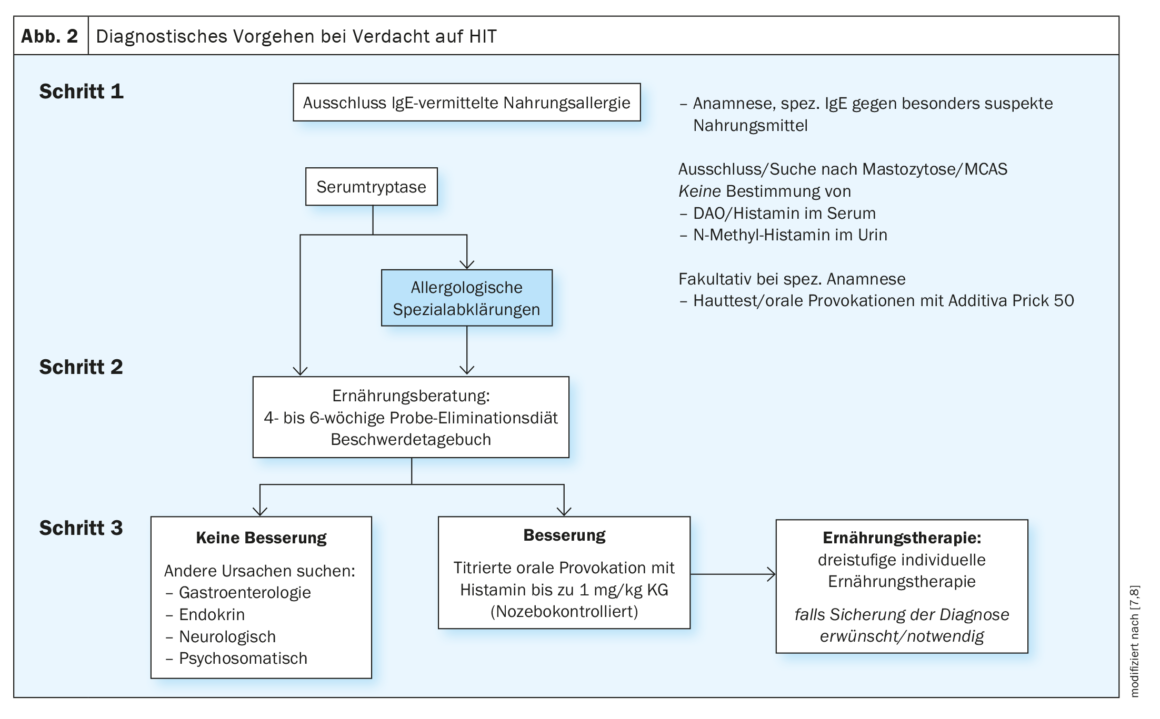
La diagnosi di HIT richiede un approccio multidisciplinare complesso e lungo, che comprende l’eliminazione sistematica delle malattie con sintomi simili (Fig. 2) [7,8]. Mancano criteri diagnostici o marcatori specifici per la HIT. Si ritiene che la manifestazione dei sintomi della HIT abbia origine da una ridotta concentrazione/attività della DAO. Questo potrebbe essere la base per misurare la concentrazione o l’attività di questo enzima per la diagnosi di HIT. Il problema, tuttavia, è che non è ancora stato stabilito un valore di riferimento per i livelli sierici di DAO. Inoltre, il livello di DAO misurato e/o l’attività di DAO nel siero possono differire dall’attuale livello/attività funzionale di DAO nella mucosa intestinale. Attualmente, una misura ragionevole è quindi l’esclusione di un’allergia effettiva IgE-mediata, se i disturbi possono essere collegati a un alimento specifico. Con l’aiuto dei test cutanei, della diagnosi molecolare di allergia e, se necessario, dei test di provocazione orale per gli additivi alimentari spesso sospettati dai pazienti, è possibile effettuare un chiarimento allergologico fondato. In una seconda fase, si deve considerare una mastocitosi sottostante. In questo caso, la determinazione della triptasi sierica può fornire indicazioni. Anche la determinazione della mutazione c-Kit nel sangue periferico o un esame del midollo osseo possono essere utili. La diagnosi di sindrome da attivazione dei mastociti (MCAS), a sua volta, si basa sulla risposta ai bloccanti H1R e su un aumento significativo della triptasi sierica nell’attacco. Se queste misure non portano ancora a un quadro chiaro, è necessario consultare un nutrizionista esperto in allergie. Un miglioramento dei sintomi con la riduzione dell’istamina parla di una HIT, almeno come co-fattore. Tuttavia, se non c’è o quasi nessun miglioramento evidente, sono indicati ulteriori accertamenti. Questo può essere titolato con provocazione orale di istamina, idealmente in doppio cieco e controllato con placebo, con parametri clinicamente definiti come endpoint. In questo caso, l’istamina viene aggiunta in fasi di titolazione crescenti, in quantità fino a 75 mg – comprese le dosi placebo. Questo dovrebbe essere fatto nell’ambito di una degenza ospedaliera, in combinazione con una dieta appropriata, una consulenza nutrizionale e, se necessario, con altri specialisti di allergologia, dermatologia e psicosomatica. In Svizzera, questo viene offerto dalla Clinica di alta montagna Davos-Wolfgang(www.hochgebirgsklinik.ch) come parte di un ricovero di alcuni giorni. In molti casi, è necessario effettuare anche un esame gastroenterologico dettagliato per i disturbi gastrointestinali più frequenti. Ma anche le malattie ormonali o neurologiche dovrebbero essere prese in considerazione, a seconda dei sintomi. Raramente si possono escludere completamente anche i disturbi psicosomatici, sia come causa primaria che come conseguenza della costante insicurezza nel mangiare.
Poiché i recettori dell’istamina (H1, H2 e soprattutto H3) sono presenti sia nel sistema nervoso periferico che in quello centrale, l’istamina ha anche un elevato impatto sugli aspetti neuropsicologici. Inoltre, la N-metniltransferasi svolge un ruolo essenziale nella degradazione dell’istamina nel sistema nervoso centrale; pertanto, oltre all’emicrania già menzionata, anche altre malattie come il morbo di Parkinson, l’ADHD o la miastenia grave sono associate a un’alterata funzione di questo enzima. Poiché diversi farmaci, come la clorchina, inibiscono la N-metiltransferasi, gli effetti neuropsicologici e i sintomi dell’istamina possono essere intensificati dai farmaci corrispondenti [9,10].
Il fatto che possano essere coinvolti fattori psicosomatici è dimostrato anche dal fatto che nelle provocazioni controllate con placebo, una percentuale non trascurabile di pazienti sperimenta sintomi simili a quelli causati dall’ingestione di prodotti contenenti istamina, anche in risposta al solo placebo. L’aspettativa che gli alimenti ricchi di istamina scatenino i disturbi può anche essere “bruciata” mentalmente – soprattutto se questa esperienza è stata fatta più volte. Poiché i fattori che influenzano la degradazione dell’istamina, come il microbioma, possono cambiare, un tentativo graduale di alleggerire le misure dietetiche è certamente giustificato, soprattutto con la consulenza di un nutrizionista esperto.
Gestione terapeutica della HIT
Tra gli approcci terapeutici, il gold standard è una dieta a basso contenuto di istamina. Una buona risposta a tale dieta è considerata una conferma della HIT. Oltre alle misure dietetiche, l’integrazione di DAO, che favorisce la scomposizione dell’istamina ingerita, può essere presa in considerazione come trattamento aggiuntivo per i soggetti con carenza di DAO intestinale. Può essere utile anche l’uso di antistaminici mirati all’H1R.
Dieta a basso contenuto di istamina: il principio della dieta a basso contenuto di istamina consiste nel selezionare gli alimenti che non dovrebbero contenere quantità eccessive di istamina o ammine biogene. Si divide in tre fasi: Karenzphase, Testphase e Dauerernährung. Nella prima fase, gli alimenti che tipicamente contengono un’elevata quantità di istamina devono essere completamente esclusi. Ci sono grandi differenze tra gli studi sui tipi di alimenti che dovrebbero essere evitati durante la dieta di eliminazione. Alcuni degli alimenti esclusi di routine contengono solo piccole quantità di ammine biogene e sono chiamati rilasciatori di istamina [11]. L’attenzione dovrebbe concentrarsi su una dieta mista di verdure per dieci giorni o tre settimane, con alimenti consumati il più possibile freschi. Dopodiché, segue la fase di prova per circa sei settimane, durante le quali gli alimenti sospetti vengono reintrodotti in modo specifico. Nella fase di nutrizione permanente, si deve ricorrere a eliminazioni individuali per ottenere una nutrizione che soddisfi le esigenze del paziente, mantenendo un’alta qualità di vita. Spesso le persone colpite traggono già beneficio modificando la combinazione dei principali gruppi alimentari proteine, grassi, carboidrati e/o modificando la struttura dei pasti.
Integrazione di DAO: analogamente all’uso dell’integrazione di lattasi per l’intolleranza al lattosio, è stata sviluppata la somministrazione esogena dell’enzima DAO per la HIT [1]. Un estratto di rene di maiale contenente 0,3 mg di enzima DAO può essere somministrato come alimento per scopi medici speciali. La dose massima giornaliera dell’enzima ingerito esogenamente è di 3× 0,3 mg, che corrisponde a 0,9 mg di DAO. La pratica clinica ha dimostrato che l’integrazione esogena di DAO può migliorare significativamente i sintomi in alcuni pazienti. Si può prendere in considerazione anche un’integrazione con vitamina C (100-1000 mg al giorno), vitamina B6 o rame, in quanto queste sostanze favoriscono la scomposizione dell’istamina tramite DAO o HNMT.
Antistaminici: il trattamento dei pazienti con antistaminici è empirico. Non esistono studi clinici randomizzati che dimostrino il contributo di questa terapia nella HIT. Tuttavia, considerando l’efficacia e la sicurezza, gli antistaminici H1 di seconda o terza generazione dovrebbero avere la precedenza. I bloccanti H2 potrebbero essere utilizzati nei pazienti con sintomi gastrointestinali dominanti. Il trattamento con antistaminici dovrebbe essere intenzionale e limitato nel tempo, e dovrebbe aiutare a capire se il blocco dei recettori H1/H2 attenua le manifestazioni. Di conseguenza, possono essere utilizzati anche come test terapeutico-diagnostico [1].
Conclusione
La HIT è una serie di disturbi diversi che si verificano dopo il consumo di alimenti ricchi di istamina. Le manifestazioni possono essere causate da diversi meccanismi fisiopatologici o da una loro combinazione. La diagnosi di HIT richiede quindi un approccio multidisciplinare complesso e lungo, che comprende l’eliminazione sistematica delle malattie con sintomi simili. Una dieta a basso contenuto di istamina è attualmente una misura diagnostica e terapeutica adeguata (ma non l’unica). Oltre alle misure dietetiche, l’integrazione orale di DAO e l’uso di antistaminici mirati all’H1R possono essere efficaci [12].
Messaggi da portare a casa
- La HIT è un’intolleranza alimentare che comporta una serie di reazioni avverse come risultato dell’istamina accumulata o ingerita.
- È causata da uno squilibrio tra l’istamina rilasciata dal cibo e la capacità dell’organismo di scomporre questa quantità.
- I sintomi variano da disturbi gastrointestinali, starnuti, difficoltà respiratorie, vampate di calore e prurito a mal di testa o vertigini.
- La diagnosi deve essere fatta in modo multidisciplinare e la diagnosi sistematica deve essere fatta in base a una serie di criteri.
Includere l’eliminazione delle malattie con sintomi simili. - Una dieta graduale a basso contenuto di istamina, l’integrazione orale di DAO e la somministrazione di antistaminici mirati all’H1R possono aiutare ad alleviare i sintomi nei pazienti con HIT.
Letteratura:
- Hrubisko M, Danis R, Huorka M, Wawruch M: Histamine Intolerance – The More We Know the Less We Know. A Review. Nutrients 2021; 13(7): 2228.
- Colombo FM, Cattaneo P, Confalonieri E, Bernardi C: Histamine food poisonings: A systematic review and meta-analysis. Crit Rev Food Sci Nutr 2018; 58: 1131–1151.
- Reese I, Ballmer-Weber B, Beyer K, et al.: German guideline for the management of adverse reactions to ingested histamine. Allergologie 2021; 10:761-772.
- Smolinska S, et al.: Histamine and gut mucosal immune regulation. Allergy 2014; 69(3): 273-81.
- Klocker J, Matzler SA, Huetz GN, et al.: Expression of histamine degrading enzymes in porcine tissues. Inflamm Res 2005; 54(Suppl 1): S54–S57.
- Yamauchi K, Sekizawa K, Suzuki H, et al.: Structure and function of human histamine N-methyltransferase: critical enzyme in histamine metabolism in airway. Am J Physiol 1994; 267(3 Pt 1): L342–L349.
- Reese I, et al.: Guideline on management of suspected adverse reactions to ingested histamine: Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergology and Environmental Medicine (GPA), the Medical Association of German Allergologists (AeDA) as well as the Swiss Society for Allergology and Immunology (SGAI) and the Austrian Society for Allergology and Immunology (ÖGAI). Allergol Select 2021; 5: 305–314.
- Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D: Food Intolerances. Nutrients 2019; 11(7): 1684.
- Sergeeva OA, Klyuch BP, Fleischer W, et al.: P2Y receptor-mediated excitation in the posterior hypothalamus. Eur J Neurosci. 2006 Sep; 24(5): 1413–1426.
- Yoshikawa T, Nakamura T, Yanai K. Histamine N-Methyltransferase in the Brain. Int J Mol Sci. 2019 Feb 10;20(3): 737.
- Sánchez-Pérez S, Comas-Basté O, Veciana-Nogués M, et al.: Low-histamine diets: Is the exclusion of foods justified by their histamine content? Nutrients 2021; 13: 1395.
- Schmid-Grendelmeier P , Gianelli D, Gutzweiler JP, et al.: Histaminintoleranz – zwischen Mythen und Fakten. Schweizer Zeitschrift für Ernährungsmedizin 2022; 2: 10–15.
InFo NEUROLOGIE & PSYCHIATRIE 2023; 21(3): 6–10