Studi come CESAR o SHOCK II, ma anche l’ulteriore sviluppo di pompe, ossigenatori e tubi di perfusione hanno contribuito al fatto che la terapia con ECMO ed ECLS è diventata molto più importante. Queste procedure rappresentano una sfida per il team di trattamento interdisciplinare.
ECMO è l’acronimo di “ossigenazione extracorporea a membrana” e si riferisce a una pompa centrifuga extracorporea con un ossigenatore che viene collegato alla circolazione del paziente tramite un sistema di tubi. Si fa una distinzione tra l’ECMO veno-venoso, che viene utilizzato nell’insufficienza respiratoria acuta, e l’ECMO veno-arterioso, che viene utilizzato nei pazienti con shock cardiogeno acuto. Recentemente, la nomenclatura è stata specificata nella denominazione ECMO per la configurazione veno-venosa (vv) ed ECLS (“Extracorporeal Life Support”) per la configurazione veno-arteriosa (va).
La terapia con ECMO/ECLS ha acquisito rapidamente importanza negli ultimi anni. Questo è stato inizialmente dovuto ai risultati pubblicati nello studio CESAR, che ha dimostrato che i pazienti con sindrome da distress respiratorio acuto (ARDS) trattati con ECMO venovenoso presentavano un vantaggio in termini di sopravvivenza e qualità di vita rispetto ai pazienti che ricevevano la sola terapia di ventilazione mirata all’ARDS [1]. Anche l’impianto di vaECLS nello shock cardiogeno ha registrato una straordinaria impennata. Da un lato, ciò è dovuto ai progressi tecnici nelle pompe, negli ossigenatori e nei tubi di perfusione. D’altra parte, lo studio SHOCK II, che non è riuscito a dimostrare un beneficio di sopravvivenza nello shock cardiogeno con l’uso della pompa a palloncino intra-aortica (IABP) [2], ha aperto la strada all’uso della vaECLS.
La gestione dei pazienti sottoposti a vvECMO o vaECLS è particolarmente impegnativa. L’impianto del sistema e il successivo trattamento del paziente richiedono un team interdisciplinare e multiprofessionale, che comprende intensivisti, cardiochirurghi, cardiologi e pneumologi, oltre a perfusionisti e infermieri di terapia intensiva.
Incannulamento e configurazione di vvECMO e vaECLS
Come procedura per l’insufficienza respiratoria acuta, l’ECMO viene impiantato in una configurazione veno-venosa (Fig. 1). Per il drenaggio venoso, viene inserita una cannula nella vena femorale comune (VFC). La punta della cannula viene posizionata sotto controllo ecocardiografico in modo che si trovi all’ingresso della vena cava inferiore (VCI) nell’atrio destro. Una cannula viene inserita nella vena giugulare interna (VJI) per fornire il sangue ossigenato. La punta della cannula si trova nella vena cava superiore (VCS).
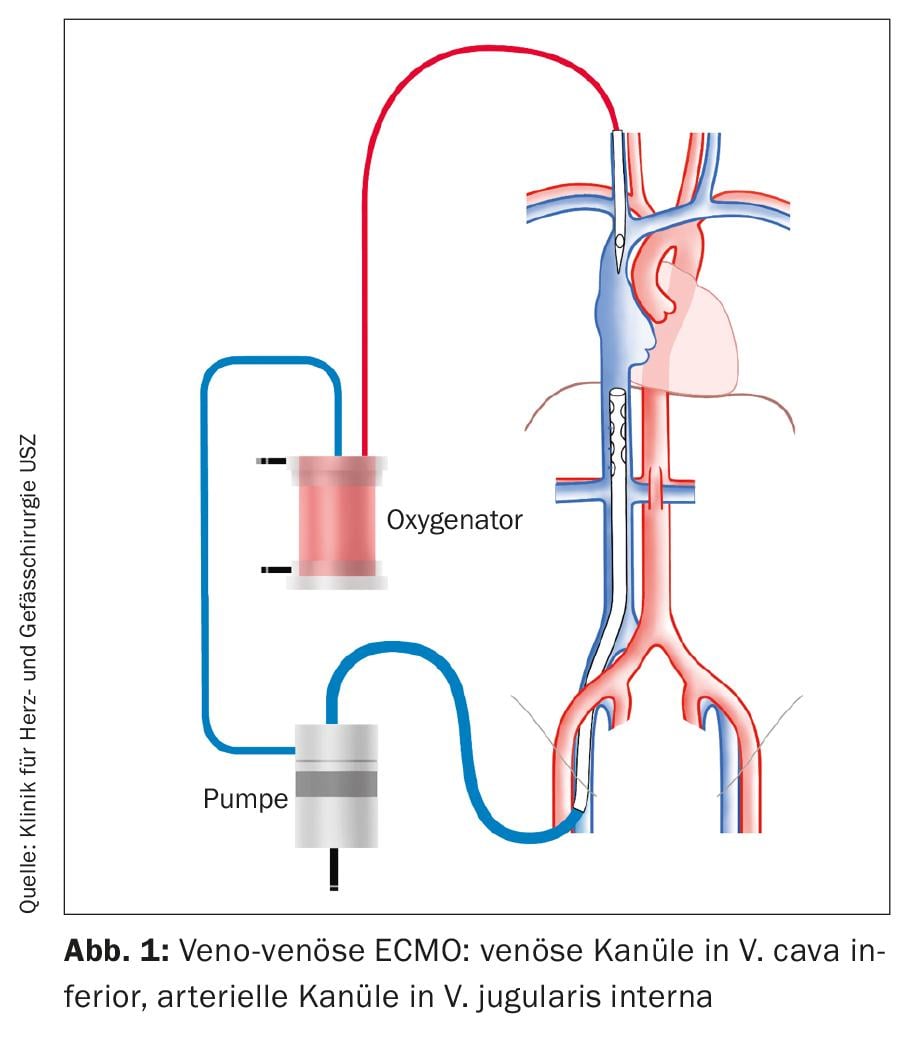
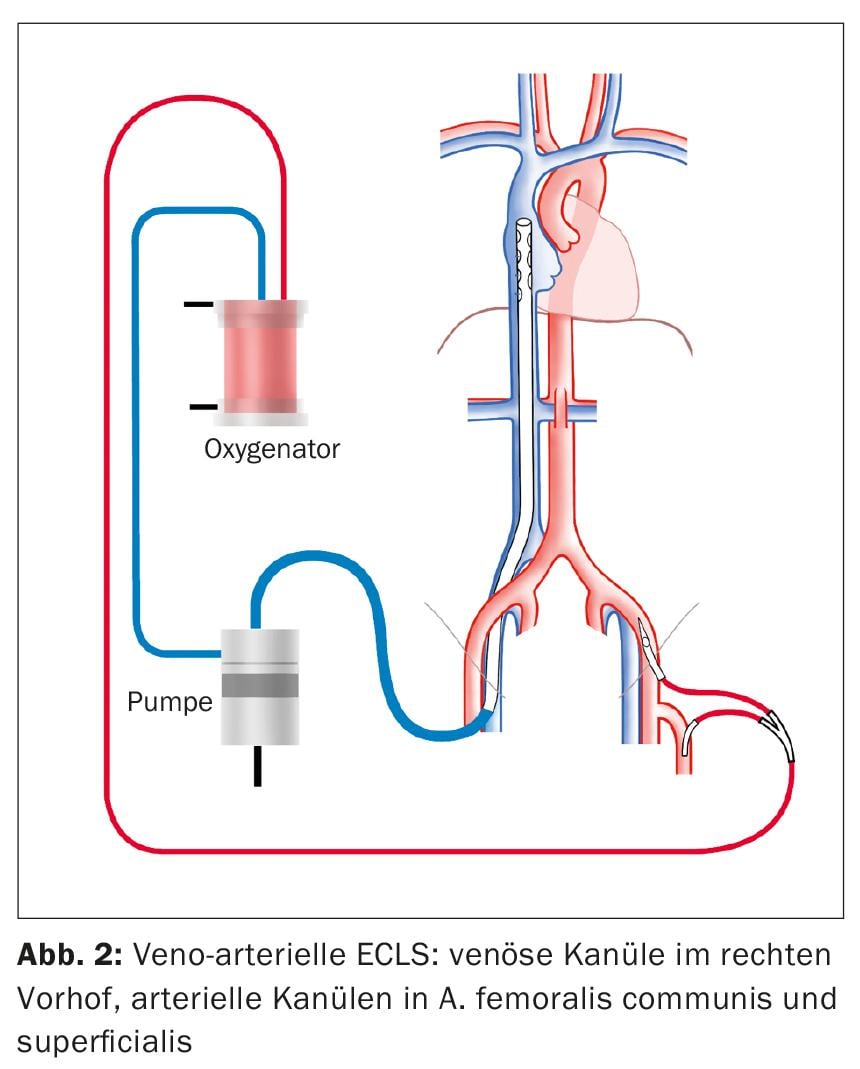
L’ECLS come procedura per lo shock cardiogeno viene impiantato in una configurazione veno-arteriosa (Fig. 2). In modo simile alla vvECMO, una cannula viene inserita nella VFC destra per il drenaggio venoso. Sempre sotto controllo ecocardiografico, la punta della cannula viene posizionata in modo che si trovi a 1-2 cm nella vena cava superiore per ottenere un drenaggio ottimale della metà superiore e inferiore del corpo. L’accesso standard per l’alimentazione arteriosa è l’A. femoralis communis (AFC). La cannula viene inserita prossimalmente nell’arteria iliaca esterna. Inoltre, una gamba di perfusione viene posizionata distalmente nell’arteria femorale superficiale per evitare l’ischemia della gamba.
In primo luogo, tutte le cannule vengono impiantate per via percutanea. Un sistema di chiusura percutanea del vaso viene posizionato prima dell’inserimento della cannula AFC per ottenere la chiusura del foro di puntura durante la successiva rimozione percutanea della cannula. Se la puntura percutanea dell’AFC non ha successo, la cannula deve essere impiantata a cielo aperto chirurgicamente. Questa procedura può essere necessaria quando l’impianto avviene in condizioni di rianimazione. Non è necessario un sistema di chiusura vascolare percutaneo per la rimozione delle cannule venose dalla VFC e dalla VJI. Il foro può essere chiuso con una sutura.
Strategie di trattamento
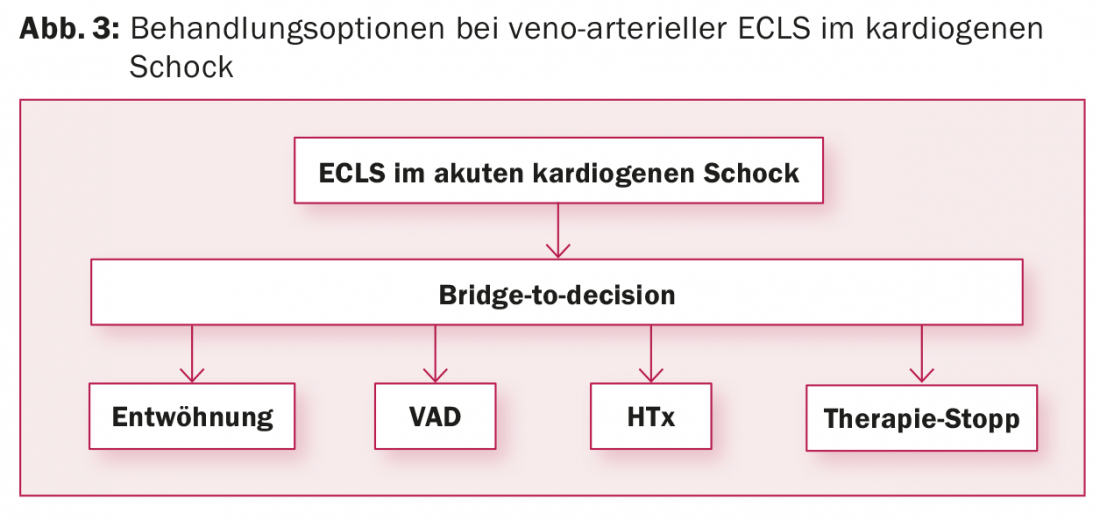
vaECLS: l ‘impianto del vaECLS avviene spesso in una situazione di emergenza che non consente di valutare la strategia di trattamento dopo il vaECLS. Le comorbidità e l’ambiente psicosociale del paziente sono solitamente sconosciuti. Tuttavia, questo è un prerequisito per determinare il concetto di trattamento dopo il vaECLS. Pertanto, il vaECLS viene solitamente impiantato come “ponte verso la decisione” per guadagnare tempo e determinare la situazione del paziente. Oltre a chiarire le malattie concomitanti e la situazione di vita del paziente, è necessario valutare la situazione neurologica, soprattutto se il vaECLS è stato impiantato in condizioni di rianimazione. A tal fine, oltre alla TAC cranica e all’EEG, è necessario effettuare un test di risveglio sull’ECMO per poter valutare il paziente dal punto di vista clinico-neurologico. Dopo il completamento degli esami, si possono scegliere quattro opzioni di terapia successiva (Fig. 3):
- Svezzare il paziente dal vaECLS se la funzione cardiaca si ristabilisce.
- Se la funzione cardiaca non si riprende: Passare il paziente dalla vaECLS a un dispositivo di assistenza cardiaca come “ponte verso il trapianto” se il paziente è candidato a un trapianto di cuore, o come “terapia di destinazione” se il paziente non è candidato a un trapianto di cuore.
- Trapianto di cuore, se il passaggio a un sistema di supporto cardiaco non sembra ragionevole, non ci sono controindicazioni al trapianto di cuore e un cuore di donatore adatto è disponibile entro un massimo di due o tre settimane. Per questo, il paziente viene inserito d’urgenza nella lista d’attesa. Se non è disponibile un cuore di donatore adatto entro questo periodo, il paziente verrà impiantato con un dispositivo di assistenza ventricolare, altrimenti il tasso di complicanze del vaECLS aumenterà.
- Interruzione della vaECLS con morte consecutiva del paziente, se la funzione cardiaca del paziente non si riprende e le controindicazioni non consentono l’impianto di un dispositivo di assistenza cardiaca o il trapianto di cuore.
Secondo le attuali linee guida della Società Europea di Cardiologia del 2016 per l’insufficienza cardiaca acuta e cronica [3], l’impianto di una vaECLS può essere preso in considerazione nello shock cardiogeno refrattario, tenendo conto dell’età del paziente, delle comorbidità e della funzione neurologica (raccomandazione IIb, livello di evidenza C).
vvECMO: l’impianto del vvECMO è solitamente urgente e raramente di emergenza. Esistono tre opzioni di trattamento dopo la vvECMO:
- Svezzamento dalla vvECMO in caso di recupero della funzione polmonare.
- Trapianto di polmone se la funzione polmonare non si recupera e non ci sono controindicazioni.
- Interruzione della vvECMO con conseguente decesso del paziente se la funzione polmonare non viene recuperata e il paziente non è candidato al trapianto di polmone.
Mortalità e morbilità
vaECLS: il tasso di sopravvivenza dei pazienti che hanno ricevuto vaECLS in shock cardiogeno fino alla dimissione dall’ospedale è di circa il 40%. Questo è il risultato di un’analisi di 3846 pazienti nel registro internazionale dell’Organizzazione per il supporto vitale extracorporeo (ELSO) dal 2003 al 2013 [4]. Sulla base dei loro risultati, gli autori hanno sviluppato un punteggio di rischio, il cosiddetto “punteggio SAVE”, che permette di stimare il tasso di sopravvivenza dei pazienti alla vaECLS a seconda dei fattori di rischio presenti. Una meta-analisi di 1199 pazienti provenienti da 22 studi osservazionali dal 2000 al 2014 conferma l’analisi del registro ELSO con un tasso di sopravvivenza del 40% dei pazienti vaECLS alla dimissione ospedaliera [5]. Il tasso di sopravvivenza appare inizialmente basso, circa il 40%. Senza vaECLS, tuttavia, lo 0% sarebbe sopravvissuto. Il basso tasso di sopravvivenza nonostante il ripristino di una circolazione sufficiente con la vaECLS è almeno in parte dovuto ai processi complessi nello shock cardiogeno con lo sviluppo di una reazione infiammatoria sistemica e una sindrome multiorgano. Stabilire una sufficiente perfusione degli organi attraverso la sola vaECLS non è ovviamente sempre sufficiente per superare questi processi.
I tassi di sopravvivenza a lungo termine dei pazienti dopo l’impianto di un vaECLS sono scarsi in letteratura. Nella meta-analisi citata sopra, la sopravvivenza a 3 anni è indicata come 42,7% [5]. Questo corrisponde approssimativamente al tasso di sopravvivenza fino alla dimissione dall’ospedale. Ciò significa che la mortalità è bassa solo una volta che i pazienti sono stati dimessi dall’ospedale.
Le complicazioni all’ECMO di solito hanno un’influenza sfavorevole sulla sopravvivenza del paziente. Più della metà dei pazienti sviluppa una o più complicazioni [5]. Le complicazioni vascolari possono verificarsi nel 10-20% dei pazienti [5,6]. A seconda dell’entità dell’ostruzione vascolare da parte della cannula nell’AFC, può verificarsi un’ischemia della gamba. Per evitare ciò, è ormai prassi standard inserire una cannula di perfusione distale nell’AFS al momento dell’impianto di vaECLS. Le complicazioni emorragiche si verificano nel 26-41% dei pazienti [5,6]. Sono favoriti dal disturbo della coagulazione intravascolare disseminata spesso presente nello shock cardiogeno, dall’insufficiente produzione di fattori di coagulazione nell’insufficienza epatica, dalla trombocitopenia e dalla fluidificazione del sangue necessaria in caso di vaECLS.
Le complicazioni neurologiche includono l’ictus ischemico o emorragico nel 6-8% dei pazienti [5,6]. Sono causati da un flusso sanguigno cerebrale insufficiente nello shock cardiogeno o durante la rianimazione prima dell’impianto di vaECLS. Il complesso disturbo della coagulazione derivante dallo shock cardiogeno, che non sempre può essere rilevato dalla chimica di laboratorio, può favorire lo sviluppo di queste complicanze a livello della vaECLS. Le complicanze infettive sono comuni (25-49%) e comprendono infezioni locali nei siti di incannulamento (17%) e infezioni sistemiche, tra cui polmonite e sepsi. Gli standard di sterilità che non possono essere sempre rispettati durante l’impianto di vaECLS in emergenza e il sistema immunitario compromesso nello shock cardiogeno favoriscono lo sviluppo di infezioni [5–7]. L’insufficienza renale acuta deriva dalla ridotta perfusione nello shock cardiogeno e si verifica nel 47-55% dei pazienti [5,6]. La sostituzione renale è necessaria nel 40-46% dei pazienti [6,7]. Per la terapia vvECMO sono stati sviluppati anche dei punteggi di rischio per stimare la probabilità di sopravvivenza, come il punteggio PRESERVE o PRESET [9,10].
vvECMO: oltre il 60% dei pazienti che ricevono la vvECMO per l’insufficienza polmonare refrattaria sopravvive fino alla dimissione ospedaliera, come dimostrato da una meta-analisi pubblicata di recente su 1042 pazienti [8]. L’età del paziente e le dimensioni insufficienti della cannula, con conseguente potenziale di ossigenazione insufficiente, sono fattori di rischio.
Le complicazioni si verificano nel 40,2%. L’emorragia è la più comune con il 29,3%. Le emorragie intracerebrali si verificano nel 5,4% dei casi. L’emorragia nei siti di incannulamento venoso non gioca un ruolo significativo al 10%, in contrasto con il rischio più elevato di emorragia nelle cannule arteriose nella vaECLS. Le infezioni locali nei siti di incannulamento si sviluppano in poco meno del 10% di tutti i pazienti. Ma solo il 7% delle complicazioni porta alla morte.
Trasporto di pazienti ECMO
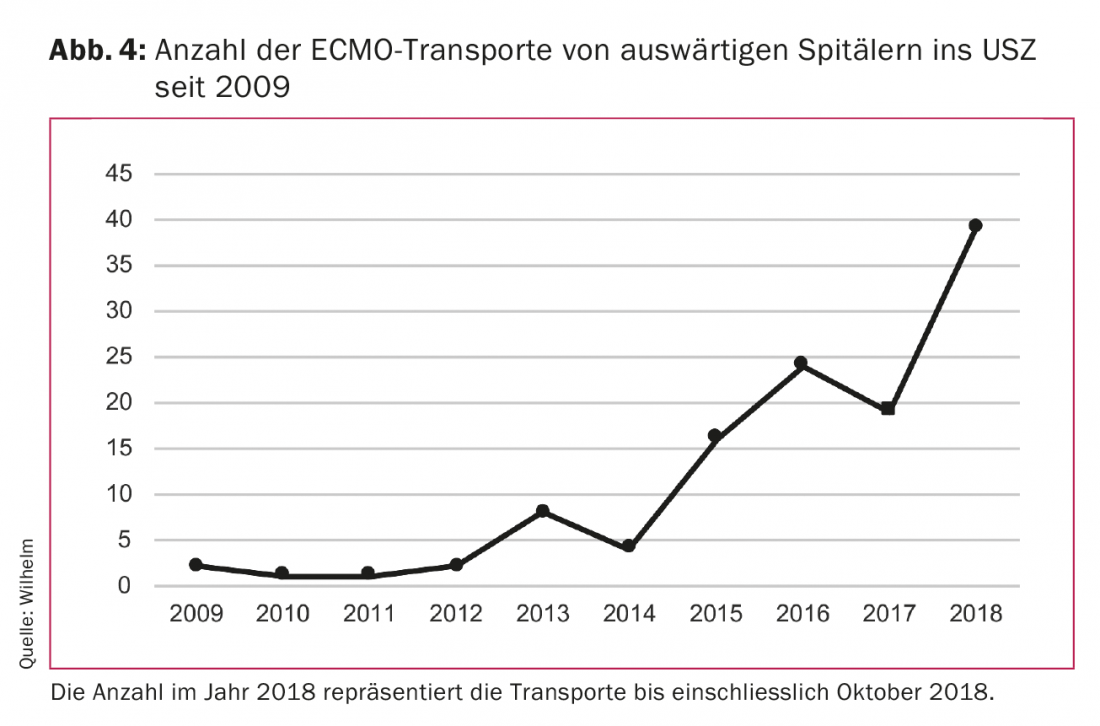
Lo sviluppo tecnico delle pompe centrifughe e degli ossigenatori ha portato a una riduzione significativa delle dimensioni dei sistemi. Di conseguenza, ora possono essere facilmente trasportati in ambulanza o in elicottero. Questo ha reso possibile il trasporto dei pazienti da un ospedale all’altro sul vaECLS o sul vvECMO. Questo ha dato origine a un nuovo concetto di trattamento. I pazienti ricoverati in ospedali extraurbani con insufficienza respiratoria acuta o in shock cardiogeno, che non sono trasportabili a causa delle loro condizioni critiche, possono essere trattati in loco con il vaECLS o il vvECMO e successivamente trasportati con questo sistema all’ospedale centrale per ulteriori trattamenti. Il nostro team della Clinica di Chirurgia Cardiovascolare dell’Ospedale Universitario di Zurigo (USZ) è stato in grado di effettuare tali trasporti con successo, in sicurezza e senza problemi tecnici, sia a terra che in elicottero. La necessità di questo tipo di trattamento è aumentata in modo significativo negli ultimi anni (Fig. 4). Il team, composto da un cardiochirurgo e da un perfusionista, viene portato con l’apparecchiatura all’ospedale fuori città, dove viene impiantato il vaECLS o il vvECMO. Il paziente viene poi trasportato alla USZ sul sistema. I nostri risultati mostrano che il tasso di sopravvivenza di questi pazienti è assolutamente paragonabile a quello dei pazienti sottoposti a vaECLS o vvECMO nel nostro centro ospedaliero.
La sfida rimane
L’uso di vaECLS nello shock cardiogeno e di vvECMO nell’insufficienza respiratoria refrattaria consente di trattare pazienti critici che sarebbero morti prima che questo trattamento fosse disponibile. Tuttavia, questa terapia non ha ancora il successo che vorremmo. Ciò è dovuto alla complessità di questa popolazione di pazienti. In considerazione dell’impegno umano, materiale e finanziario che comporta, l’uso di vaECLS o vvECMO deve essere esaminato criticamente in ogni singolo caso da un punto di vista etico e socio-economico. L’uso dei punteggi può essere un aiuto per la valutazione del rischio. Gli studi controllati randomizzati, che possono fornire indicazioni in altre aree della medicina, non sono ancora disponibili in questo campo e potrebbero non esserlo mai.
Messaggi da portare a casa
- L’ECMO venovenosa viene utilizzata nell’insufficienza respiratoria refrattaria.
- L’ECLS veno-arterioso viene impiantato nello shock cardiogeno acuto.
- L’ECMO venovenoso e l’ECLS veno-arterioso servono come “ponte verso la decisione”.
- Il tasso di sopravvivenza alla dimissione ospedaliera è del 40% per la vaECLS e del 60% per la vvECMO.
- I pazienti possono essere trasportati in modo sicuro da un ospedale fuori città all’ospedale centrale presso il vaECLS o il vvECMO.
Letteratura:
- Peek GJ, et al: Efficacia e valutazione economica del supporto ventilatorio convenzionale rispetto all’ossigenazione extracorporea a membrana per l’insufficienza respiratoria grave dell’adulto (CESAR): uno studio randomizzato controllato multicentrico. Lancet 2009; 374(9698): 1351-1363.
- Thiele H, et al: Contropulsazione con palloncino intra-aortico nell’infarto miocardico acuto complicato da shock cardiogeno (IABP-SHOCK II): risultati finali a 12 mesi di uno studio randomizzato, in aperto. Lancet 2013; 382(9905): 1638-1645.
- Ponikowski P, et al.: Linee guida ESC 2016 per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica: La Task Force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica della Società Europea di Cardiologia (ESC) Sviluppate con il contributo speciale della Heart Failure Association (HFA) dell’ESC. Eur Heart J 2016; 37(27): 2129-2200.
- Schmidt M, et al: Previsione della sopravvivenza dopo ECMO per shock cardiogeno refrattario: il punteggio survival after veno-arterial-ECMO (SAVE). Eur Heart J 2015; 36(33): 2246-2256.
- Xie A, et al: Ossigenazione extracorporea venoarteriosa a membrana per lo shock cardiogeno e l’arresto cardiaco: una meta-analisi. J Cardiothorac Vasc Anesth 2015; 29(3): 637-645.
- Cheng R, et al: Complicazioni dell’ossigenazione extracorporea a membrana per il trattamento dello shock cardiogeno e dell’arresto cardiaco: una meta-analisi di 1.866 pazienti adulti. Ann Thorac Surg 2014; 97(2): 610-616.
- Bermudez CA, et al: Ossigenazione extracorporea a membrana per lo shock refrattario avanzato nella cardiomiopatia acuta e cronica. Ann Thorac Surg 2011; 92(6): 2125-2131.
- Vaquer S, et al: Revisione sistematica e meta-analisi delle complicanze e della mortalità dell’ossigenazione a membrana extracorporea veno-venosa per la sindrome da distress respiratorio acuto refrattario. Ann Intensive Care 2017; 7(1): 51.
- Schmidt M, et al: Il punteggio di rischio di mortalità PRESERVE e l’analisi degli esiti a lungo termine dopo l’ossigenazione extracorporea a membrana per la sindrome da distress respiratorio acuto grave. Intensive Care Med 2013; 39(10): 1704-1713.
- Hilder M, et al: Confronto dei modelli di previsione della mortalità nella sindrome da distress respiratorio acuto sottoposta a ossigenazione extracorporea a membrana e sviluppo di un nuovo punteggio di previsione: il PREdiction of Survival on ECMO Therapy-Score (PRESET-Score). Crit Care 2017; 21: 301.
CARDIOVASC 2018; 17(6): 4-7