Ogni intervento può comportare problemi alla circolazione, al cuore o ai polmoni nel post-operatorio. Evitare tali complicazioni e il loro trattamento è di grande importanza, perché altrimenti il rischio perioperatorio aumenta in modo significativo. Ciò richiede che l’équipe di trattamento della chirurgia toracica sia consapevole dei rischi intraoperatori e postoperatori e sia abile nel gestire le complicanze che si presentano durante il processo.
Ogni intervento può comportare problemi alla circolazione, al cuore o ai polmoni nel post-operatorio. Evitare tali complicazioni e il loro trattamento è di grande importanza, perché altrimenti il rischio perioperatorio aumenta in modo significativo. Ciò richiede che l’équipe di trattamento della chirurgia toracica sia consapevole dei rischi intraoperatori e postoperatori e sia abile nel gestire le complicanze che si presentano durante il processo.

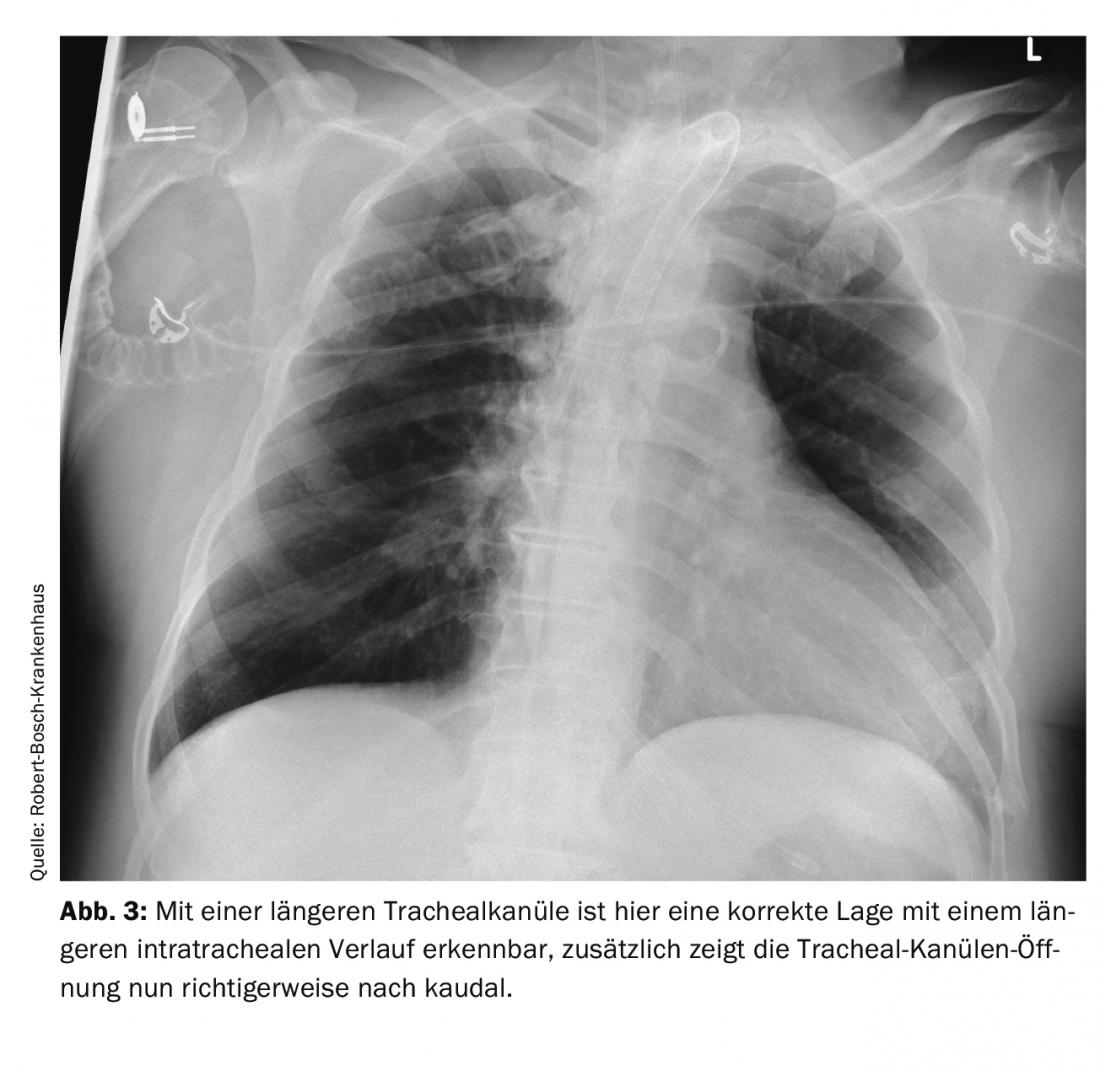
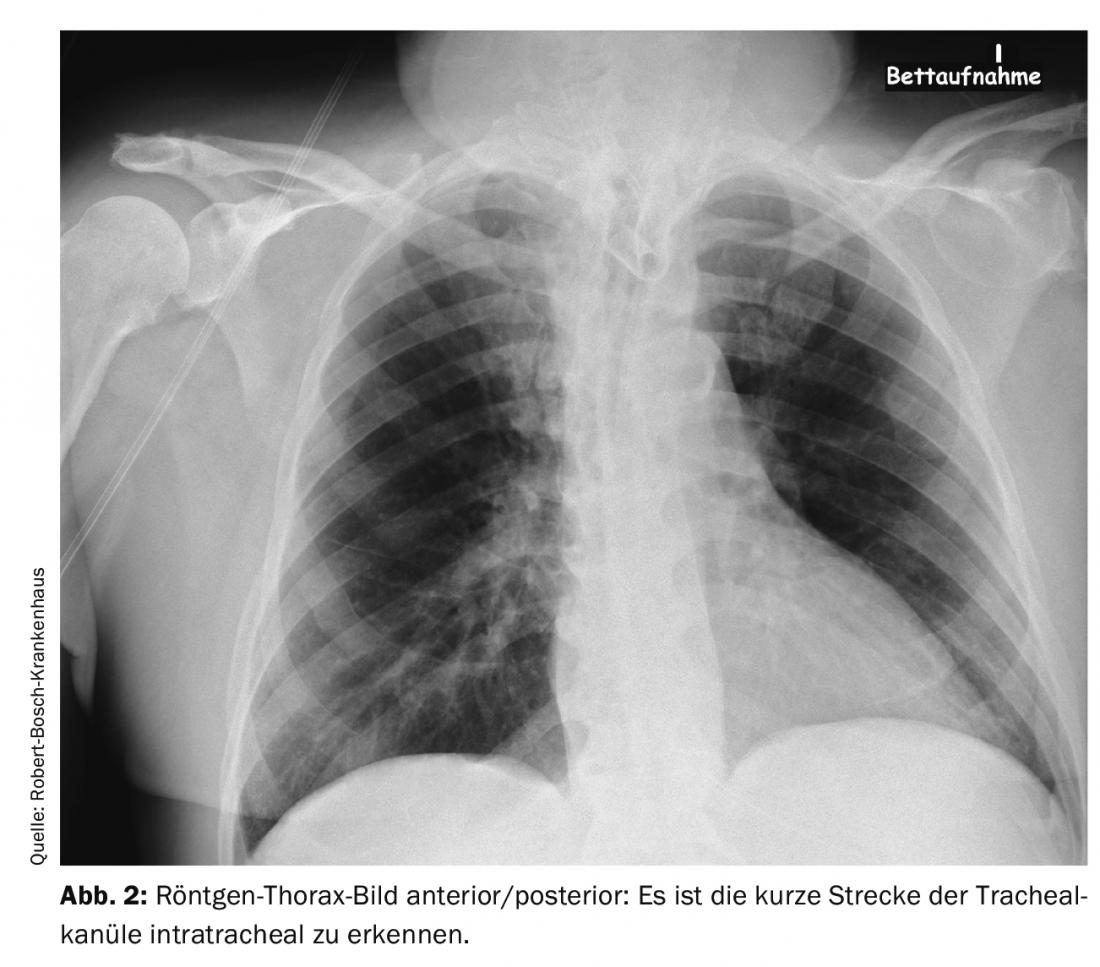
Anche una procedura relativamente piccola, come la creazione di un tracheostoma, può portare il paziente a trovarsi in pericolo vitale dopo l’intervento: In un paziente di 66 anni, è stata tentata prima una tracheostomia dilatata. Poiché questo non ha avuto successo, è stata eseguita una tracheostomia plastica. Poco dopo, il paziente è stato trasferito in un altro ospedale. Nei giorni successivi, si sono verificate difficoltà ricorrenti di ventilazione e ipercapnia. Si pensava che la causa fosse il broncospasmo e lo scompenso da stress dovuto alla riduzione della sedazione per lo svezzamento dal ventilatore. La diagnostica per immagini è stata eseguita più volte. La causa era una cannula tracheale posizionata in modo errato. La cannula era troppo corta e quindi giaceva solo con la punta intratracheale e con l’apertura direttamente sulla parete posteriore tracheale. Questo ha portato a un’ostruzione intermittente delle vie aeree. Nella radiografia – immagine del torace e nella TAC del torace, se si conoscono i segni, si può vedere questa malposizione. Si può vedere nelle immagini delle Figure 1 e 2 la posizione dell’apertura della cannula tracheale direttamente sulla parete tracheale con la sola breve distanza intratracheale e dopo la correzione con una cannula tracheale più lunga nella Figura 3. Il modo più semplice per rilevare questo problema è il controllo tracheoscopico con un broncoscopio. In una situazione del genere, anche un problema facilmente correggibile può portare a un disturbo grave con ipossia e ipercapnia, se non si presta attenzione ai dettagli della diagnosi e quindi non si riconosce il problema effettivo del disturbo delle vie aeree.
Per ridurre il rischio di complicanze postoperatorie, i seguenti punti devono essere sempre controllati quando il paziente viene trasferito in un’unità di monitoraggio o di terapia intensiva dopo un’operazione: coscienza, profondità della sedazione, se necessario, presenza di riflessi protettivi nei pazienti estubati, parametri di respirazione o ventilazione spontanea, posizione del tubo o della cannula tracheale, ventilazione laterale dei polmoni, posizione e portata dei drenaggi toracici, impostazione dell’aspirazione sui drenaggi e parametri di circolazione. Una procedura standard è utile in questo caso, ad esempio una procedura che utilizza lo schema ABCDE per controllare i segni vitali. Si raccomanda anche un passaggio di consegne con misure operative documentate per iscritto, le particolarità intraoperatorie e i problemi riscontrati. In questo caso, si raccomanda un protocollo di handover con il concetto SBAR per evitare errori [1]. L’impostazione dell’aspirazione dei drenaggi toracici è di particolare importanza. Se c’è una perdita d’aria a livello del parenchima polmonare, la pressione negativa sui drenaggi della cavità toracica è necessaria per evitare il pneumotorace, ma un’aspirazione troppo alta può aumentare la perdita d’aria. Nel caso di una pneumectomia, l’impostazione di un’aspirazione negativa (più forte di meno cinque mbar) è controindicata, poiché questa pressione negativa può altrimenti portare a uno spostamento del mediastino (effetto simile a quello di uno pneumotorace da tensione) e quindi a gravi complicazioni cardiopolmonari. L’emorragia postoperatoria può essere rilevata dalla quantità di perdita di drenaggio, dalla determinazione dell’emoglobina nel sangue del paziente e, se necessario, nel liquido di drenaggio, dall’imaging ecografico dello spazio pleurico e, nelle fasi avanzate, da una reazione circolatoria dovuta alla mancanza di volume. Se queste misure non forniscono informazioni sufficienti, spesso è utile una TAC del torace. Oltre a controllare i parametri di coagulazione e, se necessario, adottare misure per migliorare la coagulazione, è opportuno informare il reparto di chirurgia/chirurgia toracica di una revisione chirurgica eventualmente necessaria. Altre complicazioni, più rare, indotte dalla chirurgia, come l’insufficienza del moncone bronchiale (riconoscibile da volumi più elevati di fistola d’aria attraverso i drenaggi toracici) o la torsione del lembo (primo segno spesso un’atelettasia nell’immagine a raggi X del torace) possono spesso essere verificate con una broncoscopia e, se necessario, anche con una TAC (con mezzo di contrasto per l’imaging vascolare) e richiedono una revisione chirurgica.
Pneumectomia con il massimo rischio perioperatorio
Nella chirurgia toracica maggiore, i disturbi respiratori e cardiaci sono più frequenti in fase perioperatoria. Ad esempio, dopo la pneumonectomia, il rischio di infarto miocardico o di morte cardiovascolare nei primi 30 giorni dopo l’intervento è superiore al 5% [2]. È quindi opportuno chiarire i fattori di rischio cardiopolmonare del paziente prima dell’intervento ed effettuare sempre una valutazione del rischio. Per la lobectomia assistita con videotoracoscopia, la classificazione ASA è stata descritta come un metodo utile [3]. Per una valutazione generale del rischio preoperatorio, sono utili l’anamnesi, l’esame fisico, i valori di laboratorio (con analisi dei gas nel sangue) e la diagnostica per immagini (radiografia del torace o TAC). Un ECG a riposo raramente fornisce nuove informazioni prima dell’intervento, ma può essere molto utile come confronto nei problemi post-operatori causati da aritmie cardiache o ischemia. Gli esami funzionali come l’elettrocardiogramma da sforzo, la spiroergometria, il test del cammino di 6 minuti, la stima dell’equivalente metabolico e l’indicazione di quanti piani sono possibili quando si cammina hanno un valore informativo significativamente migliore rispetto ai cosiddetti valori misurati a riposo. L’intervento chirurgico previsto, videotoracoscopico o toracotomico, e il numero di segmenti di polmone resecati sono ulteriori fattori di valutazione del rischio perioperatorio. La funzione polmonare postoperatoria dopo le resezioni può essere stimata utilizzando la seguente formula: valore della funzione preoperatoria (ad esempio FEV1) × numero di segmenti polmonari postoperatori / numero di segmenti polmonari preoperatori [4].
La fibrillazione atriale si verifica con una frequenza del 13 – 46% nella chirurgia toracica maggiore [5]. In termini di intervento chirurgico, l’incidenza più alta si ha con la pneumectomia. È anche un fattore che aumenta il rischio complessivo dell’intervento chirurgico. La terapia dipende dall’effetto sulla circolazione del paziente. Più la circolazione è instabile, più è probabile che la cardioversione sia utile e necessaria in caso di nuova insorgenza di fibrillazione atriale. Dal punto di vista farmacologico, l’amiodarone è più efficace per la conversione del ritmo cardiaco. Se l’obiettivo è il controllo puro della frequenza, i beta-bloccanti e la digitale sono un’opzione di trattamento. Inoltre, è sempre consigliabile controllare gli elettroliti (soprattutto il livello di potassio) e, se necessario, sostituire il potassio e il magnesio. Esistono diversi approcci alla terapia farmacologica profilattica, con i beta-bloccanti e l’amiodarone che si dimostrano i più efficaci.
Saturazione venosa centrale superiore al 70%, se possibile
L’insufficienza cardiaca intra o post-operatoria deve essere diagnosticata rapidamente. Intraoperatoriamente, può essere utile l’ecocardiografia transoesofagea (TEE); post-operatoriamente, sono utili sistemi semi-invasivi come il monitoraggio con il sistema Picco® o l’ecocardiografia transtoracica (TTE) e, in determinate circostanze, un esame TEE. L’ecocardiografia è anche in grado di rilevare il versamento pericardico emodinamicamente efficace e il tamponamento pericardico. Il trattamento dell’insufficienza cardiaca grave (indice cardiaco inferiore a 1,5 l/min/m2 KÖF) avviene con catecolamine, inibitori della fosfodiesterasi-3 o levosimedan. L’insufficienza cardiaca destra è solitamente più difficile da trattare rispetto all’insufficienza cardiaca sinistra. Nell’insufficienza cardiaca destra, il problema può essere l’aumento della resistenza vascolare polmonare; in questo caso, può essere utile una terapia con sildenafil o epoprostenolo per via inalatoria. Se lo stato volumetrico del paziente non è chiaramente identificabile, può essere necessario un esame TTE o l’imaging ecografico della vena cava inferiore. Le misurazioni sonografiche, gli esami TTE e TEE sono metodi che dipendono dall’esperienza dell’esaminatore e dovrebbero essere disponibili per le resezioni polmonari estese. Inoltre, le tecniche di monitoraggio circolatorio semi-invasive possono essere utilizzate per fornire informazioni sullo stato del volume, ad esempio la varianza del volume del colpo può essere utilizzata per valutare il volume in presenza di ritmo sinusale [6]. Un semplice valore di laboratorio per stimare un apporto adeguato di ossigeno è la misurazione della saturazione venosa centrale; questo valore dovrebbe (con un valore normale di emoglobina) essere preferibilmente superiore al 70%. Dopo l’intervento, monitorare lo stato del volume bilanciando le importazioni e le esportazioni. Un volume eccessivo compromette principalmente la funzione polmonare, mentre un volume intravascolare troppo basso porta a problemi di circolazione e, in seconda battuta, alla disfunzione degli organi. Di solito i reni sono colpiti per primi e nelle situazioni di carenza di volume pronunciata si verifica un aumento del livello di lattato (per lo più a causa dell’aumento del metabolismo anaerobico o, più raramente, a causa della ridotta degradazione nel fegato).
Il sanguinamento intraoperatorio con shock emorragico deve essere evitato, se possibile. La conoscenza dei rischi e la preparazione a questi problemi sono di grande utilità in questo caso. Durante una mediastinoscopia, ad esempio, il rischio di gravi emorragie è basso, inferiore all’1% [7]. Tuttavia, se c’è una perdita di sangue importante, è estremamente utile stabilire 1 o 2 accessi venosi a grande lume già prima dell’inizio dell’intervento. Per gli interventi con un rischio più elevato di emorragia, deve essere fornito un numero adeguato di concentrati di globuli rossi compatibili con il ricevente, a seconda del livello di emoglobina prima dell’intervento. Si raccomanda sempre un concetto di “Gestione del sangue del paziente”.
L’incidenza dell’insufficienza respiratoria acuta dopo la chirurgia toracica maggiore è riportata in letteratura tra il 2-7% [8]. La mortalità per insufficienza respiratoria grave nelle prime 48 ore dopo una pneumectomia varia dal 26% all’80%, a seconda della letteratura. Il problema principale risiede nello scambio di gas, che ora è limitato a un solo polmone. Se questa funzione è compromessa, il paziente entra molto rapidamente in aree vitali pericolose di ipercapnia e ipossia. È quindi importante determinare con precisione l’offerta di volume e spesso limitare l’offerta di volume in quantità. Il trauma dell’operazione, l’anestesia, il dolore, ecc. portano a una compromissione della funzione polmonare post-operatoria. La broncocostrizione, la secrezione e l’aspirazione favoriscono la formazione di atelettasia e polmonite. La ventilazione intraoperatoria durante la ventilazione a polmone singolo con volumi tidalici ridotti (5 ml/kgKG) e PEEP moderata (5 – 8 cm H2O) può migliorare gli scambi gassosi postoperatori e ridurre i rischi [9]. La mobilizzazione precoce (fuori dal letto), la fisioterapia e la respirazione e una buona gestione del dolore (ad esempio con un catetere peridurale toracico) migliorano la situazione [10]. La ventilazione non invasiva, l’aspirazione broncoscopica nella respirazione spontanea, la ventilazione invasiva con posizionamento addominale se necessario e, in caso di decorso prolungato, una tracheostomia sono misure necessarie per il trattamento in caso di scambio di gas polmonare significativamente limitato e atelettasia.
Il rischio di polmonite aumenta con la durata della ventilazione
Il rischio di polmonite aumenta proporzionalmente alla durata della ventilazione invasiva [11]. Per la maggior parte dei pazienti dopo un intervento di chirurgia toracica, sono utili il rapido ripristino della respirazione spontanea e l’estubazione precoce. Tuttavia, se è possibile ottenere un’ipercapnia rilevante dal punto di vista del pH, un’ossigenazione insufficiente, una circolazione instabile o, a seguito di un’atelettasia prolungata di un polmone, una ventilazione insufficiente del segmento polmonare interessato, è consigliabile la ventilazione postoperatoria. Nei pazienti con malattia polmonare ostruttiva cronica pronunciata, a volte può essere necessario estubare e fornire un supporto precoce per la meccanica respiratoria con la ventilazione non invasiva, nonostante i livelli elevati di paCO2 (se sono presenti riflessi protettivi, coscienza adeguata e cooperazione del paziente). Se viene utilizzato un tubo a doppio lume intraoperatorio, si raccomanda di passare a un tubo normale nel post-operatorio, per ridurre l’irritazione causata dalla posizione del tubo endobronchiale e per ottenere una migliore gestione delle secrezioni. Se c’è o c’è stata una difficoltà nell’intubazione orotracheale, si raccomanda l’uso di una “asta di Cook” (catetere di scambio delle vie aeree) quando si cambia il tubo.
Posizionare i pazienti intubati con la parte superiore del corpo sollevata di circa 40° riduce l’incidenza di polmonite associata al ventilatore. Sono utili anche un’igiene orale regolare e un controllo regolare della pressione del bracciale. Dopo l’insorgere della polmonite, sono necessarie le determinazioni microbiologiche dei campioni (dalle secrezioni tracheali o bronchiali, sempre prima dell’inizio della terapia antibiotica) e una terapia antibiotica sufficiente. Bisogna aspettarsi patogeni Gram-positivi e Gram-negativi; meno frequentemente, i funghi o i patogeni atipici sono i fattori scatenanti della polmonite. La terapia antibiotica potrebbe dover essere adattata allo spettro patogeno specifico dell’ospedale. Durante la terapia, bisogna prestare attenzione al dosaggio adeguato e alla durata della terapia correttamente selezionata. Nella maggior parte dei casi, è sufficiente una durata della terapia di una settimana. I pazienti che hanno subito un trattamento immunosoppressivo o neoadiuvante hanno un rischio maggiore di infezione e sono più difficili da trattare. Spesso, i pazienti con polmonite beneficiano anche della broncospasmolisi con farmaci e terapia respiratoria sistematica.
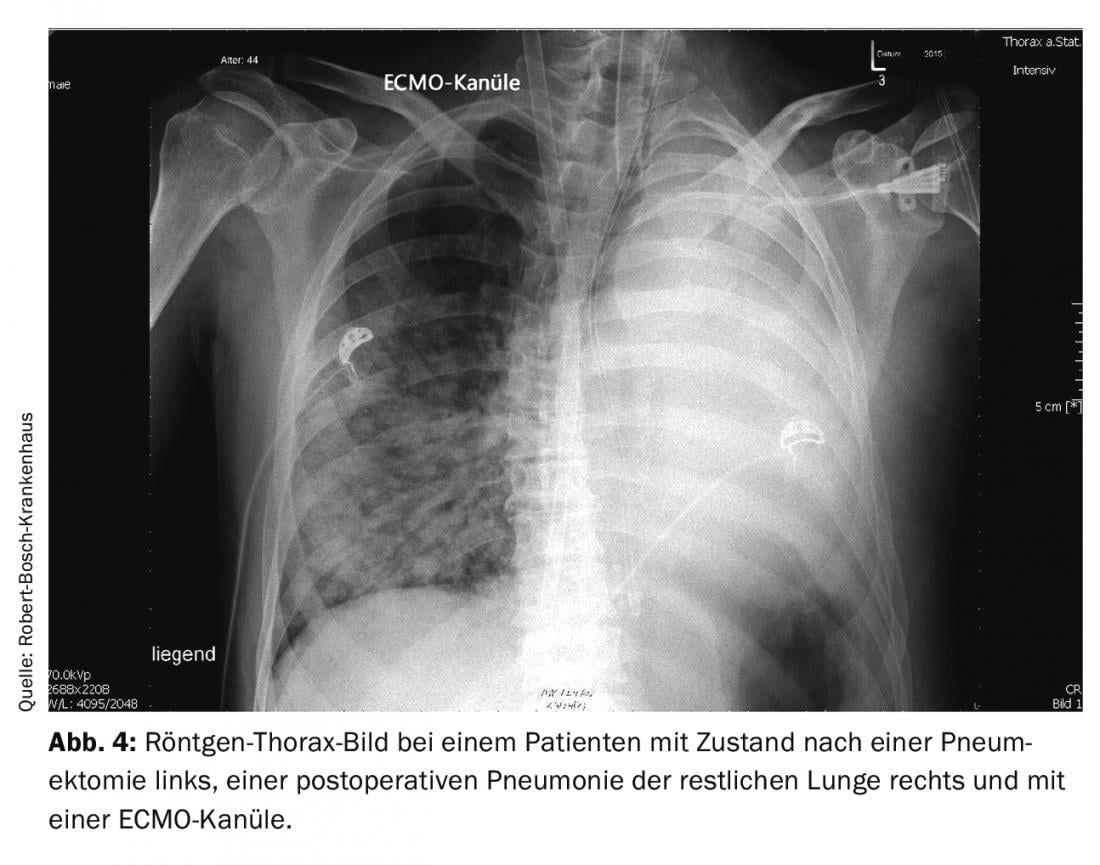
Se tutte le misure convenzionali falliscono in caso di insufficienza polmonare, può essere necessaria una terapia con ossigenazione a membrana extracorporea (ECMO) per via venovenosa. In un paziente con una condizione post-pneumectomia, la polmonite nel polmone rimanente può diventare rapidamente pericolosa per la vita a causa della riduzione della superficie di scambio dei gas indotta dalla chirurgia. Se le condizioni generali sono corrette (nessuna controindicazione e un paziente sufficientemente stabile nelle altre funzioni vitali), la terapia ECMO può apportare chiari vantaggi in tale percorso. La Figura 4 mostra una radiografia di un paziente di 44 anni con polmonite dopo una pneumectomia e una cannula ECMO posizionata attraverso la vena giugulare interna destra. In questo caso, la terapia con ECMO è stata completata con successo dopo dieci giorni. Poiché questa procedura extracorporea non è priva di rischi, è necessario che vi sia una chiara indicazione per questo trattamento e che il team di trattamento abbia un’esperienza sufficiente con questa procedura. L’anticoagulazione necessaria, le lesioni causate dal posizionamento dei cateteri di grande diametro e un’infezione nosocomiale sono i rischi principali della procedura.
L’edema polmonare da riespansione, come ulteriore causa di disturbo dello scambio gassoso postoperatorio, può verificarsi dopo la rimozione di un grande versamento pleurico o di uno pneumotorace pronunciato e anche dopo la ventilazione a polmone singolo (separazione dei polmoni tramite tubo a doppio lume o bloccatore di bronchi) per un lungo periodo di tempo. Si presume che la causa fisiopatologica sia un processo multifattoriale. Lo sviluppo dell’accumulo di fluidi nell’interstizio e negli alveoli, dovuto all’aumento della permeabilità ai fluidi, si presume sia causato dal rilascio di mediatori, dalla perdita di tensioattivo e dal danno alla membrana alveolare da parte delle ossidasi. Simile dal punto di vista fisiopatologico è l’edema post-pneumectomia, che si verifica 24-72 ore dopo l’intervento di pneumonectomia o raramente dopo la lobectomia. Il trattamento consiste nell’assunzione restrittiva di liquidi, nella ventilazione non invasiva o invasiva con PEEP e nell’aumento della concentrazione di ossigeno inspiratorio, che di solito è necessario. È associata a una mortalità significativa, simile all’ARDS grave, e purtroppo può verificarsi anche con un’assunzione di liquidi molto ridotta in fase perioperatoria.
Nel complesso, è necessario un monitoraggio attento, un riconoscimento rapido e corretto e un trattamento rapido nel caso dei disturbi pericolosi per la vita menzionati. Questo permette di ottenere un buon risultato per il paziente, anche nelle procedure che sono associate a un notevole rischio perioperatorio.
Messaggi da portare a casa
- Una valutazione del rischio perioperatorio di mortalità e letalità aiuta a evitare le complicazioni postoperatorie nella chirurgia toracica maggiore. In questo caso, sono utili i test funzionali sistematici.
- Le complicazioni respiratorie e cardiache si verificano con una frequenza rilevante durante queste procedure.
- Il monitoraggio circolatorio semi-invasivo o invasivo è consigliato per le condizioni cardiovascolari instabili; i valori della pressione arteriosa e della frequenza cardiaca da soli sono spesso insufficienti.
- La mobilizzazione, l’elevazione della parte superiore del corpo, la terapia respiratoria e la fisioterapia, insieme alle impostazioni del ventilatore, sono le pietre miliari della prevenzione e del trattamento delle complicanze respiratorie. Nella maggior parte dei casi, la respirazione spontanea precoce e l’estubazione rapida sono utili per questi pazienti.
- In situazioni individuali, la terapia ECMO può essere necessaria dopo l’intervento.
Letteratura:
- von Dossow V, Zwißler B: Consegna strutturata del paziente nella fase perioperatoria – Il concetto SBAR. Anaesth Intensivmed 2016; 57: 88-90.
- Kristensen SD, Knuuti J, Saraste A, et al: Linee guida ESC/ESA 2014 sulla chirurgia non cardiaca: valutazione e gestione cardiovascolare: La task force congiunta sulla chirurgia non cardiaca: valutazione e gestione cardiovascolare della Società Europea di Cardiologia (ESC) e della Società Europea di Anestesiologia (ESA). Eur J Anaesthesiol 2014; 31(10): 517-573.
- Zhang R, Kyriss T, Dippon J, et al: G. Lo stato fisico dell’American Society of Anesthesiologists facilita la stratificazione del rischio dei pazienti anziani sottoposti a lobectomia toracoscopica. Eur J Cardiothorac Surg 2018; 53(5): 973-979.
- Smulders SA, Smeenk FW, Janssen-Heijnen ML, et al: Cambiamenti effettivi e previsti nella funzione polmonare dopo la pneumonectomia: un’analisi retrospettiva. Chest 2004; 125: 1735-1741.
- Zhao BC, Huang TY, Deng QW, et al: Profilassi contro la fibrillazione atriale dopo la chirurgia toracica generale: analisi sequenziale dei trial e meta-analisi di rete. Chest 2017; 151(1): 149-159.
- Hansen M: Monitoraggio emodinamico – Monitoraggio avanzato [Invasive and minimally invasive hemodynamic monitoring]. Anasthesiol Intensivmed Notfallmed Schmerzther 2016; 51(10): 616-625.
- Schirren M, Sponholz S, Oguhzan S, et al: Emorragia intraoperatoria durante la chirurgia toracica: strategie di prevenzione e concetti di trattamento chirurgico]. Chirurg 2015; 86(5): 453-458.
- Kösek V, Wiebe K: Insufficienza respiratoria postoperatoria e suo trattamento [Postoperative respiratory insufficiency and its treatment]. Chirurgo 2015; 86(5): 437-443.
- Marret E, Cinotti R, Berard L, et al: La ventilazione protettiva durante l’anestesia riduce le principali complicanze postoperatorie dopo un intervento chirurgico per cancro al polmone: uno studio randomizzato controllato in doppio cieco. Eur J Anaesthesiol 2018; 35(10): 727-735.
- Rogers LJ, Bleetman D, Messenger DE, et al: L’impatto della conformità al protocollo ERAS (enhanced recovery after surgery) sulla morbilità della resezione per il tumore polmonare primario. J Thorac Cardiovasc Surg 2018; 155(4): 1843-1852.
- Wunder C: Infezioni nosocomiali in terapia intensiva. Anaesth Intensivmed 2020; 61: 215-222.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2021; 3(1): 9-13