La sicurezza dei farmaci riguarda la ricerca prima e dopo l’approvazione di un farmaco, la conoscenza dei medici e di gruppi speciali di pazienti, ma anche l’integrazione della tecnologia nella vita ospedaliera quotidiana. In questo modo si possono evitare gli errori terapeutici e le interazioni pericolose.
Per prima cosa, parliamo di farmaci. Le “fasi di vita” dello sviluppo clinico di un farmaco sono sufficientemente note. A partire dal premarketing, che comprende le sperimentazioni dalla fase I alla III, fino alla presentazione all’autorità regolatoria del farmaco (ad esempio la FDA negli Stati Uniti) e all’approvazione – se il farmaco sopravvive alla revisione. Sebbene negli ultimi anni le popolazioni di studio speciali, cioè le persone in età avanzata, con malattie renali/fegato, di diversa ascendenza, ecc. abbiano trovato sempre più spazio nella fase di pre-commercializzazione, ciò non copre ovviamente tutti i gruppi di trattamento e tutte le situazioni. Ad esempio, le donne incinte e i bambini sono spesso esclusi per motivi etici.
Per poter valutare meglio la sicurezza di un farmaco, l’approvazione è seguita dalla fase post-marketing (fase IV), che prevede il monitoraggio a lungo termine degli eventi avversi, il monitoraggio sistematico e gli studi di sicurezza farmacoepidemiologici. Dalla fine degli anni ’90, questa ‘fase di vita’ dei farmaci è stata sempre più sistematizzata e integrata in modo più attivo nel concetto generale di marketing. Oggi, di solito viene già considerata o integrata in modo proattivo nello sviluppo di nuove sostanze (cioè gli studi di sicurezza epidemiologici sistematici, basati sulla popolazione, vengono solitamente negoziati contestualmente alla presentazione di un’autorizzazione all’immissione in commercio).
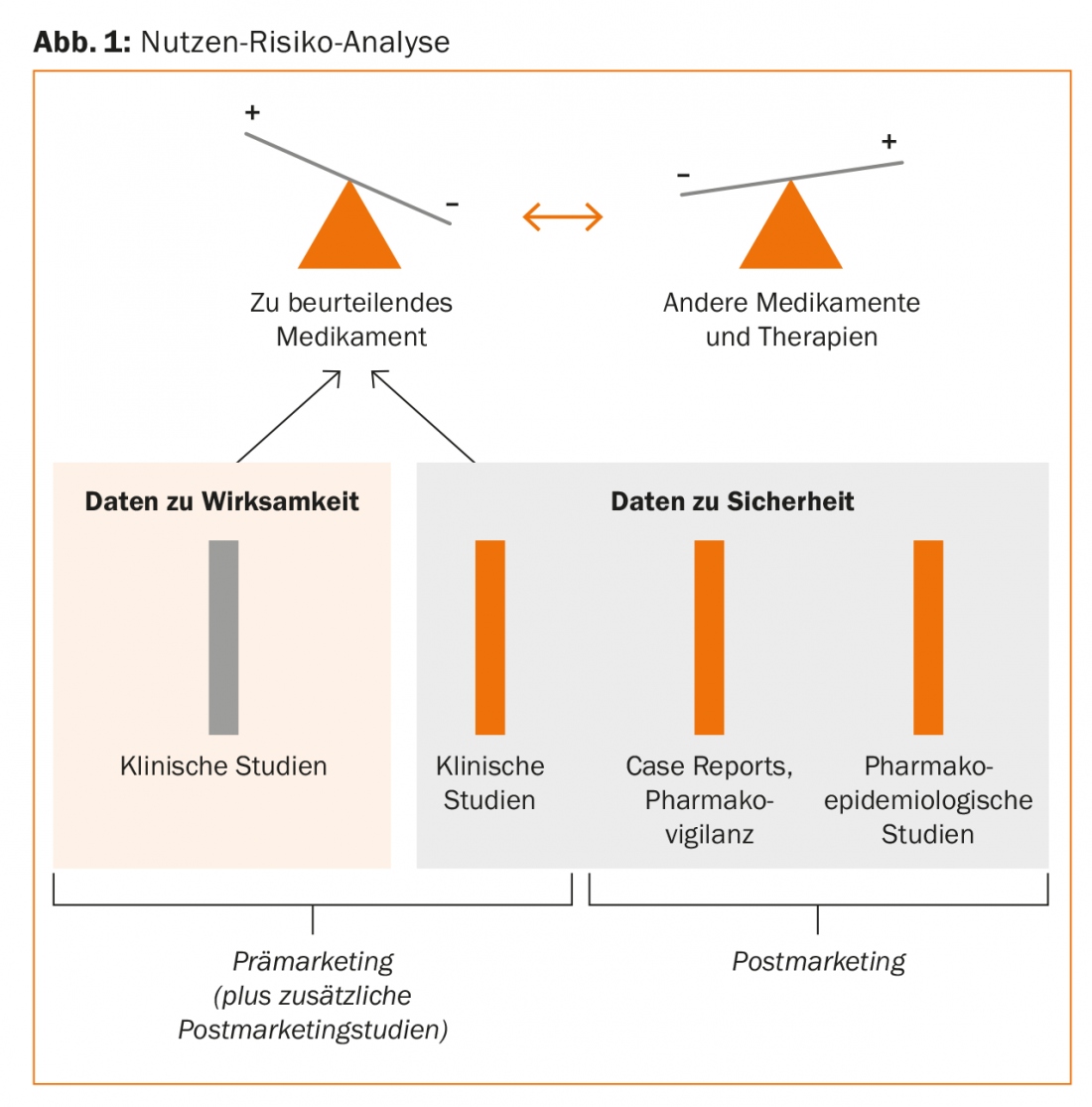
Un’analisi razionale dei benefici e dei rischi dei farmaci con la stessa indicazione si basa quindi sui seguenti pilastri:
- Studi clinici (Fase I, II, III)
- Rapporti di caso/farmacovigilanza (rapporti spontanei)
- Studi farmacoepidemiologici (Fig. 1).
L’area della farmacovigilanza o dei rapporti sui casi può essere valutata qualitativamente molto bene e ha un effetto di segnalazione (generazione di ipotesi), ma è poco adatta alla quantificazione dei rischi relativi. Il maggior numero di prove proviene da studi farmacoepidemiologici sistematici. “Questo settore è ora altamente specializzato e gli studi sono molto ampi e impegnativi. Ma ciò che possiamo fare molto bene anche nella vita di tutti i giorni con le nuove possibilità tecniche sono le valutazioni con i sistemi informativi clinici. Abbiamo pubblicato gli studi corrispondenti sulle interazioni farmacologiche nel 2011 [1]. I nostri dati sui neurolettici di seconda generazione del 2016 [2] dimostrano inoltre che questo è possibile anche a livello locale, nel proprio ospedale, e che ha senso migliorare la sicurezza delle prescrizioni”, ha spiegato il relatore.
Fasi della vita dei medici
Per quanto riguarda gli errori di medicazione, Ashcroft et al. due anni fa ha illustrato in modo chiaro che i medici giovani e inesperti commettono il doppio degli errori nel primo e nel secondo anno rispetto ai medici più anziani, ma che questi ultimi non “se la cavano” senza errori di medicazione e che gli errori – se ne commettono – sono altrettanto gravi. Ciò significa che gli interventi sono indicati non solo per i medici in formazione, ma anche per i medici senior, per evitare errori di medicazione potenzialmente gravi [3]. La volontà di continuare ad apprendere e imparare per tutta la vita (anche i più anziani dai più giovani), così come l’integrazione della tecnologia moderna (ad esempio, l’iPad durante i turni) nel processo decisionale sono i prerequisiti per questo.
“Ci atteniamo davvero al principio ippocratico ‘Primum non nocere’ (o in tedesco: Prima non nuocere)? Ecco un esempio: per una malattia altrimenti mortale, prescrive il farmaco 1, che cura il 75% dei pazienti ma comporta un rischio di effetto collaterale acuto fatale di 1:10.000 casi, o il farmaco 2 con un tasso di guarigione dell’80% e un rischio corrispondente di 1:100?”, ha chiesto il Prof. Russmann al pubblico. “Molti sceglierebbero la droga 1. Tuttavia, ciò causa 421 decessi in più rispetto alla droga 2. Il calcolo corrispondente è molto semplice:
Farmaco 1: un paziente su 10.000 muore; dei restanti 9999, 7499 vengono curati. Quindi, 7499 su 10.000 sopravvivono.
Farmaco 2: 100 pazienti su 10.000 muoiono; dei restanti 9900, 7920 vengono curati. 7920 su 10.000 sopravvivono.
Il “processo decisionale difensivo”, ossia un atteggiamento autoprotettivo da parte del medico, combinato con una falsa valutazione intuitiva delle probabilità, può quindi concludersi pericolosamente per il paziente. Per rimanere all’esempio precedente: Il fatto che il paziente sia morto a causa della malattia invece che per le medicine prescritte dalla sua stessa mano è un po’ più facile da sopportare per il medico.
Un riepilogo di come migliorare la sicurezza dei farmaci da parte dei medici è illustrato nella panoramica 1.
Fasi di vita delle prove
I seguenti principi sono rilevanti in questo caso:
- Utilizzi farmaci con un profilo di sicurezza ben documentato.
- Rimanere “aggiornati”, formazione continua
- Rimanga critico nei confronti delle nuove prove, le esamini attentamente
- Preoccupazioni: “Ogni volta che un nuovo farmaco viene immesso sul mercato, succede qualcosa di assurdo”.
Fasi di vita degli ospedali
Con analisi sistematiche e sistemi di informazione clinica, è possibile individuare e indicare in tempo combinazioni di farmaci pericolose o addirittura controindicate. I controlli di interazione sono possibili, ad esempio, tramite www.mediq.ch. Il Prof. Russmann, in qualità di farmacologo clinico ed epidemiologo, è lui stesso intensamente coinvolto in questo tema e ha co-sviluppato e implementato il cosiddetto programma di “farmacoepidemiologia interventistica”. Nel corso del processo, un gran numero di prescrizioni viene registrato tramite un sistema elettronico di informazioni cliniche e viene creato un database farmacoepidemiologico ospedaliero locale. Attraverso il programma di “farmacoepidemiologia interventistica”, gli errori di medicazione negli ospedali possono essere identificati, quantificati e la loro rilevanza clinica valutata in tempi molto brevi. In questo modo, è possibile integrare avvisi automatici mirati nella prescrizione elettronica dei farmaci (in “tempo reale”). Inoltre, dai dati si ottengono studi di coorte/caso-controllo e longitudinali con dichiarazioni sui modelli di prescrizione, sugli effetti collaterali e sugli aspetti economici. Due pubblicazioni degli ultimi anni dimostrano che questo funziona [4,5].
La gestione proattiva della qualità, così come gli investimenti nell’IT e nei sistemi sopra citati che riconoscono i potenziali problemi nella farmacoterapia, valutano la rilevanza clinica e avvertono tempestivamente delle situazioni critiche, sono quindi fondamentali. Oltre alla stabilità della forza lavoro e al basso turnover del personale, aiutano l’ospedale a migliorare la sicurezza dei farmaci in modo sostenibile e a lungo termine.
Fasi della vita dei pazienti
Infine, qualche parola sui pazienti nella fase avanzata della loro vita”. Negli anziani, a causa della multimorbilità e quindi della politerapia, l’esame delle interazioni tra i farmaci (“interazione farmaco-farmaco”) è centrale. Tuttavia, non bisogna dimenticare le interazioni tra farmaci e malattie (“interazione farmaco-malattia”). Anche l’inventario della funzione renale e gli eventuali aggiustamenti della dose, le visite cliniche regolari e il monitoraggio di vari parametri come la pressione sanguigna, l’ECG, ecc. fanno parte di una pratica clinica che mira a migliorare la sicurezza dei farmaci. “Per la popolazione pediatrica, ossia i pazienti all’inizio della loro vita, il sito web/banca dati kinderdosierungen.ch fornisce informazioni preziose”, ha detto.
Fonte: 15° Riunione annuale della SGAMSP, 28 settembre 2017, Wil
Letteratura:
- Haueis P, et al.: Valutazione delle interazioni farmacologiche in un ampio campione di pazienti psichiatrici: un’interfaccia dati per l’analisi di massa con un software di supporto decisionale clinico. Clin Pharmacol Ther 2011 Oct; 90(4): 588-596.
- Low DF, et al: Antipsicotici di seconda generazione in un ospedale terziario: modelli di prescrizione, profili metabolici e interazioni farmacologiche. Int Clin Psychopharmacol 2016 Jan; 31(1): 42-50.
- Ashcroft DM, et al: Prevalenza, natura, gravità e fattori di rischio degli errori di prescrizione nei pazienti ospedalieri: studio prospettico in 20 ospedali del Regno Unito. Drug Saf 2015 Sep; 38(9): 833-843.
- Niedrig D, et al.: Sviluppo, implementazione e analisi dei risultati di avvisi semiautomatici per l’aggiustamento della dose di metformina nei pazienti ospedalizzati con insufficienza renale. Pharmacoepidemiol Drug Saf 2016 Oct; 25(10): 1204-1209.
- Low D, et al: Sovradosaggio di paracetamolo in un ospedale terziario: implementazione e analisi dei risultati di un programma di allarme preventivo. Journal of Clinical Pharmacy and Therapeutics 2016; 41(5): 515-518.
Ulteriori letture:
- Gigerenzer G: Rischio: come prendere le decisioni giuste. Monaco di Baviera: Random House GmbH 2013.
InFo NEUROLOGIA & PSICHIATRIA 2017; 15(6): 39-41