La gestione del dolore è una delle grandi sfide delle cure palliative, ma spesso anche una di quelle con un successo terapeutico misurabile. Negli stadi avanzati, tutte le opzioni di gestione del dolore devono essere esaurite per migliorare la qualità di vita. Se la terapia fallisce, è necessario contattare uno specialista del dolore. Circa il 90% dei pazienti con tumori avanzati può essere trattato in questo modo con poco dolore.
Quasi tutti i pazienti affetti da una malattia grave, spesso maligna, hanno paura del dolore che non può essere trattato. Molti di loro conoscono situazioni di familiari o amici che hanno sofferto di un dolore trattato in modo inadeguato durante il decorso della malattia e hanno dovuto vivere la fase di fine vita in agonia. Con le possibilità odierne di terapia del dolore, questi corsi non dovrebbero più verificarsi. Tuttavia, ci sono situazioni in cui il trattamento del dolore può raggiungere i suoi limiti a causa della sua complessità.
Il trattamento del sintomo dolore è molto adatto come esempio di buon controllo dei sintomi nelle cure palliative, soprattutto perché il dolore è un problema frequente nel corso di malattie potenzialmente letali. Un’analgesia efficace è uno dei compiti principali delle cure palliative. Spesso, a causa del decorso distruttivo della malattia, si verifica una situazione di dolore progressivo che richiede un continuo adeguamento della terapia. È importante che il concetto di trattamento analizzi il tipo di dolore e le possibili patologie eziologiche sottostanti, al fine di applicare anche approcci di terapia causale, come l’irradiazione del dolore, quando possibile. A causa dell’inattività, spesso si verifica un aumento del dolore e la terapia può essere complicata dall’aumento della disfunzione degli organi. Soprattutto nel decorso tardivo della malattia, i fattori non somatici per l’esperienza del dolore vengono sempre più alla ribalta. D’altra parte, comprensibilmente, i pazienti raramente chiedono il controllo dei sintomi con la stessa veemenza con cui chiedono la liberazione dal dolore.
Nozioni di base sul dolore
La definizione di dolore valida oggi proviene dal 1986 dall’Associazione Internazionale per il Controllo del Dolore (IASP) e recita: Il dolore è un’esperienza sensoriale ed emotiva spiacevole che è accompagnata da un danno tissutale reale o imminente – o è descritto in termini di tale danno – spesso accompagnato da manifestazioni vegetative come pallore, sudorazione e aumento della pressione sanguigna.
Il dolore acuto ha normalmente un’utile funzione di avvertimento ed è significativo, protettivo e di supporto alla vita. Nel caso del dolore cronico nel corso di una malattia maligna, tuttavia, il dolore ha perso questa utile funzione di avvertimento. Il dolore può essere classificato in base al suo decorso temporale come acuto o cronico, ma anche in base alla sua patogenesi come dolore nocicettivo, neuropatico e misto, e conosciamo anche il cosiddetto disturbo del dolore somatoforme. Nella situazione palliativa, di solito abbiamo a che fare con situazioni di dolore cronico progressivo, spesso misto, tuttavia il dolore acuto si ripresenta nel corso della malattia, che deve essere sottoposto a una valutazione differenziata per non perdere le opzioni terapeutiche causali.
Patogenesi del dolore
L’analisi del dolore differenziata rispetto alla patogenesi è indispensabile, poiché una terapia del dolore significativa è possibile solo dopo una classificazione di successo. Distinguiamo il dolore nocicettivo dal dolore neuropatico. Il dolore nocicettivo è un dolore che di solito deriva da un danno locale nel sito della lesione. Un’eccezione è rappresentata dal dolore viscerale, che può rendere difficile l’assegnazione locale tramite le zone di Head.
Un buon esempio di evento nocicettivo è il dolore causato dalla comparsa di metastasi ossee. In questo caso, la distruzione locale dovuta all’irritazione dei recettori corrispondenti scatena un dolore di base costante, che a volte viene accentuato da un attacco di dolore più intenso.
Al contrario, il dolore neuropatico ha origine nel sistema nervoso centrale o periferico. L’insorgenza del dolore spesso non è in relazione temporale immediata, con una certa latenza di giorni o settimane dopo la lesione effettiva; gli attacchi di dolore sono frequenti e molto intensi, imprevedibili e descritti come brucianti, taglienti, elettrizzanti e pulsanti. Inoltre, possono verificarsi iperalgesia, ipalgesia e allodinia. Esempi di dolore neuropatico sono la nevralgia post-erpetica, il dolore dell’arto fantasma, il dolore radicolare o il dolore innescato centralmente (dolore talamico).
Dolore da cancro
Nel contesto di una malattia tumorale, il dolore può essere provocato direttamente dal tumore, sia attraverso la crescita distruttiva del tessuto, sia attraverso la pressione o l’infiltrazione dei nervi, sia attraverso lo stiramento o la pressione sugli organi cavi. Il dolore indiretto da tumore deriva dall’infiammazione edematosa perilesionale, dalle fratture patologiche o dalle ostruzioni degli organi cavi. Infine, il dolore insorge anche in seguito a terapie tumorali post-operatorie, post-trattamento o a causa dell’infiammazione e delle conseguenze della chemioterapia. Quando è possibile, dopo aver chiarito la causa del dolore, si dà priorità all’opzione terapeutica causale, se l’onere associato appare giustificabile nel contesto generale. Purtroppo, queste opzioni sono limitate, quindi la terapia sintomatica è spesso l’unica opzione.
Terapia del dolore
Circa nello stesso periodo in cui il dolore è stato definito dalla IASP, l’OMS ha sviluppato uno schema di classificazione per il trattamento del dolore nei pazienti oncologici. L’obiettivo di questo regime era quello di alleviare o eliminare il dolore e di prevenire il ripetersi di un’esacerbazione del dolore. La classificazione consente un trattamento del dolore efficiente, relativamente a basso rischio e rapidamente efficace. Oggi, lo schema di stadiazione dell’OMS viene utilizzato in forma modificata anche nel trattamento del dolore non maligno.
I tre livelli includono, al livello 1, i classici antidolorifici non oppioidi, che tutti conosciamo bene. Esempi sono il paracetamolo, il metamizolo, l’aspirina, il diclofenac, la mefenamina, ecc. Oltre al loro effetto analgesico, queste sostanze hanno anche proprietà antiflogistiche e antipiretiche in misura variabile. Ad eccezione del paracetamolo, agiscono esclusivamente a livello periferico sul nocicettore. Solo il paracetamolo ha un effetto centrale. In Nella fase 2 troviamo gli oppioidi deboli. I rappresentanti di questa categoria sono tramadolo, codeina, diidrocodeina o tilidina. Hanno un rapporto rischio-beneficio favorevole, hanno circa 1/6-1/10 dell’efficacia della sostanza di riferimento, la morfina (quindi sono chiamati oppioidi deboli) e sono facili da dosare. I problemi sorgono nel 10% dei pazienti che, ad esempio, non possono metabolizzare la codeina e soffrono solo degli effetti collaterali indotti dagli oppioidi, così come nei diversi metabolizzatori in cui il tramadolo provoca solo sintomi di ortostasi serotoninergica e antiadrenergica.
Il livello 3 comprende gli oppioidi classici con la sostanza di riferimento morfina (più mg per la stessa analgesia – oppioidi deboli; meno mg per la stessa analgesia – oppioidi forti). La tabella 1 mostra una panoramica delle dosi equivalenti per gli oppioidi. Gli oppioidi inibiscono la trasmissione nelle sinapsi del sistema nocicettivo, attivano i sistemi inibitori nel sistema nervoso centrale e nel midollo spinale, alterano la percezione del dolore attraverso l’attacco al talamo e al sistema limbico e quindi portano anche all’ansiolisi. A livello periferico del nocicettore, gli oppioidi agiscono principalmente nel tessuto infiammato.
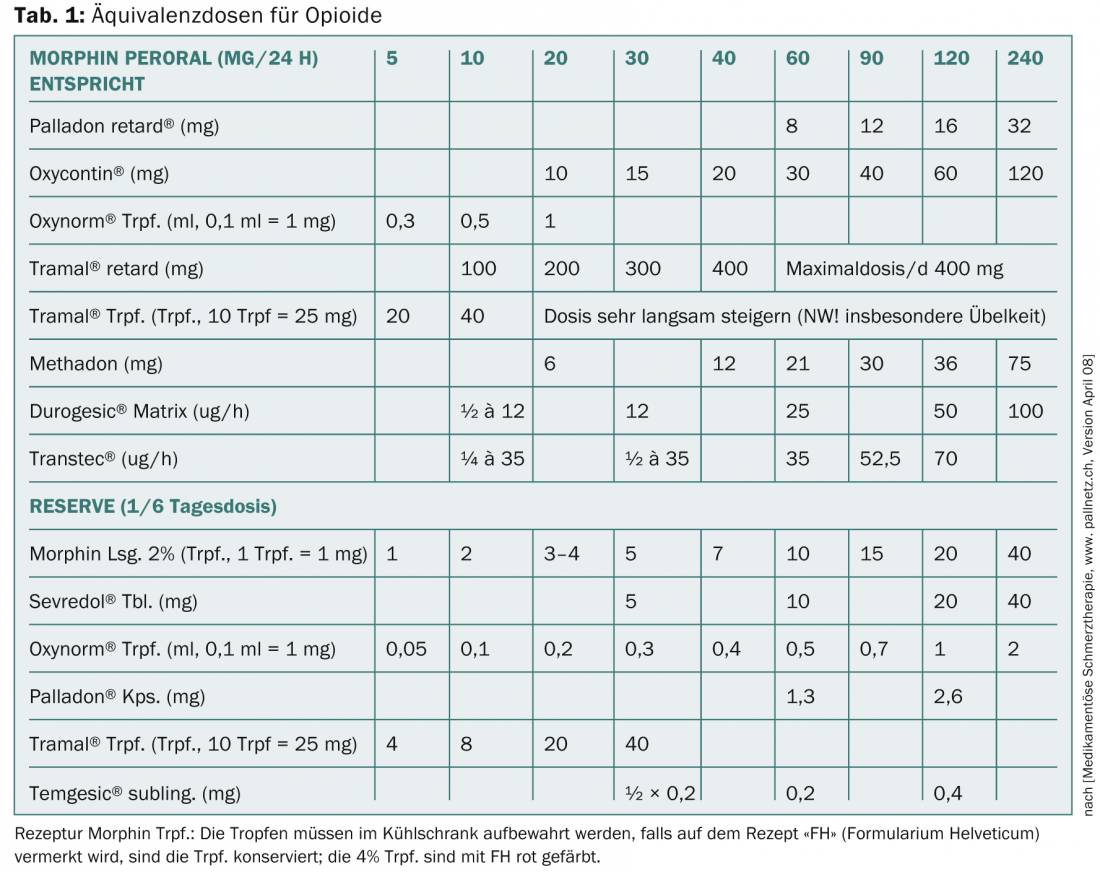
I problemi principali sono la nausea indotta dagli oppioidi, che di solito è passiva, e la stitichezza permanente, che richiede un farmaco concomitante obbligatorio. Le singole sostanze si differenziano principalmente per i loro diversi effetti sui recettori mü, kappa e delta.
I principi di base della terapia del dolore si basano sulla somministrazione orale (per bocca) con la scelta di galenici appropriati, a un’ora fissa (per orologio) nel senso di una somministrazione profilattica piuttosto che reattiva, preferibilmente in forma di rilascio prolungato e con un’estensione graduale della terapia (per scala). Qualche anno dopo, sono state aggiunte l’individualizzazione dei regimi terapeutici e la considerazione delle esigenze del paziente per quanto riguarda le misure non farmacologiche. La raccomandazione originaria di accumulare in tutte e tre le fasi non viene più seguita oggi, soprattutto nel caso del dolore tumorale e della probabilità di un rapido aumento del dolore, al fine di contrastare la cronicizzazione del dolore attraverso un’inutile perdita di tempo.
In linea di principio, i preparati della fase 1 possono essere combinati bene con quelli della fase 2 o 3, in quanto l’effetto terapeutico nocicettivo del farmaco della fase 1 può portare ad un effetto di risparmio degli oppioidi. La combinazione dei farmaci della fase 1 tra loro è controversa; ci sono indicazioni di sinergie per l’uso di paracetamolo e metamizolo insieme. Non è consigliabile combinare gli oppioidi di fase 2 e 3, poiché la competizione per il recettore potrebbe far sì che la sostanza più debole abbia effetto.
Gli oppioidi
Gli oppioidi sono farmaci centrali nelle cure palliative e spesso sono indispensabili per un controllo efficace dei sintomi. Vale quindi la pena di esaminare più da vicino alcuni aspetti del trattamento con queste sostanze.
Ci sono ancora molti miti che circondano la somministrazione di oppioidi, non solo tra i pazienti, ma anche tra i medici. L’uso della morfina è spesso equiparato all’inizio della fine, perché la sostanza è vista come una riserva di ferro per morire. Pertanto, è necessario discutere con il paziente l’indicazione alla somministrazione di oppioidi, che è chiaramente giustificabile nel controllo dei sintomi, principalmente il dolore o anche la mancanza di respiro. Attraverso una spiegazione dettagliata della modalità d’azione e degli obiettivi terapeutici, anche i pazienti più scettici possono essere motivati a sottoporsi al trattamento. Questo include l’informazione che con una dose stabile di oppioidi, ad esempio tramite un sistema transdermico, non è vietato nemmeno guidare l’auto – se non ci sono altri impedimenti dovuti alla malattia.
Dipendenza: la seconda paura riguarda la dipendenza. Naturalmente, la dipendenza fisica si sviluppa durante il trattamento con oppioidi, vale a dire che se il bisogno di antidolorifici diminuisce grazie alla terapia causale, un preparato oppioide deve essere eliminato lentamente, altrimenti si verificheranno i classici sintomi fisici di astinenza. La dipendenza psicologica di solito non si sviluppa, soprattutto se la terapia viene effettuata con preparati retard o con applicazione transdermica. Un’eccezione è rappresentata dalla petidina, dove viene descritta la dipendenza, soprattutto quando la sostanza viene somministrata per via endovenosa. Pertanto, si raccomanda di evitare la somministrazione di questa sostanza. In alcuni casi, si verifica una certa assuefazione, nel senso di una tachifilassi. In termini di diagnosi differenziale, in caso di perdita di effetto, si deve sempre prendere in considerazione una progressione tumorale e rivalutare la possibilità di un controllo causale del dolore, anche in ambito palliativo.
Dosaggio ed effetti collaterali: Soprattutto i medici inesperti nel gestire le dosi talvolta elevate di oppioidi temono il pericolo di depressione respiratoria. Se utilizzata correttamente, questo pericolo non esiste, poiché l’effetto della morfina può essere valutato molto bene dal punto di vista clinico. Un esempio di inizio di terapia con morfina è riportato nella tabella 2.

Nella fase di titolazione, gli effetti collaterali indesiderati si manifestano per primi, cioè i pazienti lamentano nausea e costipazione senza alcun effetto analgesico. Questo è spesso il momento in cui la terapia viene interrotta a causa dell’intolleranza e dell’inefficacia. Dopo l’aumento della dose, la sedazione si verifica in misura maggiore o minore prima che si instauri l’analgesia. Questa dose analgesicamente efficace è chiamata “finestra terapeutica” e rappresenta la dose target. Purtroppo, la finestra terapeutica non è sempre aperta allo stesso modo, per cui una volta determinata la dose, questa deve sempre essere corretta verso l’alto o verso il basso. Prima di raggiungere la dose critica per quanto riguarda la depressione respiratoria, si verificano stati confusionali e sintomi neurologici, in particolare contrazioni muscolari, per cui la dose deve essere ridotta se si verificano questi sintomi.
Anche la scelta dell’oppioide in termini di eliminazione, renale o epatica, gioca un ruolo. In questo caso, nella scelta della preparazione si devono prendere in considerazione anche le possibili complicazioni a livello degli organi. L’ossicodone e l’idromorfone sono spesso superiori ad altri oppioidi in questo senso. In linea di principio, non esiste un limite massimo alla dose della maggior parte degli oppioidi, ma il controllo del dolore determina la quantità. Soprattutto con gli agonisti parziali, tuttavia, può verificarsi un effetto tetto, cioè un ulteriore aumento della dose non provoca un aumento dell’effetto. Si raccomanda quindi una rotazione verso un’altra sostanza. La secchezza delle fauci, la ritenzione urinaria, la costipazione e l’ortostasi non devono essere limitanti per la dose.
Farmaci concomitanti: la questione dei farmaci concomitanti è spesso controversa. Iniziamo sempre il trattamento antiemetico con metoclopramide, la sostanza più potente per la nausea indotta da oppioidi, oltre all’oppioide. È possibile che alcuni pazienti vengano trattati in modo eccessivo. Tuttavia, per i pazienti che sperimentano questo sintomo sgradevole, c’è spesso un’avversione tale agli oppioidi che provare di nuovo richiede spesso un lungo periodo di tempo, durante il quale il dolore viene sopportato piuttosto che trattato adeguatamente. Di norma, la nausea è solo passiva e il farmaco concomitante può essere interrotto dopo qualche giorno. Tuttavia, in alcuni casi persiste, quindi l’antiemetico deve essere mantenuto. A volte la rotazione degli oppioidi, cioè il passaggio a un’altra sostanza, è necessaria per controllare questo effetto collaterale.
Purtroppo, la stitichezza fastidiosa è permanente e di solito richiede una terapia permanente con lassativi, eventualmente con più di un preparato. In questo caso, il preparato combinato Oxycontin e naloxone può in parte facilitare la terapia.
In sintesi, si deve affermare che in una situazione di dolore progressivo, l’uso di oppioidi spesso non può essere evitato e che una combinazione di analgesici di livello 1 con farmaci analgesici comedici non è un’alternativa al necessario trattamento con oppioidi. L’allergia alla morfina è molto rara. In nessun caso il prurito, che è un effetto degli oppioidi dovuto all’irritazione dei recettori corrispondenti, deve essere interpretato erroneamente come un’allergia. Come spiegato sopra, la comparsa di nausea non è un’allergia.
Una buona conoscenza delle sostanze utilizzate è importante per una terapia di successo. È necessario conoscere la durata d’azione, l’insorgenza dell’azione, l’eventuale effetto tetto, le interazioni e gli effetti collaterali. A volte l’effetto collaterale può essere utilizzato anche per la terapia, ad esempio per la diarrea. Una corretta prescrizione ospedaliera o domiciliare comprende la dose unitaria, la dose massima giornaliera, la preparazione, il calendario e la dose di riserva per il dolore improvviso, che di solito è 1⁄6-1⁄10 della dose giornaliera e può essere somministrata fino a ogni ora, a seconda della situazione. L’obiettivo è ottenere un dolore basso con un’intensità del dolore sulla scala VA inferiore a quattro; se ci sono più di cinque dosi di riserva al giorno, è indicato un aumento del farmaco di base.
A seconda del carattere del dolore, ha senso l’aggiunta di co-analgesici, ad esempio l’uso di antiepilettici o antidepressivi per le componenti del dolore neuropatico. Se si ritiene che l’edema sia un fattore che contribuisce, si deve prendere in considerazione la somministrazione di glucocorticoidi e si possono utilizzare anche neurolettici o miorilassanti. Tuttavia, l’uso di questi preparati è in parte limitato dall’intensificazione della fatica già esistente legata al cancro.
I motivi del fallimento della terapia analgesica possono essere una diagnosi errata del dolore o una sottovalutazione dell’intensità del dolore, una terapia inadeguata dei sintomi concomitanti (ad esempio, ansia o depressione), una dose sbagliata, intervalli troppo lunghi o l’evitamento di farmaci potenti. Tuttavia, anche con il trattamento del dolore eseguito lege-artis, ci sono fallimenti terapeutici che giustificano il coinvolgimento di un anestesista esperto in terapia del dolore. In questo caso potrebbe essere necessario ricorrere a procedure invasive.
Sempre, l’affermazione di Dame Cicley Saunders: “Il dolore è ciò che il paziente dice che è” deve essere fondamentale.
Christel Nigg, MD
Nic Zerkiebel, MD
Letteratura:
- Neuenschwander H, et al: Palliativmedizin, Krebsliga Schweiz, 2a edizione rivista, 2006.
- Beubler E: Kompendium der medikamentösen Schmerztherapie, 4a edizione rivista, Springer WienNew York, 2008.
- Gallacchi G, et al: Schmerzkompendium, 2a edizione, Thieme-Verlag, 2005.
- Raccomandazioni Breakthrough Pain, ed.: Società Svizzera di Medicina Palliativa, Cura e Assistenza, palliative ch palliative.ch 2006.
- Eychmüller St: Il senso fa senso, Therapeutische Umschau 2012; 69(2): 87-90.
- Büche D.: Valutazione e strumento di valutazione nelle cure palliative, Therapeutische Umschau 2012; 69(2): 81-86.
- Strategia nazionale per le cure palliative 2010-2012, Ufficio federale della sanità pubblica (UFSP) 2009. www.admin.ch/palliativecare
- Criteri di indicazione per le cure palliative specialistiche www.bundespublikationen.admin.ch
- Antonovsky A: Salutogenesi. Sulla demistificazione della salute. Edizione tedesca di Alexa Franke. dgvt-Verlag, Tübingen 1997.
- Idratazione alla fine della vita, raccomandazioni di Bigorio: Ed.: Società Svizzera di Medicina Palliativa, Cure e Assistenza, palliative ch, 2011.
- Kunz R: Le cure palliative sono un approccio globale all’assistenza, non una nuova specialità, Schweizerische Ärztezeitung, 2006 (87): 1106.
- Accademia Svizzera delle Scienze Mediche ASSM: Cure palliative. Linee guida e raccomandazioni di etica medica, 2006.
- Bruera E, et al: L’Edmonton Symptom Assessment System (ESAS): un metodo semplice per la valutazione dei pazienti in cure palliative. J of Palliative Care 1991 (7): 6-9.
- Saunders C: Cicley Saunders Morire e vivere: la spiritualità nelle cure palliative. Tradotto dall’inglese. di Martina Holder-Franz.
InFo Oncologia & Ematologia 2014; 2(3): 10-14











