Un chiarimento approfondito della causa delle crisi epilettiche è essenziale per una decisione terapeutica. Il gran numero di preparati disponibili consente una terapia individuale per la persona colpita. Il rischio di recidiva è un fattore decisivo nella decisione di un trattamento precoce.
La farmacoterapia è stata la base del trattamento dell’epilessia sin dalla scoperta dei primi farmaci efficaci contro le crisi. Tutte le sostanze attualmente disponibili hanno un effetto puramente sintomatico di soppressione delle crisi e non influenzano la fisiopatologia sottostante, motivo per cui si dovrebbe parlare di un anticonvulsivante e non di un farmaco antiepilettico. Tuttavia, poiché non tutte le crisi epilettiche sono “convulsive” – cioè con contrazioni muscolari – il termine anticonvulsivi non è del tutto esatto. L’Istituto di Medicina (IOM) propone che le sostanze utilizzate per trattare le crisi epilettiche siano chiamate “farmaci per le crisi” [1].
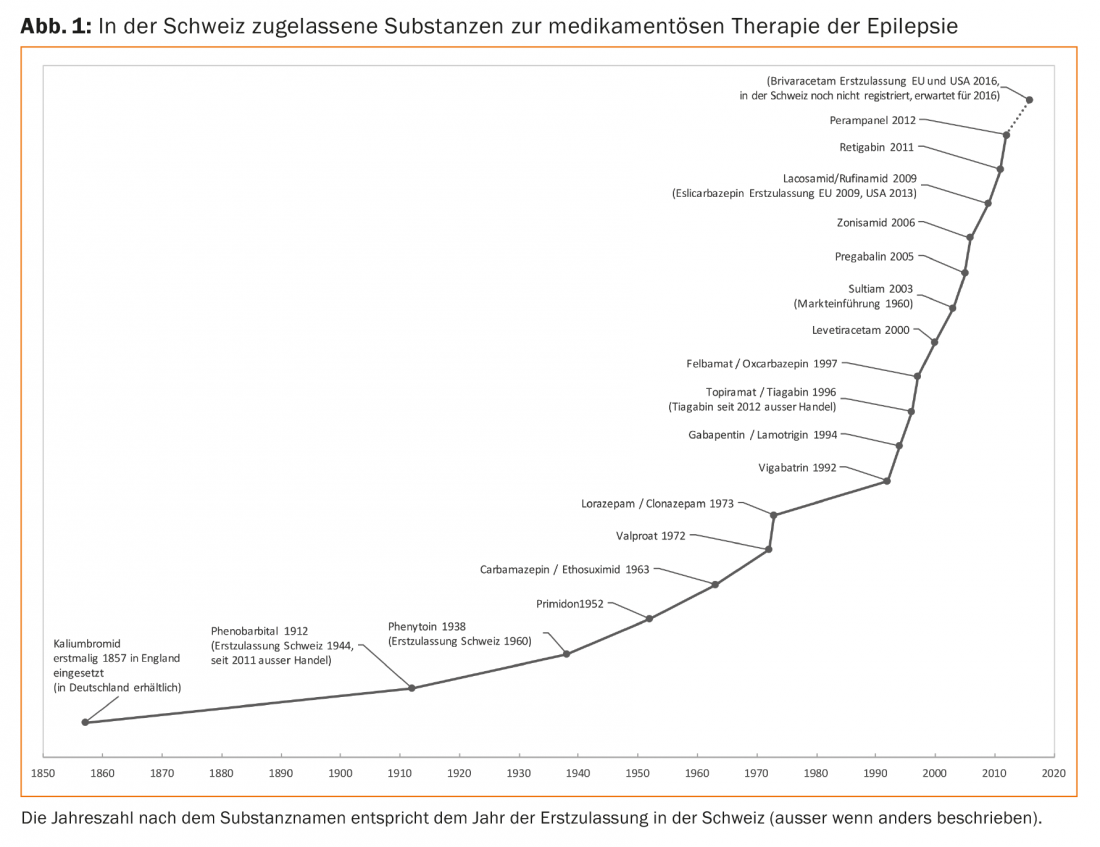
Oltre alle vecchie sostanze standard ancora in uso, come fenitoina, primidone, carbamazepina, etossimide e acido valproico, sono disponibili altre sostanze (Fig. 1). Ormai, alcuni di questi nuovi farmaci per le crisi epilettiche sono in uso da molto tempo, quindi i loro vantaggi e svantaggi sono ben noti.
Trattamento già dopo la prima crisi non provocata?
Un chiarimento approfondito della causa delle crisi epilettiche è essenziale per una decisione terapeutica. Secondo l’ultima classificazione dell’epilessia della Lega Internazionale contro l’Epilessia (ILAE), la diagnosi di epilessia può essere fatta già dopo una prima crisi non provocata se, in base ai risultati dei chiarimenti corrispondenti, c’è un rischio di recidiva per un’ulteriore crisi di almeno il 60% in dieci anni e il rischio di recidiva è quindi altrettanto alto che dopo due crisi non provocate.
Se esiste un rischio elevato di recidiva, secondo le linee guida internazionali, come quelle della Società tedesca di neurologia, la terapia anticonvulsivante può essere iniziata anche dopo una prima crisi non provocata. Nel complesso, tuttavia, si tratta di solito di una decisione terapeutica individuale che tiene conto anche dell’atteggiamento del paziente nei confronti dei farmaci, della paura degli effetti collaterali e anche del bisogno di sicurezza del paziente (e dei suoi familiari) o della disponibilità a correre rischi [2].
Due grandi studi multicentrici (FIRST – First Seizure Trail Group; MESS – Multicentre Epilepsy and Single Seizure Study) hanno esaminato il rischio di recidiva e la prognosi a lungo termine con il trattamento immediato delle crisi rispetto a quello ritardato [3–6]. In entrambi gli studi, il trattamento immediato dopo una prima crisi epilettica non provocata ha dimostrato di ridurre il rischio di recidiva rispettivamente del 50% e del 30%; tuttavia, la metà dei partecipanti allo studio non ha avuto una seconda crisi. L’inizio precoce del trattamento non ha avuto alcun effetto sulla frequenza delle crisi dopo tre e cinque anni in entrambi gli studi.
Secondo i dati dello studio MESS, il numero necessario da trattare (NNT) per prevenire un’ulteriore crisi epilettica è di 14 dopo una prima crisi e di 5 dopo una seconda crisi epilettica. La prognosi a lungo termine per la terapia non peggiora se si attende una possibile seconda crisi epilettica [4,5].
In generale, molti studi hanno dimostrato che il rischio di recidiva è più alto poco dopo il primo attacco. L’80-90% dei pazienti che hanno ulteriori crisi ha una ricaduta entro i primi due anni. Tuttavia, i risultati degli studi attualmente disponibili sono spesso difficili da trasferire alla routine clinica odierna, poiché, ad esempio, nello studio MESS, l’imaging strutturale non è stato effettuato in tutti i partecipanti allo studio. Questo è ora richiesto dalle linee guida ed è anche una pratica comune, poiché le lesioni cerebrali strutturali comportano un aumento del rischio di recidiva e possono quindi essere motivo di una terapia anticonvulsivante precoce [7–9].
Tuttavia, lo stato attuale degli studi non consente una raccomandazione generale sul fatto che la terapia anticonvulsivante sia già indicata dopo la prima crisi epilettica. Tuttavia, ci sono risultati di esami rispetto. Diagnosi per le quali si deve ipotizzare un aumento del rischio di recidiva e che sono quindi motivo di farmacoterapia anticipata (tab. 1).

Terapia anticonvulsivante iniziale
In genere si consiglia di iniziare con una monoterapia e di dosarla prima. La scelta di un farmaco per la terapia iniziale non è facile, dato il gran numero di farmaci disponibili. Tuttavia, ci sono alcuni criteri che devono essere considerati nel processo di selezione: Tipo di crisi, classificazione della sindrome epilettica, sesso, malattie concomitanti, farmaci concomitanti e urgenza del trattamento. In generale, circa il 60-70% dei pazienti adulti diventa libero da crisi con il primo farmaco anticonvulsivante somministrato. Quando si sceglie una sostanza, si deve prendere in considerazione anche la tollerabilità e l’influenza delle comorbidità, poiché circa il 60% dei pazienti deve assumere il farmaco per il controllo delle crisi per il resto della vita.
Secondo le linee guida, tutti i farmaci anticonvulsivi sono adatti alla monoterapia iniziale nelle epilessie focali, ad eccezione dell’etosuccimide, che viene utilizzata solo nei casi di assenze (crisi petit mal).
La lamotrigina e il levetiracetam hanno dimostrato di essere ugualmente efficaci; sono preferiti alla carbamazepina per la migliore tollerabilità [10]. Il levetiracetam, in particolare, è spesso utilizzato nella pratica clinica di routine perché non deve essere dosato per un lungo periodo, non induce enzimi e comporta meno interazioni con altri farmaci. Il levetiracetam e la lamotrigina di solito non provocano quasi crisi nelle epilessie generalizzate idiopatiche (IGE), a differenza, ad esempio, della carbamazepina. Nel recente e ampio studio randomizzato controllato SANAD (Standard And New Antiepileptic Drugs), la lamotrigina è risultata superiore a carbamazepina, gabapentin e topiramato in termini di tempo di interruzione del trattamento e di effetti collaterali non tollerabili nelle epilessie focali (braccio A) [11]. In un altro studio, il pregabalin è risultato meno efficace in un confronto diretto con la lamotrigina [12].
Le monoterapie iniziali adatte per l’epilessia generalizzata o non classificata includono valproato, lamotrigina e topiramato, che sono stati confrontati nel braccio B dello studio SANAD [13]. Il valproato ha mostrato una migliore efficacia rispetto alla lamotrigina e una migliore tollerabilità rispetto al topiramato. Per ottenere la libertà dalle crisi a un anno, il topiramato era paragonabile al valproato.
Trattamento delle donne in età fertile
Una contraccezione affidabile è indicata per le donne in età fertile trattate con anticonvulsivi. Bisogna prestare attenzione alle interazioni clinicamente rilevanti dei contraccettivi con i farmaci per le crisi (ad esempio con la lamotrigina), in quanto entrambi i contraccettivi possono indebolire l’effetto dei farmaci per le crisi e viceversa. Per la maggior parte delle sostanze più recenti, attualmente non ci sono dati sufficienti per consentire una valutazione definitiva di un possibile effetto sul nascituro. In un ampio studio di registro, le donne trattate con farmaci per le crisi epilettiche durante la gravidanza sono risultate avere un rischio molto basso di malformazioni congenite maggiori, pari solo al 4,2% (tasso di malformazioni del 2-4% nella popolazione normale) [14]. Uno studio danese non ha evidenziato un aumento del rischio di gravi difetti alla nascita in caso di assunzione di un nuovo farmaco per le crisi epilettiche durante la gravidanza [15]. In uno studio pubblicato nel 2014, il topiramato è stato associato a un possibile ritardo nella crescita del nascituro [16].
Il valproato deve essere usato con grande cautela nelle donne in età fertile. I motivi sono il rischio teratogeno e l’effetto negativo sullo sviluppo cognitivo a lungo termine dei bambini esposti al valproato in utero [17]. Sulla base dei dati attuali, la raccomandazione è di utilizzare il valproato solo se assolutamente necessario e poi in forma a lento rilascio e con una dose il più possibile bassa, preferibilmente inferiore a 1000 mg/d.
Ulteriore trattamento dopo un trattamento iniziale non riuscito
La farmacoresistenza si ha quando non si ottiene una libertà duratura dalle crisi dopo adeguati tentativi di trattamento con due farmaci antiepilettici tollerati, adatti e a dosi sufficientemente elevate (in monoterapia o in combinazione). In seguito, la diagnosi di epilessia deve essere rivista criticamente, ad esempio con un video-EEG di 24 ore, e devono essere ricercate anche le diagnosi differenziali. Si dovrebbe anche considerare precocemente un eventuale intervento chirurgico per l’epilessia. Le possibili cause di resistenza al trattamento sono elencate nella tabella 2.

In linea di principio, tutte le sostanze approvate sono concepibili per un trattamento combinato. Si consiglia cautela con la somministrazione contemporanea di bloccanti dei canali del sodio, in quanto può portare a effetti collaterali più gravi nel sistema nervoso centrale. Le nuove sostanze approvate per la terapia combinata, alcune delle quali hanno un diverso meccanismo d’azione, come lacosamide, rufinamide, retigabina e perampanel, fanno sperare che, in casi individuali, si possa ancora ottenere la libertà dalle crisi attraverso effetti sinergici e additivi nei casi di farmacoresistenza.
Uso dei generici
La terapia iniziale può essere effettuata senza problemi con un preparato generico. I farmaci generici possono anche essere utilizzati o sostituiti per l’epilessia che non è ancora stata trattata con successo. A causa della biodisponibilità variabile e del conseguente aumento del rischio di crisi epilettiche, il passaggio dal farmaco originatore al farmaco generico, dal farmaco generico al farmaco originatore o persino da un farmaco generico all’altro in pazienti senza crisi epilettiche dovrebbe essere scartato [18].
Interruzione della terapia
Ci sono pochi dati affidabili sulla questione dell’interruzione dei farmaci dopo molti anni di assenza di crisi. La pratica clinica consiste nel continuare a somministrare il farmaco finché non si verificano effetti collaterali gravi. L’interruzione è consigliata solo quando la situazione che scatena le crisi non è più presente. Inoltre, alcune forme di epilessia infantile e adolescenziale possono “crescere”. Prima di interrompere la terapia, la persona interessata deve essere informata sulle possibili conseguenze dell’interruzione della terapia.
Letteratura:
- Epilessia attraverso lo spettro: promuovere la salute e la comprensione – Istituto di Medicina [Internet], 2012. www.iom.edu/epilepsy
- Elger CE: Prima crisi epilettica e epilessie in età adulta – Cosa c’è di nuovo? Le raccomandazioni più importanti in sintesi. Definizione e classificazione 2016; 1-23.
- Gruppo di prova del primo sequestro (Gruppo FIR.S.T.): Studio clinico randomizzato sull’efficacia dei farmaci antiepilettici nel ridurre il rischio di ricaduta dopo una prima crisi tonico-clonica non provocata. Neurologia 1993; 43(3 Pt 1): 478-483.
- Musicco M, et al: Il trattamento della prima crisi tonico-clonica non migliora la prognosi dell’epilessia. Gruppo di prova del primo sequestro. Neurologia 1997; 49(4): 991-998.
- Marson A, et al: Trattamento immediato rispetto a quello differito con farmaci antiepilettici per l’epilessia precoce e le crisi singole: uno studio randomizzato controllato. Lancet 2005; 365(9476): 2007-2013.
- Kim LG, et al: Previsione del rischio di recidiva di crisi dopo una singola crisi ed epilessia precoce: ulteriori risultati dello studio MESS. Lancet Neurol 2006; 5(4): 317-322.
- Eickhoff SB, et al.: Connettività anatomica e funzionale delle aree citoarchitettoniche all’interno dell’opercolo parietale umano. J Neurosci 2010; 30(18): 6409-6421.
- Hauser W, et al: Recidiva delle crisi dopo una prima crisi non provocata: un follow-up esteso. Neurologia 1990; 40(8): 1163-1170.
- Krumholz A, et al: Linea guida basata sull’evidenza: Gestione della prima crisi epilettica non provocata negli adulti: Rapporto del Sottocomitato per lo Sviluppo delle Linee Guida dell’Accademia Americana di Neurologia e della Società Americana di Epilessia. Neurologia 2015 ottobre; 85(17): 1526-1527.
- Rosenow F, et al: Lo studio LaLiMo: lamotrigina rispetto a levetiracetam nelle 26 settimane iniziali di monoterapia per l’epilessia focale e generalizzata – uno studio multicentrico in aperto, prospettico, randomizzato e controllato. J Neurol Neurosurg Psychiatry 2012; 83(11): 1093-1098.
- Marson AG, et al: Lo studio SANAD sull’efficacia di carbamazepina, gabapentin, lamotrigina, oxcarbazepina o topiramato per il trattamento dell’epilessia parziale: uno studio randomizzato controllato non in cieco. Lancet 2007; 369(9566): 1000-1015.
- Kwan P, et al: Efficacia e sicurezza di pregabalin rispetto a lamotrigina nei pazienti con crisi parziali di nuova diagnosi: uno studio di fase 3, in doppio cieco, randomizzato, a gruppi paralleli. Lancet Neurol 2011; 10(10): 881-890.
- Marson AG, et al: Lo studio SANAD sull’efficacia di valproato, lamotrigina o topiramato per l’epilessia generalizzata e non classificabile: uno studio randomizzato controllato non in cieco. Lancet 2007; 369(9566): 1016-1026.
- Morrow J, et al: Rischi di malformazione dei farmaci antiepilettici in gravidanza: uno studio prospettico del Registro Epilessia e Gravidanza del Regno Unito. J Neurol Neurosurg Psychiatry 2006; 77(2): 193-198.
- Mølgaard-Nielsen D, Hviid A: Farmaci antiepilettici di nuova generazione e rischio di gravi difetti alla nascita. JAMA 2011; 305(19): 1996-2002.
- Veiby G, et al: Restrizione della crescita fetale e difetti alla nascita con farmaci antiepilettici di nuova e vecchia generazione durante la gravidanza. J Neurol 2014; 261(3): 579-588.
- Meador KJ, et al: Esposizione fetale ai farmaci antiepilettici ed esiti cognitivi all’età di 6 anni (studio NEAD): uno studio prospettico osservazionale. Lancet Neurol 2013; 12(3): 244-252.
- Rueegg S, et al.: Uso di farmaci antiepilettici generici nella terapia dell’epilessia – Dichiarazione della Lega Svizzera contro l’Epilessia (SLgE). Arco svizzero di neurologia e psichiatria 2012; 163(3): 104-106.
InFo NEUROLOGIA & PSICHIATRIA 2016; 14(3): 8-11