La pleura è coinvolta in circa il 30% di tutte le malattie che colpiscono il sistema respiratorio. Questo è spesso caratterizzato dalla comparsa di un’effusione. L’incidenza totale dei versamenti pleurici nei Paesi industrializzati occidentali è di circa 300/100.000 persone.
La pleura è coinvolta in circa il 30% di tutte le malattie che colpiscono il sistema respiratorio. Questo è spesso caratterizzato dalla comparsa di un’effusione. L’incidenza totale dei versamenti pleurici è elevata, circa 300/100.000 nei Paesi industrializzati occidentali. Le malattie cardiache, epatiche e renali concomitanti sono solitamente transudate con una quota del 40-46%. Gli essudati che richiedono una chiarificazione sono stimati fino al 60% in una popolazione mista di pazienti di medicina interna. Queste si dividono in 40-45% di cause infiammatorie-microbiche, 20-30% di effusioni maligne e 10-18% di effusioni reattive, ad esempio nel tromboembolismo. Il resto comprende cause rare e versamenti idiopatici.
Di base
Lo spazio pleurico misura circa 5-30 µm. Normalmente, nella cavità pleurica si trovano fino a 15 ml di liquido pleurico, un filtrato microvascolare della pleura parietale. La pressione pleurica deriva dalla forza di espansione della parete toracica, dalla forza di retrazione elastica del polmone, nonché dalla pressione idrostatica capillare e dalla pressione oncotica. Il risultato è un leggero afflusso di liquido nello spazio pleurico. Il fluido viene scambiato attraverso i vasi linfatici della pleura parietale, di solito circa 15-30 ml per 24 ore e per emitorace. Questo può essere aumentato a 500 ml. I cambiamenti nei rapporti di pressione, nei rapporti di drenaggio o l’aumento della produzione nel contesto di processi infiammatori o maligni portano infine allo sviluppo di un versamento pleurico; il primo di solito si traduce in un trasudato, il secondo in un essudato.
L’ecografia toracica, procedura disponibile quasi ovunque, o la tomografia computerizzata possono mostrare le alterazioni pleuriche meglio, molto meglio dell’immagine panoramica toracica. Consentono una classificazione descrittiva. Vengono registrati il carattere e l’estensione delle alterazioni pleuriche, la presenza di un versamento, le sue dimensioni, la cameratura, il rapporto delle alterazioni con il polmone e la parete toracica. Inoltre, è possibile eseguire una biopsia mirata con l’aiuto di tecniche di imaging. Ma possono anche rivelare indizi eziologici, come i trombi centrali come indizio di embolia polmonare.
W. Frank ha suggerito quattro domande chiave per impostare la diagnosi: (1) è necessario eseguire una toracentesi? (2) si tratta di un trasudato o di un essudato? (3) qual è l’eziologia di base del versamento in caso di essudato? (4) Quando sono indicate quali tecniche bioptiche? Già la diagnosi di effusione porta con un’alta probabilità a un chiarimento (fino al 75% dei casi). L’aggiunta di procedure endoscopiche-bioptiche porta a un aumento a oltre il 90%. Questa è la base dell’algoritmo presentato.
Puntura pleurica – Toracentesi
La toracentesi è indicata quando è presente un versamento e le considerazioni cliniche non sono chiaramente a favore del trasudato. Oggi, la puntura viene solitamente eseguita con il supporto ecografico. Gli aghi non devono essere sottodimensionati per poter rimuovere il materiale viscoso, se necessario. L’anestesia locale può essere utile, ma non è sempre necessario eseguirla, poiché la puntura di prova pura difficilmente supera l’estensione della puntura anestetica. In caso di cameratura, possono essere necessarie più punture, ma possono anche risultare in risultati diversi. Le effusioni bilaterali di solito non richiedono un work-up invasivo su entrambi i lati, poiché si correlano in modo predominante per quanto riguarda i parametri chiave. Un campione di 20-30 ml di versamento è sufficiente per la diagnosi. Un prelievo di quantità maggiori viene solitamente effettuato per indicazione terapeutica, per ridurre la distress respiratoria e spesso è una misura di emergenza.
Prime fasi di valutazione
Per prima cosa, l’effusione viene valutata visivamente. Si distinguono l’effusione chiara o torbida e il pus (empiema), così come l’effusione sanguinolenta o chilosa. Anche l’odore è un criterio importante. Il cattivo odore spesso caratterizza l’empiema. La sedimentazione e la centrifugazione possono rivelare una torbidità dovuta ai detriti cellulari. La determinazione dell’emoglobina o dell’ematocrito permette di distinguere tra versamento emorragico ed emotorace. La diagnosi differenziale tra i versamenti chilosi e pseudocilosi è possibile determinando i trigliceridi nel versamento.
Analisi chimica
Il passo successivo è l’analisi del contenuto proteico. Esiste una classificazione in trasudato o essudato in base ai criteri di luminosità. Se esiste una chiara malattia esplicativa per un trasudato, la dottrina generale è che non è necessario procedere ulteriormente con la diagnosi. Inoltre, un’effusione maligna è ampiamente esclusa se è presente un trasudato. I trasudati passivi sono stati descritti nella linfangiosi carcinomatosa della pleura o nel linfoma maligno della pleura, per cui occasionalmente la diagnosi deve essere estesa anche in caso di trasudati. Anche le punture ripetute e le terapie come i farmaci diuretici possono portare a un cambiamento. La determinazione aggiuntiva della LDH può essere utile per individuare i trasudati il cui contenuto proteico è aumentato solo a causa della terapia diuretica. In caso di essudato, tuttavia, di solito sono necessari ulteriori chiarimenti.
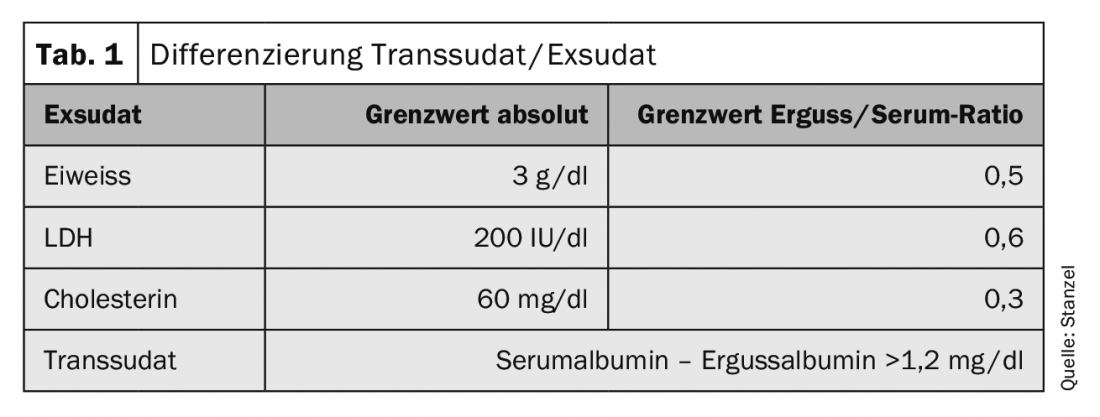
Un passo decisivo è la determinazione delle proteine nel liquido pleurico (tab. 1) . La significatività viene migliorata valutando il valore pleurico in relazione al valore sierico. Un’analisi aggiuntiva del livello di LDH nel versamento pleurico in relazione al valore sierico migliora la sensibilità. La determinazione del colesterolo può contribuire a un’ulteriore differenziazione. In caso di versamento chiloso, oltre ai risultati visivi caratteristici, la determinazione dei trigliceridi o dei chilomicroni porta alla diagnosi. La demarcazione degli “pseudoesudati” può essere difficile. Si tratta di transudati cronici o di transudati modificati dalla terapia diuretica. La determinazione dell’amilasi nel versamento può rivelare un’associazione con la pancreatite acuta e cronica o la perforazione esofagea. Anche altri parametri possono essere inclusi nella diagnosi. A seconda della malattia di base, può essere utile la determinazione di neutrofili, pH, NT-proBNP o fattore reumatoide o altri parametri.
La determinazione del valore del pH è importante sia nell’effusione parapneumonica che in quella maligna. Un pH ≤7,30 si riscontra solitamente solo nell’empiema, raramente nel versamento tubercolare o nel versamento pleurico maligno avanzato. In combinazione con la diminuzione del glucosio, questo indica un ispessimento pleurico e l’inibizione del trasferimento tra circolazione sanguigna e spazio pleurico. Per la determinazione del pH, il fluido ottenuto viene analizzato come un’analisi dei gas nel sangue. Il pH e la depressione del glucosio sono una misura della gravità e dell’estensione di un processo pleurico.
La diagnosi di un’effusione tubercolare è particolarmente impegnativa. Una linfocitosi pronunciata nell’effusione, valori elevati di proteine e LDH con glucosio simultaneamente abbassato possono essere indicazioni di un’eziologia tubercolare. L’individuazione microscopica e culturale della tubercolosi non è facile e ha successo solo nel 25% circa dei casi in media. La sensibilità può essere aumentata determinando l’adenosina deaminasi (ADA), un enzima infiammatorio associato ai macrofagi e alle cellule T, con un cut-off di 47 U/ml nel test enzimatico. Sono utili le tecniche di amplificazione del DNA per rilevare le sequenze di DNA specifiche per il Mycobacterium tuberculosis. Questi possono consentire una rapida individuazione della pleurite tubercolare. Tuttavia, le sensibilità e le specificità variano maggiormente. La diagnosi non dovrebbe quindi mai basarsi solo su un singolo reperto.
Citologia
L’esame citologico dell’effusione è una procedura molto semplice e ampiamente utilizzata e dovrebbe già essere inclusa nell’esame iniziale del versamento pleurico, ad eccezione del trasudato. La malignità può essere già dimostrata da un reperto citologico positivo, sia per infiltrazione maligna della pleura che per coinvolgimento pleurico da metastasi. Tuttavia, i risultati degli studi variano molto, a seconda della malattia tumorale e della sua estensione. I pazienti con un’effusione maligna e un pH dell’effusione inferiore a 7,30 avevano risultati citologici positivi nel 78%. Con un pH dell’effluente superiore a 7,30, questo valore è sceso solo al 51%. I metodi di biologia molecolare e cellulare consentono nuovi approcci. I marcatori infiammatori e oncologici sono ormai consolidati. L’immunocitologia, in particolare, consente una diagnosi più precoce e più sensibile. Inoltre, l’uso di un pannello di marcatori diversi rende più facile la diagnosi differenziale tra mesotelioma e adenocarcinoma.
Biopsia con ago
L’aggiunta di una biopsia della pleura, se l’esame citologico iniziale non ha chiarito la situazione, è oggi controversa e quasi mai utilizzata. Solo la biopsia pleurica contribuisce in modo significativo a chiarire la pleurite tubercolare. In uno studio su 254 pazienti, i granulomi caseosi erano rilevabili nelle agobiopsie nel 79,8% dei pazienti; gli altri potevano essere confermati da esami culturali. Il tasso di chiarificazione dipende dal numero di biopsie e raggiunge l’optimum quando vengono effettuate sei o più biopsie o quando viene rilevato tessuto pleurico in almeno due delle biopsie. Nel caso di un’alta incidenza di tubercolosi, la combinazione di determinazione dell’ADA, predominanza di linfociti e agobiopsia offre il più alto tasso diagnostico per l’essudato inspiegabile.
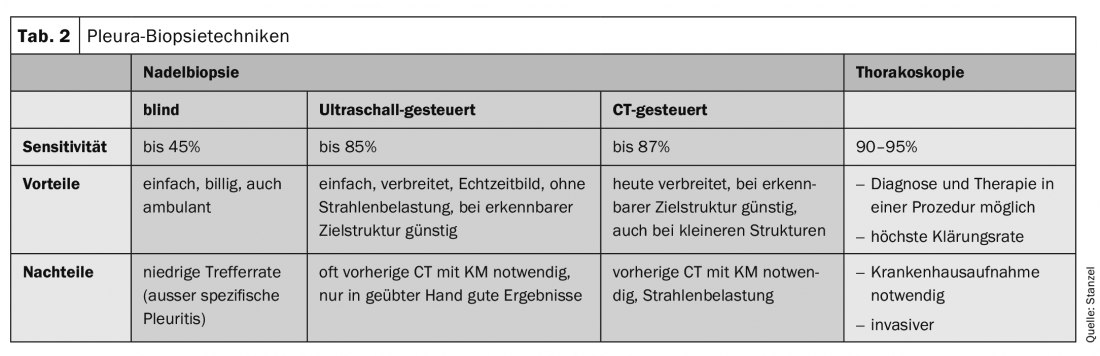
Nell’effusione maligna, l’agobiopsia alla cieca è molto meno sensibile della citologia dell’effusione. Rispetto alla toracoscopia, anche l’agobiopsia è chiaramente inferiore (36% contro 87%). In combinazione con le moderne tecniche di imaging, come l’ecografia del torace o la TAC, le diagnosi definitive vengono effettuate più frequentemente. La qualità delle biopsie con l’ago da taglio automatico è eccellente, perché sono ottenute per lo più senza artefatti e corrispondono a cilindri di punzonatura tagliati senza problemi. L’agobiopsia sotto controllo ecografico o TC-guidata dà buoni risultati, soprattutto quando è possibile rilevare un ispessimento pleurico o una nodularità, che può essere mirata con l’ago sotto il controllo dell’imaging (tab. 2).
Toracoscopia
Dopo aver esaurito le possibilità menzionate finora, una percentuale non trascurabile di circa il 20-25% delle effusioni rimane inspiegabile. L’algoritmo è poi seguito dalla toracoscopia come passo successivo. La pura attesa con follow-up (“wait and see”) è di solito un’opzione solo per i pazienti gravemente malati e in pessime condizioni generali. Se il chiarimento definitivo è utile, desiderato e non ci sono controindicazioni e i risultati della toracoscopia sono suscettibili di cambiare la procedura, deve essere eseguita. Un altro argomento a favore della toracoscopia è spesso l’opzione aggiuntiva della pleurodesi toracoscopica, soprattutto nei casi di versamenti grandi e/o ricorrenti. Ciò significa che la diagnosi e la terapia interventistica vengono effettuate in un’unica fase.
Jacobaeus eseguì la toracoscopia per la prima volta nel 1910 per diagnosticare la pleurite essudativa. Dagli anni ’70, con Brandt e Loddenkemper in Germania e Boutin in Francia, questo metodo si è affermato in Europa per la chiarificazione delle malattie pleuriche e dei versamenti pleurici. In combinazione con la moderna tecnologia video, questo ha dato origine alla toracoscopia video in qualità HD che oggi è comune (Fig. 1).

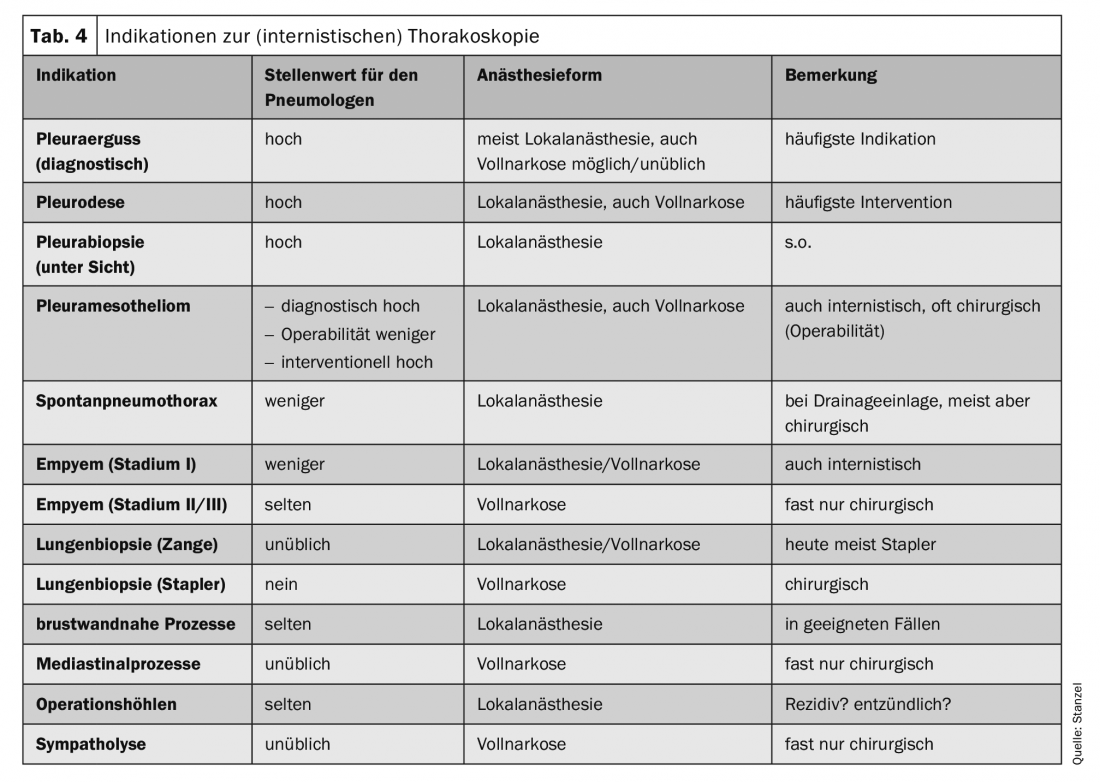
Classicamente, la toracoscopia interna – in inglese “medical thoracoscopy” – viene eseguita in anestesia locale in sedazione in sale endoscopiche con strumenti riutilizzabili e ha un carattere prevalentemente diagnostico (tab. 3) . Tuttavia, esistono anche opzioni terapeutiche nelle mani dello pneumologo interventista. La toracoscopia, soprattutto quella interventistica, può quindi essere eseguita anche in anestesia generale. Le indicazioni per la toracoscopia sono elencate nella tabella 4. La rispettiva indicazione è strettamente legata alla forma di anestesia e alla tecnica. In Germania, solo la chiarificazione e la terapia del versamento pleurico e la biopsia pleurica sotto ispezione visiva sono ancora diffuse e maggiormente accettate come indicazioni di medicina interna.
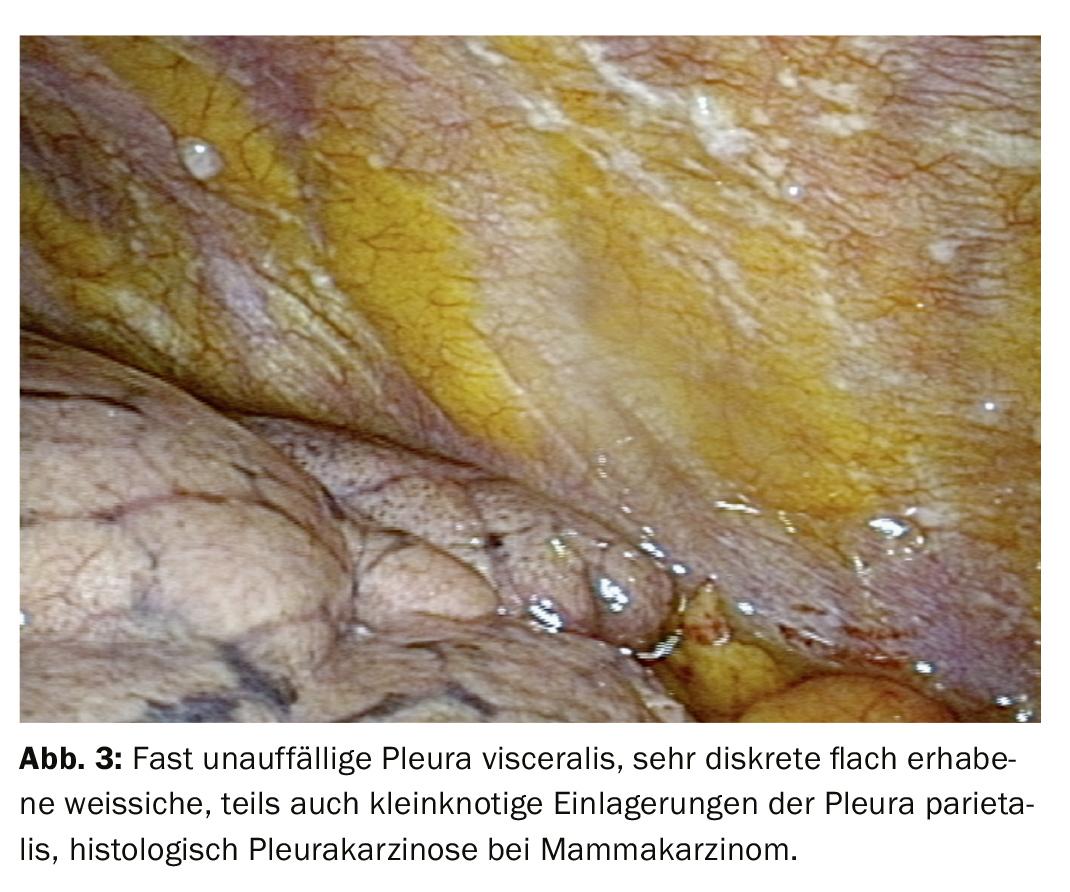
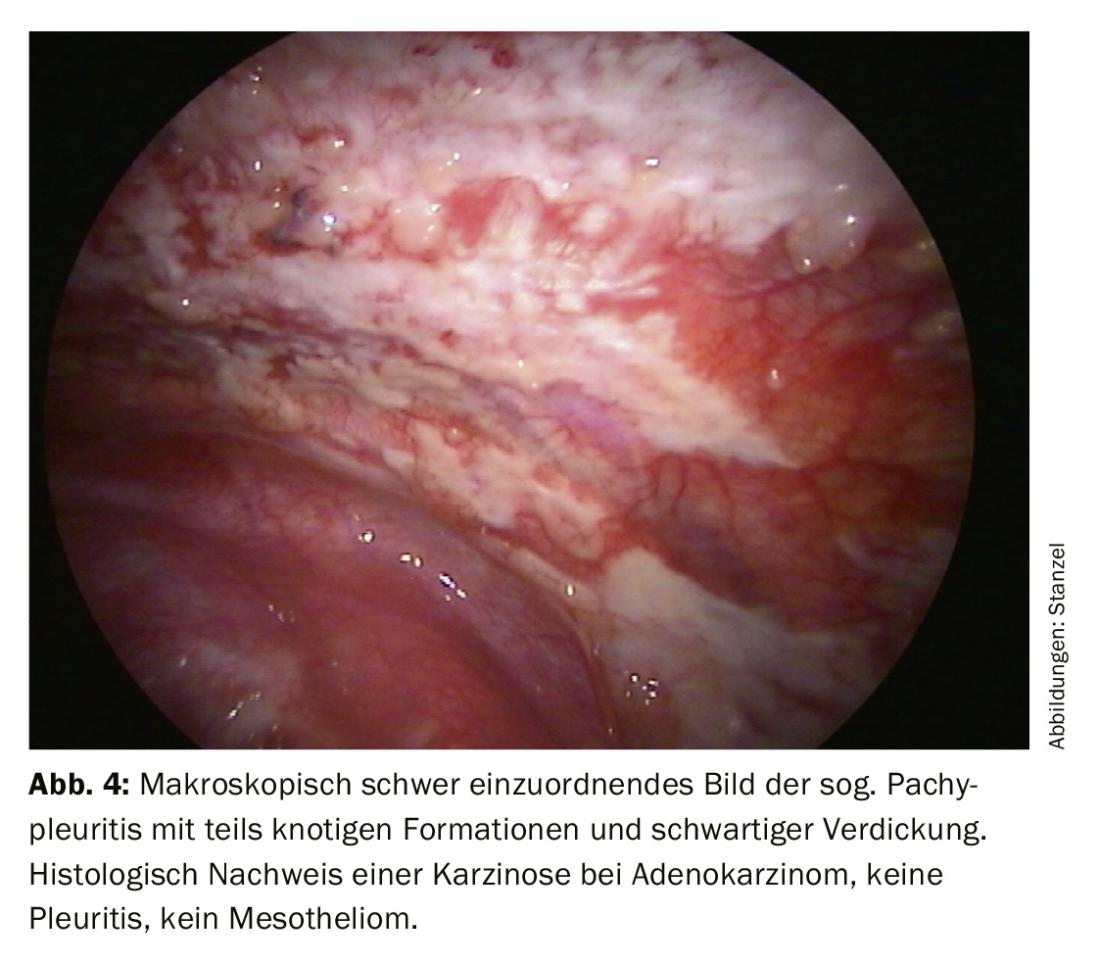
Dopo un processo diagnostico a tappe, di solito l’attenzione si concentra sulla differenziazione di un evento infiammatorio da un versamento maligno (Fig. 2). L’istologia delle biopsie con pinze della pleura consente una classificazione più chiara. Nella moderna oncologia, tuttavia, anche l’ulteriore elaborazione del tessuto tumorale gioca un ruolo importante, perché le analisi molecolari possono avere un’influenza decisiva sulla terapia, soprattutto nel caso del carcinoma polmonare. Pertanto, può essere importante fornire non solo materiale citologico, ma anche biopsie più grandi da esaminare, che possono essere facilmente ottenute tramite biopsia diretta con pinze o criobiopsia durante la toracoscopia, anche se sono evidenti solo manifestazioni tumorali discrete. (Fig.3). Il mesotelioma pleurico come importante diagnosi differenziale del versamento maligno è chiaramente diminuito di frequenza. Ma anche in questo caso, la migliore differenziazione e classificazione istologica basata sul materiale bioptico ottenuto durante la toracoscopia può essere una buona indicazione (Fig. 4).
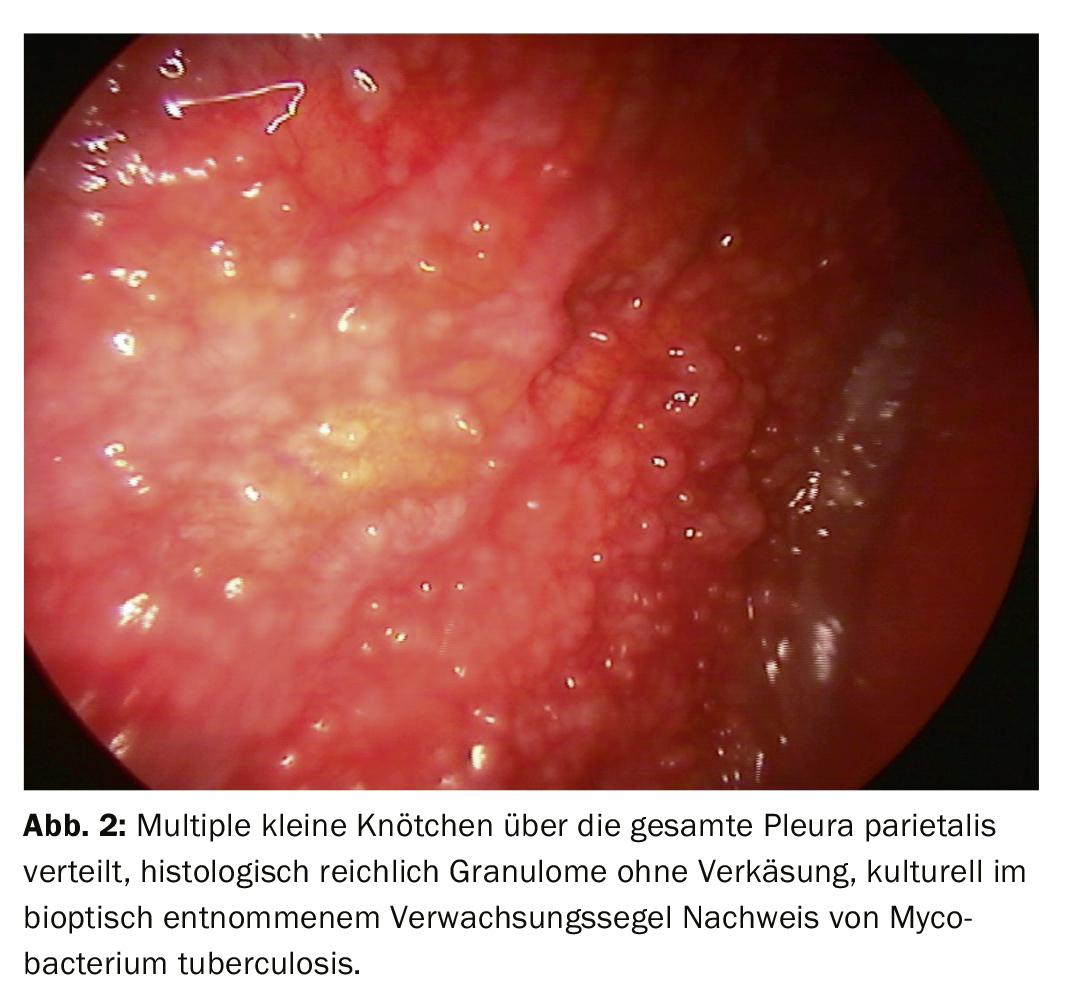
Alcuni pneumologi vedono anche un’indicazione per la toracoscopia interna nella fase iniziale di un versamento parapneumonico o di un empiema, ma più da un punto di vista terapeutico. Più il quadro clinico si evolve verso l’empiema complicato, più viene presa in considerazione la VATS da parte del chirurgo toracico, perché lo sbrigliamento diventa sempre più importante. Se la differenziazione della pleurite dalla pleurite specifica non è possibile con sufficiente certezza con la diagnostica meno invasiva, la toracoscopia porta a un tasso di chiarificazione >del 90%. Oltre all’elaborazione istologica e microbiologica supplementare dei campioni di tessuto, i materiali ottenuti durante lo sbrigliamento (depositi di fibrina, vele e camere) devono essere consegnati per un ulteriore esame (Fig. 2) . Per queste domande, il materiale deve anche essere trattato in modo adeguato (soluzione salina, lavorazione rapida). Le tecniche altamente sensibili come la PCR sono meno spesso necessarie.
In caso di pneumotorace, la toracoscopia viene ora solitamente eseguita come VATS dal chirurgo toracico, se c’è un’indicazione all’intervento. In alcuni centri, si sostiene o si è sostenuto che se si inserisce un drenaggio toracico in caso di pneumotorace sintomatico, una toracoscopia interna può anche determinare molto bene l’ulteriore strategia, che può essere effettuata attraverso lo stesso accesso prima dell’inserimento del drenaggio. Tuttavia, poiché le raccomandazioni per il pneumotorace si stanno attualmente orientando verso la puntura singola con cateteri a piccolo lume come terapia iniziale, la toracoscopia interna non viene quasi mai eseguita con questa indicazione.
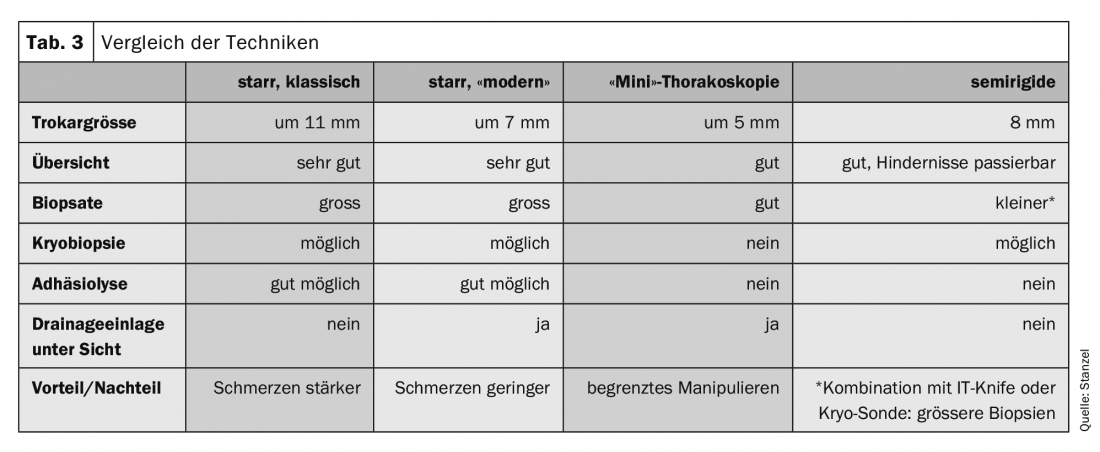
L’attrezzatura per l’esecuzione della toracoscopia è costituita da strumenti rigidi come il trocar con manicotto, la valvola, l’ottica, la pinza e l’aspirazione. (Tab. 3, 5). Per l’esame in anestesia locale, oggi sono comuni strumenti con diametri più piccoli, di solito intorno a 6-7. mm. Si utilizzano anche strumenti più grandi con diametro di 10-12 mm, principalmente in anestesia generale. diametro di mm sono utilizzati, ma non sono quasi più comuni. Un diametro maggiore dello strumento causa anche più dolore e disagio durante e dopo la toracoscopia. La “minitoracoscopia” viene eseguita con strumenti ancora più piccoli, di circa 3 mm di diametro; il manicotto ha quindi un diametro esterno di circa 5-6 mm. Quindi la procedura è meno invasiva e meno dolorosa. I risultati sono paragonabili alla procedura standard.
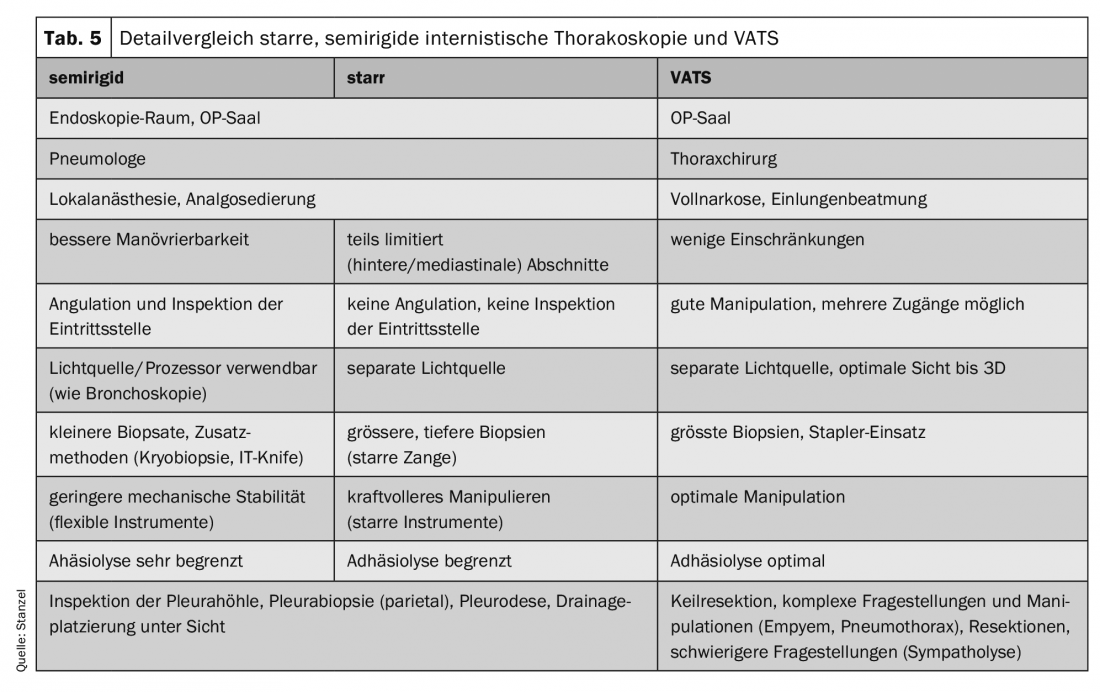
In alternativa, è stato sviluppato uno strumento semirigido che assomiglia a un broncoscopio flessibile e può essere spostato intorno agli ostacoli grazie all’opzione di angolazione. Gli svantaggi principali sono biopsie più piccole e spesso la rimozione della biopsia è più difficile rispetto alla pinza rigida. Tuttavia, questi svantaggi possono essere parzialmente compensati utilizzando tecniche aggiuntive (coltello elettrico con elettrocauterizzazione o tecnica di criobiopsia).
Il pneumotorace necessario per l’esame viene creato passivamente con l’immissione di aria ambiente, di solito dopo o con la rimozione di un versamento, oppure attivamente con un insufflatore. La localizzazione del versamento e la creazione del pneumotorace sono più facili da realizzare sotto controllo ecografico. Uno pneumotorace può essere eseguito in modo sicuro anche in caso di versamenti minimi o di assenza di versamenti. Il controllo in fluoroscopia è oggi poco diffuso. Nella maggior parte dei casi, l’esame viene effettuato attraverso un solo accesso. Occasionalmente può essere necessario creare un secondo accesso, soprattutto in presenza di aderenze, per visualizzare ulteriori aree e prelevare biopsie.
I risultati della toracoscopia sono migliori nella carcinomatosi pleurica (Fig. 3, 4). L’agobiopsia chiarisce il 44%, la citologia il 62%, la toracoscopia da sola il 95%, in combinazione con le altre procedure il 97%. Nel mesotelioma maligno, la toracoscopia contribuisce in modo significativo alla conferma istologica, sebbene sia più difficile. Ciò comporta una stadiazione esatta e la determinazione della procedura successiva. Si può anche chiarire se una resezione è promettente. Per la pleurite tubercolare, le cifre da chiarire sono: agobiopsia 51%, + coltura 61%, toracoscopia (+ coltura) 99% (Fig. 2).
Un vantaggio della toracoscopia è una diagnosi più accurata. In uno studio francese, sono state analizzate 168 toracoscopie interne. In 66 pazienti, la diagnosi è stata di pleurite non specifica dopo l’intero work-up diagnostico. Solo in 34 casi la diagnosi è stata confermata dalla toracoscopia. D’altra parte, 16 avevano un mesotelioma maligno, 10 una carcinomatosi pleurica con adenocarcinoma, 3 un carcinoma indifferenziato e 3 una pleurite specifica. Relativamente spesso, l’intera procedura successiva cambia a seguito della diagnosi finalmente effettuata per via toracoscopica. La procedura è stata modificata in 155 dei 182 pazienti.
La biopsia della pleura viene effettuata sotto visione diretta e il numero di biopsie prelevate deve essere compreso tra 2 e 6. In ogni caso, dovrebbe essere disponibile anche materiale sufficiente dal punto di vista macroscopico, soprattutto se si effettuano ulteriori diagnosi complete, come è comune oggi (immunoistologia, analisi molecolare). Se manca una struttura bersaglio chiara, è necessario sottoporre a biopsia più aree. La biopsia deve essere eseguita in posizione parietale sulla costola. Le biopsie viscerali sono associate al rischio di una perdita d’aria prolungata, quelle nello spazio intercostale al sanguinamento dal vaso intercostale o alla lesione del nervo. Sollevando e tirando lateralmente, spesso la pleura può essere tirata via come un arazzo e si può ottenere una biopsia più grande in modo sicuro. Durante il processo, i pazienti possono muoversi e diventare irrequieti anche sotto analgesia, quando sono doloranti. Un’ulteriore iniezione locale è insolita e di solito non necessaria. Di norma, il materiale bioptico viene posto in formalina e processato istologicamente. In caso di causa infettiva, soprattutto se si sospetta una causa specifica, il materiale deve essere posto in soluzione fisiologica e trasferito rapidamente a un laboratorio appropriato. La biopsia elettrochirurgica o la criobiopsia sono nuovi modi per aumentare la resa, soprattutto quando si lavora con lo strumento semirigido.
I pazienti che hanno un versamento pleurico maligno e sono sintomatici spesso hanno un versamento esteso. La chemioterapia non è sempre un trattamento promettente, soprattutto quando il distress respiratorio legato all’effusione è la preoccupazione principale e deve essere affrontato rapidamente. In questo caso, la toracoscopia offre contemporaneamente un’opzione terapeutica con l’esecuzione della pleurodesi, di solito con un’ulteriore insufflazione di talco. Le percentuali di successo sono solitamente indicate come >90%.
Una controindicazione assoluta alla toracoscopia è l’adesione e l’aderenza dello spazio pleurico, come può verificarsi nei processi maligni avanzati, in particolare il mesotelioma pleurico. Anche i processi infiammatori e l’empiema possono causarlo, così come un precedente intervento chirurgico o una pleurodesi. Le controindicazioni relative includono la dispnea marcata o l’ipossiemia non dovuta al versamento. Altri sono una situazione cardiovascolare instabile, una condizione di emorragia, una tosse insaziabile e una marcata ipertensione polmonare o obesità.
La thoacoscopia interna è una procedura sicura e caratterizzata da un basso tasso di complicanze, se eseguita da un esaminatore esperto e qualificato. La linea guida BTS sulle malattie pleuriche riporta una mortalità dello 0,34%, che spesso è a carico della poudrage di talco. Altre complicazioni come empiema, emorragia, metastasi del dotto, perdita d’aria, pneumotorace o polmonite si verificano fino all’1,8%, e complicazioni minori come enfisema sottocutaneo, emorragia minore, infezione locale, ipotensione o febbre fino al 7,3%. La toracoscopia semirigida ha tassi di complicanze leggermente inferiori rispetto alla toracoscopia rigida. Una complicazione grave è il sanguinamento da un vaso intercostale, che di solito può essere evitato. A quel punto, potrebbe essere necessaria una procedura chirurgica toracica. Pertanto, a volte si raccomanda di eseguire la toracoscopia solo se è disponibile un chirurgo toracico in caso di emergenza.
Sommario
La toracoscopia interna è una procedura diagnostica sicura, con poche complicazioni e un alto tasso diagnostico. Le caratteristiche essenziali sono la minore invasività rispetto alla VATS, il minore impegno e i minori costi. Questo pone la toracoscopia alla fine di un flusso di lavoro (algoritmo) che porta a chiarire la causa della malattia pleurica in oltre il 90% e offre anche opzioni terapeutiche, utilizzate più comunemente nel versamento maligno, ma anche nel versamento parapneumonico o nell’empiema e nello pneumotorace.
Messaggi da portare a casa
- In caso di versamento pleurico non chiaro, il tasso di chiarificazione mediante toracoscopia interna sale a oltre il 90%.
- La toracoscopia interna è una procedura minimamente invasiva eseguita in anestesia locale e analgesia.
- La sonografia del torace ha sostituito la fluoroscopia come tecnica aggiuntiva nella pianificazione e nell’esecuzione della toracoscopia.
- Se ci sono lesioni pleuriche circoscritte, un’agobiopsia ecografica o TC può chiarire la situazione; in caso di cambiamenti diffusi, la toracoscopia è di solito l’unica opzione.
- Il versamento maligno ricorrente può essere chiarito diagnosticamente per via toracoscopica in una sola seduta e definitivamente eliminato con una poudrage di talco.
Letteratura:
- Light R: Malattie della pleura. Baltimora, MD: Lippincott Williams & Wilkins 2007.
- Collins TR, Sahn SA: Toracocentesi. Valore clinico, complicazioni, problemi tecnici ed esperienza del paziente. Chest 1987; 91(6): 817-822.
- Seijo LM, Sterman DH: Polmonologia interventistica. N Engl J Med 2001; 344(10): 740-749.
- Hooper CE, Lee YCG, Maskell NA: Creazione di un servizio specializzato in malattie pleuriche. Respirologia 2010; 15(7): 1028-1036.
- Stanzel F, Ernst A: Diagnostica delle malattie della pleura. Pneumologe 2008; 5: 211-218.
- Frank W. Procedura diagnostica nel versamento pleurico. Pneumologia 2004; 58: 777-790.
- Ferrer J: Versamento pleurico tubercoloso ed empiema tubercoloso. Sem Crit Care Med 2001; 6/22: 637-646.
- Rodriguez-Panadero F, Janssen JP, Astoul P: Toracoscopia: panoramica generale e ruolo nella diagnosi e nella gestione del versamento pleurico. Eur Resp J 2006; 28: 409-421.
- Rahman NM, a nome del Gruppo Guida sulla Malattia Pleurica della British Thoracic Society. Toracoscopia in anestesia locale: Linea guida della British Thoracic Society sulla malattia pleurica 2010. Thorax 2010; 65(suppl 2): ii54-ii60.
- Loddenkemper R: Toracoscopia – stato dell’arte. Eur Resp J 1998; 11: 213-221.
- Rodriguez-Panadero F, Janssen JP, Astoul P: Toracoscopia: panoramica generale e ruolo nella diagnosi e nella gestione del versamento pleurico. Eur Resp J 2006; 28: 409-421.
- Tassi G, Marchetti G: Minitoracoscopia: un approccio meno invasivo alla toracoscopia. Chest 2003; 124: 1975-1977.
- Pyng L, Mathur PN, Colt HG: I progressi della toracoscopia: 100 anni da Jacobaeus. Respirazione 2010; 79: 177-186.
- Alraiyes AH, Dhillon SS, Harris K, et al: Toracoscopia medica: tecnica e applicazione. PLEURA 2016; 3: 1-11.
- Janssen JP: Perché è necessaria o meno la toracoscopia. Eur Respir Rev 2010; 19: 117, 213-216.
- Woolhouse I, a nome del Gruppo di sviluppo delle linee guida sul mesotelioma della BTS: Linea guida della British Thoracic Society per l’indagine e la gestione del mesotelioma pleurico maligno. Thorax 2018; 73: i1-i30.
- Blanc FX, Atassi K, Bignon J, Housset B: Valore diagnostico della toracoscopia medica nella malattia pleurica – Uno studio retrospettivo di 6 anni. Chest 2002; 121: 1677-1683.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2020; 2(1): 8-14