La terapia di sistema del carcinoma a cellule renali sta cambiando. Diversi inibitori della tirosin-chinasi possono prolungare significativamente la sopravvivenza negli stadi metastatici. Anche le immunoterapie sono efficaci.
Il carcinoma a cellule renali rappresenta circa il 2-3% di tutti i tumori maligni. L’incidenza globale nel 2012 è stimata in 338.000 casi con 144.000 decessi associati al tumore. Il carcinoma a cellule renali è quindi al 13° posto a livello mondiale in termini di incidenza [1–3] . Dopo il carcinoma della prostata e il carcinoma uroteliale della vescica urinaria, è il terzo tumore urologico più comune. Il termine “tumore renale” copre un ampio spettro di tumori eterogenei e diverse entità istopatologiche. I tre sottotipi più comuni sono il carcinoma a cellule chiare, il carcinoma papillare e il carcinoma a cellule renali cromofobe, che insieme rappresentano circa l’85-90% di tutti i tumori renali maligni e di cui il sottotipo a cellule chiare ha la prognosi peggiore [4]. In circa il 10-15% dei casi, i tumori renali sono benigni [5]. I tumori renali benigni più comuni sono l’oncocitoma e l’angiomiolipoma.
Epidemiologia
L’età principale di insorgenza del carcinoma a cellule renali è tra i 60 e i 70 anni [5,6]. Gli uomini sono colpiti più spesso delle donne, circa 1,5:1. I fattori di rischio sono il fumo, l’obesità, l’ipertensione e l’insufficienza renale cronica [5,6]. Una piccola percentuale di carcinomi a cellule renali è ereditaria, per cui vale la pena menzionare la sindrome di Von Hippel-Lindau (VHL), la sclerosi tuberosa e la sindrome di Birt-Hogg-Dubé.
Diagnostica
La maggior parte dei carcinomi a cellule renali oggi viene diagnosticata incidentalmente, cioè come reperto incidentale in un esame di imaging con un’altra domanda medica e sono asintomatici al momento della diagnosi iniziale. Di conseguenza, i tumori del rene sono più spesso diagnosticati in fase precoce rispetto al passato, il che ha portato al cosiddetto “spostamento di stadio” negli ultimi decenni [5,6]. La classica triade sintomatologica di dolore al fianco, macroematuria e tumore addominale palpabile è oggi molto rara. Tuttavia, se sono presenti questi sintomi locali, di solito si tratta di un caso di malattia tumorale già localmente avanzata e metastatizzata, con una prognosi consecutiva sfavorevole. L’esame fisico generale ha un ruolo piuttosto subordinato nella diagnosi del carcinoma a cellule renali. Tuttavia, i varicoceli di nuova insorgenza o l’edema degli arti inferiori possono essere indicazioni di spazio retroperitoneale, che di conseguenza dovrebbero essere esclusi dalla diagnostica per immagini [6]. I tumori renali possono causare diversi sintomi paraneoplastici [6].
I risultati renali anormali all’ecografia devono essere ulteriormente chiariti con una tomografia computerizzata (TC) multifase con contrasto o con una risonanza magnetica. In casi particolari, può essere utile l’ecografia con contrasto [5]. Le lesioni che occupano spazio nel rene sono generalmente suddivise in lesioni solide e cistiche. Le lesioni cistiche sono state suddivise in cinque categorie (I, II, IIF, III, IV) per la valutazione della dignità TC, utilizzando la classificazione BOSNIAK [7,8]. I reperti di categoria III e IV sono considerati maligni fino a prova contraria; è quindi indicato un chiarimento istologico. Nelle masse solide del rene, la captazione locale del mezzo di contrasto (CM) applicato è un importante criterio di malignità [5].
L’esatta localizzazione del tumore (centrale, periferica, in prossimità dell’ilo o del pielon, ecc.), l’estensione locale del tumore, l’eventuale coinvolgimento vascolare (ad esempio, trombi tumorali nella vena renale e nella vena cava) e gli ingrossamenti linfonodali sospetti vengono valutati con la TAC o la risonanza magnetica, in modo da poter effettuare una stadiazione accurata secondo l’attuale classificazione TNM (Tab. 1) [5,6]. La differenziazione degli angiomiolipomi e degli oncocitomi senza grasso dai processi maligni può causare difficoltà nella diagnostica per immagini [9]. Se si sospetta la presenza di un carcinoma a cellule renali, è necessario eseguire una TAC supplementare del torace per escludere le metastasi polmonari [5].

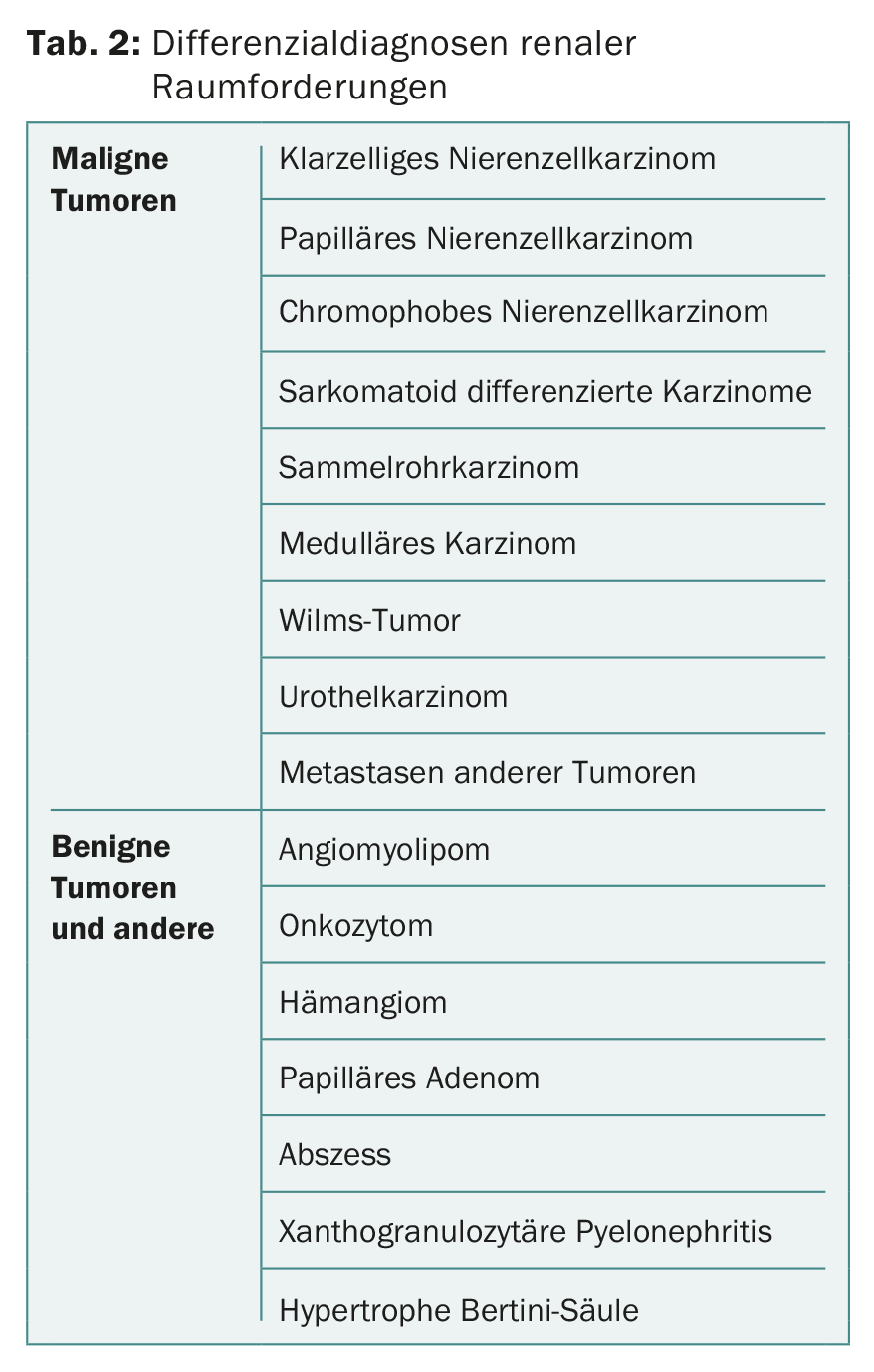
Mentre un tempo la biopsia percutanea del tumore renale era praticamente controindicata a causa dei timori di metastasi da stent, oggi viene eseguita sempre più frequentemente. La biopsia è particolarmente importante per le lesioni radiologicamente poco chiare, per i tumori renali di piccole dimensioni prima dell’inserimento in una strategia di sorveglianza attiva, prima della terapia ablativa locale o nella malattia tumorale metastatica per l’acquisizione dell’istologia [5,6,9]. Nel caso di tumori renali metastatizzati, ciò consente di scegliere una terapia sistemica adeguata. Una biopsia del tumore del rene permette anche di differenziare le metastasi da altri tumori primari. La biopsia può essere eseguita per via ecografica o sotto guida TC. Le possibili diagnosi differenziali delle masse renali sono mostrate nella tabella 2.
Stabilizzazione
La stadiazione clinica del carcinoma a cellule renali si basa sull’attuale classificazione TNM (Tab. 1) [5,10]. Il sistema di classificazione OMS/ISUP (Organizzazione Mondiale della Sanità/Società Internazionale di Patologia Urologica) sostituisce il sistema di classificazione istologica sviluppato negli anni ’80 e più utilizzato a livello internazionale, analogo a quello di Fuhrmann [5,11,12].
Terapia chirurgica
La terapia standard per il carcinoma a cellule renali è solitamente l’asportazione chirurgica completa del tumore [9]. Nel carcinoma a cellule renali localizzato, questo viene fatto con intento curativo. Storicamente, la nefrectomia radicale è stata il gold standard per molto tempo [6]. Oggi, a seconda della posizione e delle dimensioni del tumore renale, si dovrebbe puntare a una tecnica chirurgica con risparmio del nefrone, nel senso di una resezione parziale del rene. La sopravvivenza tumore-specifica nel carcinoma a cellule renali localizzato sembra essere paragonabile dopo la resezione parziale del rene e la nefrectomia [5]. Dati retrospettivi suggeriscono che la sopravvivenza complessiva è migliore dopo la resezione parziale del rene per il carcinoma a cellule renali localizzato, rispetto alla nefrectomia [5, 13-15].
Le attuali linee guida dell’EAU raccomandano di eseguire una resezione parziale del rene per il carcinoma a cellule renali di stadio T1 [5]. In linea di principio, questo può essere fatto a cielo aperto, in laparoscopia o con l’ausilio di un robot. Nello stadio T2, la nefrectomia laparoscopica è raccomandata se non è possibile eseguire una resezione parziale del rene [5].
La surrenalectomia omolaterale di routine non sembra fornire alcun beneficio in termini di sopravvivenza e pertanto viene eseguita solo se si sospetta un’infiltrazione tumorale [5]. Le metastasi linfonodali (pN+) sono associate a una prognosi sfavorevole. Tuttavia, i dati sull’importanza della linfoadenectomia sono controversi. Attualmente, secondo le attuali linee guida dell’EAU, la linfoadenectomia è raccomandata solo nei casi di sospetto clinico di metastasi linfonodali (cN+) [5]. Se i linfonodi sono clinicamente poco evidenti, può essere presa in considerazione per tumori differenziati di grandi dimensioni o sarcomatoidi. In caso di carcinoma a cellule renali già metastatizzato, ai pazienti può essere offerta una nefrectomia citoriduttiva prima di iniziare una terapia sistemica, soprattutto nel caso di tumori renali di grandi dimensioni [5].
Alternative all’intervento chirurgico
Nei pazienti anziani con comorbidità rilevanti e/o con un’aspettativa di vita limitata, si possono discutere le alternative alla chirurgia per il carcinoma a cellule renali localizzato. In particolare, i tumori renali piccoli, diagnosticati incidentalmente, possono essere monitorati regolarmente con la diagnostica per immagini in questi pazienti (sorveglianza attiva) [5,9]. Il tasso di crescita di queste lesioni che occupano spazio e il rischio di progressione allo stadio metastatico sono bassi [5,6]. Inizialmente, la conferma istologica della diagnosi mediante una biopsia del tumore renale può essere utile per questo concetto [6]. Non sono stati definiti dei chiari fattori scatenanti per il passaggio al trattamento attivo. Le opzioni di trattamento minimamente invasive, come la crioablazione o l’ablazione con radiofrequenza (RFA), possono essere discusse anche in una popolazione di pazienti selezionati [5,6]. Queste procedure vengono eseguite per via percutanea o con assistenza laparoscopica. La situazione attuale dei dati non consente ancora una valutazione conclusiva di queste terapie per quanto riguarda il controllo del tumore e la morbilità. L’embolizzazione arteriosa selettiva può essere presa in considerazione per i tumori renali non operabili che sono sintomatici, ad esempio con dolore al fianco o macroematuria [5].
Terapia di sistema del carcinoma a cellule renali
Il trattamento sistemico del carcinoma renale a cellule chiare avanzato è fortunatamente migliorato molto negli ultimi anni. Sebbene risponda poco alla chemioterapia, è noto da tempo che le reazioni immunologiche giocano un ruolo. Pertanto, si possono osservare stabilizzazioni più lunghe e persino regressioni delle metastasi polmonari o linfonodali dopo l’asportazione del tumore primario. Nel 9% dei pazienti con carcinoma a cellule renali metastatico, il trattamento con interferone-alfa può produrre remissioni, anche se con una notevole tossicità. Quest’ultima è ancora significativamente più alta con i trattamenti a base di interleuchina 2, ma si possono osservare remissioni impressionanti che durano anni in circa il 10% dei pazienti.
In oltre l’80% dei carcinomi renali a cellule chiare, nel tumore è presente un’alterazione biallelica del gene VHL, con conseguente aumento della formazione di VEGF (“fattore di crescita endoteliale vascolare”), che è un importante fattore di crescita. Diversi inibitori della tirosin-chinasi possono inibire i recettori VEGF (così come altri recettori) e hanno dimostrato di essere farmaci efficaci nel carcinoma a cellule renali metastatico. Hanno sostituito la maggior parte dei farmaci sopra citati.
Nella terapia di prima linea, il sunitinib orale e il pazopanib, altrettanto efficace ma leggermente meno tossico, sono attualmente le opzioni principali. Negli studi randomizzati, sunitinib ha mostrato una risposta nel 31% rispetto al 6% con l’interferone-alfa, allora standard, e un prolungamento della progressione del tumore da cinque a undici mesi. Anche la sopravvivenza è stata prolungata di 4,6 mesi – a 26,4 mesi. Gli effetti collaterali possono includere diarrea, ipertensione, affaticamento, reazioni cutanee, capelli bianchi e disfunzione tiroidea, oltre a disturbi cardiaci. Cabozantinib potrebbe essere più efficace di sunitinib nella terapia di prima linea, secondo un nuovo studio di fase II, ma questo deve ancora essere confermato in uno studio di fase III prima che possa diventare il nuovo standard.
Il suddetto meccanismo d’azione spiega anche l’efficacia dell’anticorpo monoclonale bevacizumab, che lega il VEGF. La combinazione con interferone-alfa è approvata nella terapia di prima linea.
Secondo i dati dello studio, l’inibitore di mTOR everolimus è un’altra opzione per il carcinoma a cellule renali con una prognosi peggiore. I possibili effetti collaterali sono la stomatite e gli effetti collaterali ematologici. Un’indicazione per everolimus è il fallimento della terapia a base di anti-VEGF.
Un inibitore della tirosin-chinasi può essere utilizzato anche nella terapia di seconda linea (come axitinib o sorafenib). L’inibitore della tirosin-chinasi cabozantinib ha prolungato significativamente la sopravvivenza (21,4 vs. 16,5 mesi) nella terapia di seconda linea rispetto a everolimus [16]. La combinazione di lenvatinib con everolimus è stata addirittura in grado di prolungare la sopravvivenza di dieci mesi in uno studio di fase II.
Dati recenti e interessanti mostrano risultati in parte molto buoni con l’immunoterapia (inibitori del checkpoint). Uno studio di fase III su nivolumab nella terapia di seconda linea ha mostrato un prolungamento della sopravvivenza mediana rispetto a everolimus da 5,4 mesi a 25 mesi e un tasso di risposta più elevato del 25% rispetto al 5% [17]. Un altro vantaggio di questa terapia è anche la tossicità generalmente molto più bassa, comprese varie malattie autoimmuni. Tuttavia, noi stessi abbiamo visto pazienti con effetti collaterali gravi (ad esempio, una malattia reumatica invalidante che dura per mesi, come la polimialgia reumatica). Recentemente è stato dimostrato (CHECKMATE-214 all’ESMO 2017) che l’immunoterapia combinata con nivolumab e ipilimumab è superiore alla terapia con sunitinib nella terapia di prima linea, soprattutto quando è espresso PD-L1, con una risposta superiore del 58% rispetto al 25% e un tempo prolungato alla progressione del tumore di 22,8 rispetto a 5,9 mesi. Le immunoterapie stanno quindi entrando nella terapia di prima linea grazie a questi dati attuali. Tuttavia, questa superiorità rispetto a sunitinib non si applica ai pazienti del gruppo a buona prognosi.
La scelta della terapia di terza linea si basa sui trattamenti precedenti e sul loro successo.
Trattamento adiuvante
Gli studi sul trattamento adiuvante dopo l’intervento chirurgico per il carcinoma a cellule renali e nei casi di alto rischio di recidiva con diverse sostanze sono stati negativi e controversi per anni. Dati recenti [18] mostrano che sunitinib per un anno come terapia adiuvante in contesti ad alto rischio può aumentare il tempo alla recidiva da 5,6 a 6,8 anni. Tuttavia, al momento si tratta ancora di un trattamento off-label.
Messaggi da portare a casa
- L’età principale di insorgenza del carcinoma a cellule renali è tra i 60 e i 70 anni.
- A seconda della posizione e delle dimensioni del tumore al rene, si deve puntare, se possibile, su una tecnica chirurgica che risparmi il nefrone.
- La biopsia percutanea del tumore renale viene eseguita con sempre maggiore frequenza al giorno d’oggi.
- La terapia di sistema del carcinoma a cellule renali sta cambiando grazie a nuovi farmaci e combinazioni. Diversi inibitori della tirosin-chinasi possono prolungare significativamente la sopravvivenza negli stadi metastatici. Le immunoterapie (inibitori del checkpoint) sono efficaci anche negli stadi metastatizzati.
- Il trattamento adiuvante è un’opzione se il rischio di recidiva è elevato.
Letteratura:
- Torre LA, et al: Statistiche globali sul cancro, 2012. CA: A Cancer J Clin 2015; 65(2): 87-108.
- Ferlay J, et al: Incidenza e mortalità per cancro nel mondo: fonti, metodi e modelli principali in GLOBOCAN 2012. Int J Cancer 2015; 136(5): 359-386.
- Rete europea dei registri dei tumori: Factsheet sul tumore del rene (KC). Febbraio 2017. www.encr.eu
- Shuch B, et al.: Comprendere le varianti patologiche del carcinoma a cellule renali: estrarre le opportunità terapeutiche dalla complessità biologica. Eur Urol 2015; 67(1): 85-97.
- Ljungberg B, et al: Linee guida EAU sul carcinoma a cellule renali. Associazione Europea di Urologia. Aggiornamento limitato a marzo 2017. www.uroweb.org
- Capitanio U, Montorsi F: Cancro renale. The Lancet 2016; 387: 894-906.
- Israel GM, Bosniak M: Come lo faccio io: valutazione delle masse renali. Radiologia 2005; 236(2): 441-450.
- Warren KS, McFarlane J: La classificazione Bosniak delle masse cistiche renali. BJU Int 2005; 95(7): 939-942.
- Schmid HP: Tendenze nel carcinoma a cellule renali – decorso chiarificatore e terapia localizzata. info@oncologia 2015; 5: 27-30.
- Edge S, et al: Manuale di stadiazione del cancro AJCC. 7ª edizione. New York: Springer-Verlag 2010.
- Moch H: Il sistema di classificazione WHO/ISUP per il carcinoma renale. Patologo 2016; 37(4): 355-360.
- Dagher J, et al: Carcinoma renale a cellule chiare: convalida della classificazione dell’Organizzazione Mondiale della Sanità/Società Internazionale di Patologia Urologica. Istopatologia 2017 Jul 18. DOI: 10.1111/his.13311 [Epub ahead of Print].
- Roos FC, et al: Vantaggio di sopravvivenza della nefrectomia parziale rispetto a quella radicale nei pazienti che presentano un carcinoma a cellule renali localizzato. BMC Cancer 2014; 14(1): 372.
- Zini L, et al: Nefrectomia radicale rispetto a quella parziale: effetto sulla mortalità complessiva e non tumorale. Cancro 2009; 115(7): 1465-1471.
- Huang WC, et al: Nefrectomia parziale rispetto alla nefrectomia radicale nei pazienti con tumori renali di piccole dimensioni: c’è una differenza nella mortalità e negli esiti cardiovascolari? J Urol 2009; 181(1): 55-62.
- Choueiri TK, et al: Cabozantinib versus everolimus nel carcinoma a cellule renali avanzato (METEOR): risultati finali di uno studio randomizzato, in aperto, di fase 3. Lancet Oncol 2016; 17: 917-927.
- Motzer RJ, et al: Nivolumab rispetto a everolimus nel carcinoma a cellule renali avanzato. N Engl J Med 2015; 373: 1803-1813.
- Ravaud A, et al: Sunitinib adiuvante nel carcinoma a cellule renali ad alto rischio dopo la nefrectomia. N Engl J Med 2016; 375(23): 2246-2254.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(6): 23-26