Le plasmocitosi reattive sono rare, ma spesso pronunciate. Devono essere differenziate dalla proliferazione reattiva (policlonale) e monoclonale delle plasmacellule. Una diagnosi differenziale precisa consente una terapia efficace.
La plasmocitosi reattiva è stata descritta per la prima volta nel 1988 come proliferazione policlonale di plasmacellule nel sangue periferico ed è complessivamente rara [1,2]. Le malattie associate alla proliferazione reattiva delle plasmacellule comprendono, da un lato, processi non neoplastici come le malattie autoimmuni, le infezioni e le anemie da carenza di substrato e, dall’altro, processi maligni e neoplastici, in particolare le malattie tumorali ematologiche [3,4]. Nella maggior parte dei casi, l’estensione della proliferazione delle plasmacellule è piccola e spesso limitata al midollo osseo, ma è possibile una plasmocitosi pronunciata che può portare a un sospetto di leucemia plasmacellulare (Tab. 1) .
Rapporto sul caso
Una paziente di 70 anni si è presentata al pronto soccorso di un ospedale regionale a causa di una dispnea acuta aggravata. Due settimane prima, il medico di base aveva iniziato una terapia antibiotica per un quadro clinico di polmonite. A causa della dispnea persistente oltre la terapia antibiotica, è stata eseguita una TAC del torace, che ha rivelato emboli polmonari subsegmentali su entrambi i lati e linfoadenopatie diffuse fino a un diametro massimo di 16 mm. È stata stabilita l’anticoagulazione orale con edoxaban ed è stato pianificato un work-up delle linfoadenopatie.
Al pronto soccorso, il paziente si è presentato tachipnoico con una frequenza respiratoria di 35/min e una saturazione di ossigeno del 93% inferiore a 5 litri di ossigeno al minuto. I segni vitali erano altrimenti come segue: Pressione sanguigna 119/81 mmHg, polso 81/min, temperatura 35,6°C. L’esame fisico ha rivelato suoni respiratori ostruttivi e stridore inspiratorio. Il resto dell’esame fisico era irrilevante. A causa della respirazione ostruttiva, è stata somministrata una dose di prova di 125 mg di metilprednisolone, che ha portato a una parziale regressione della dispnea.
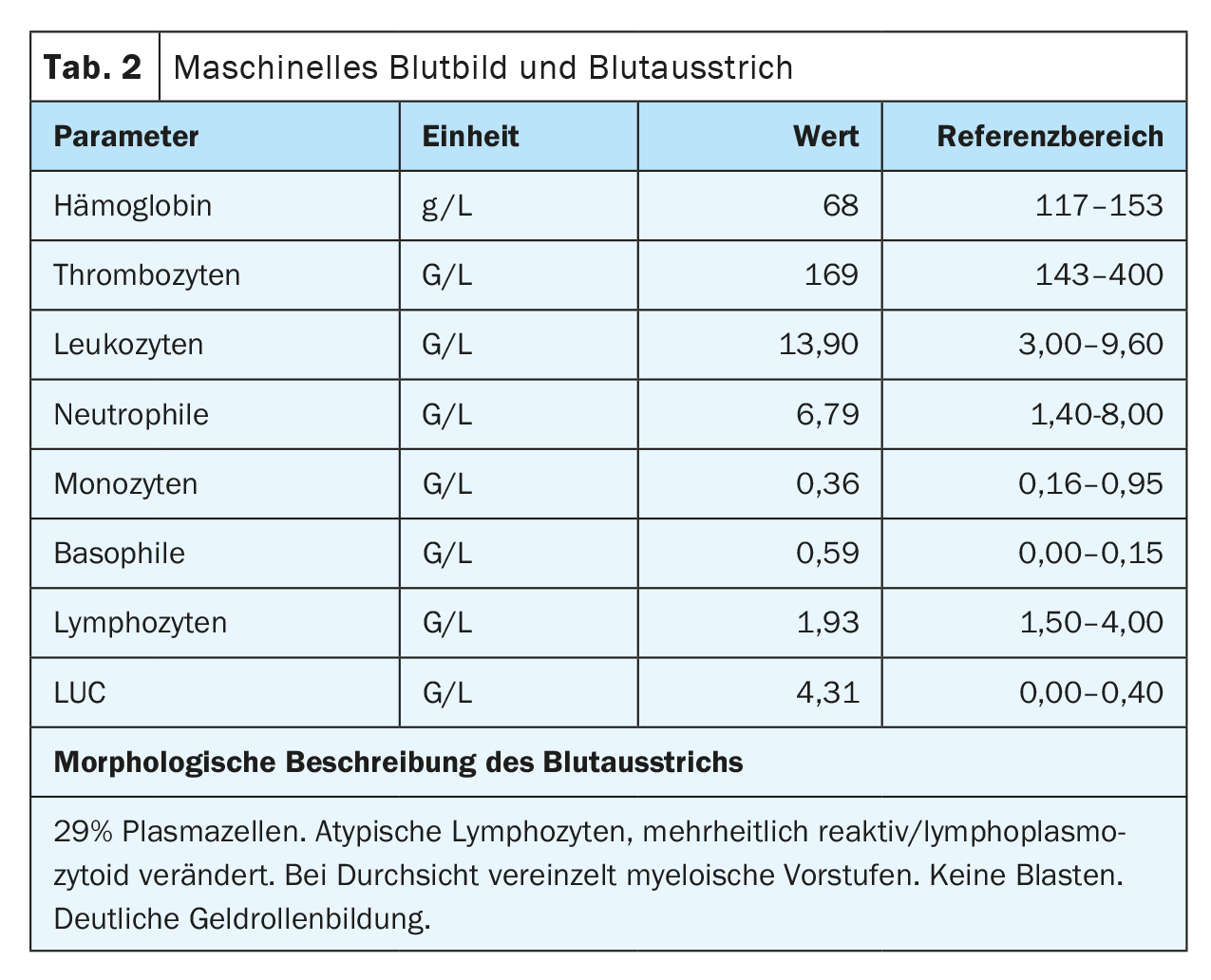
Il sangue periferico ha mostrato un’anemia con un’emoglobina di 77 g/L, valori piastrinici normali e una leucocitosi di 20,4 G/L, causata da un washout del 29,5% di plasmacellule. Inoltre, si è verificata una forte formazione di gel roll degli eritrociti come indicazione della presenza di paraproteinemia. In linea con questo, c’era un aumento delle proteine totali del siero di 106 g/L (intervallo di riferimento: 62-80 g/L) con un’albumina leggermente inferiore di 28 g/L (intervallo di riferimento: 32-46 g/L) e un aumento della lattato deidrogenasi (LDH) di 987 U/L (intervallo di riferimento: 232-430 U/L).
Questa costellazione di risultati ha portato al sospetto di leucemia plasmacellulare e la dispnea acuta è stata interpretata come un possibile segno di sindrome da iperviscosità. Pertanto, la paziente è stata indirizzata al nostro centro ospedaliero per valutare la plasmaferesi.
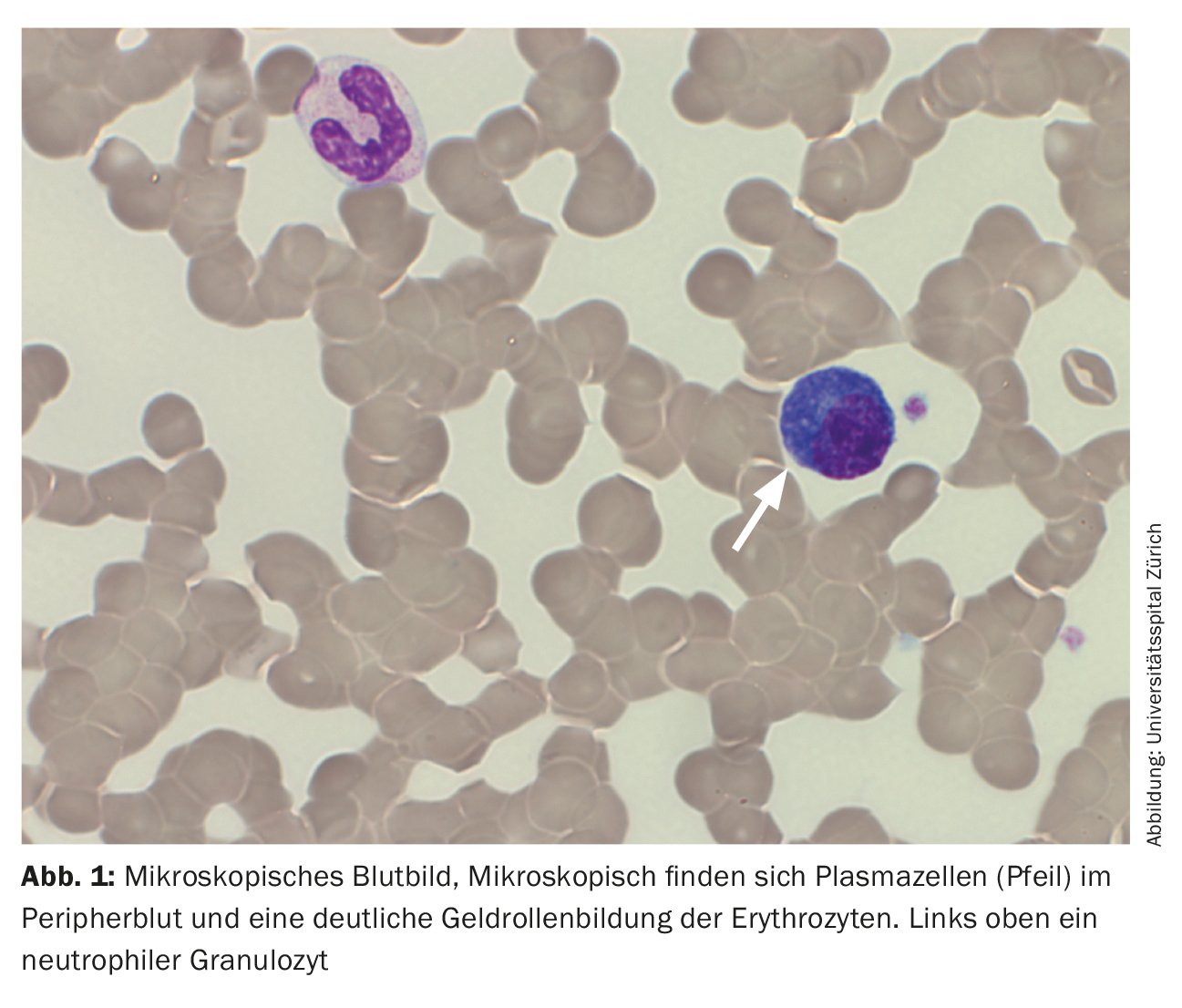
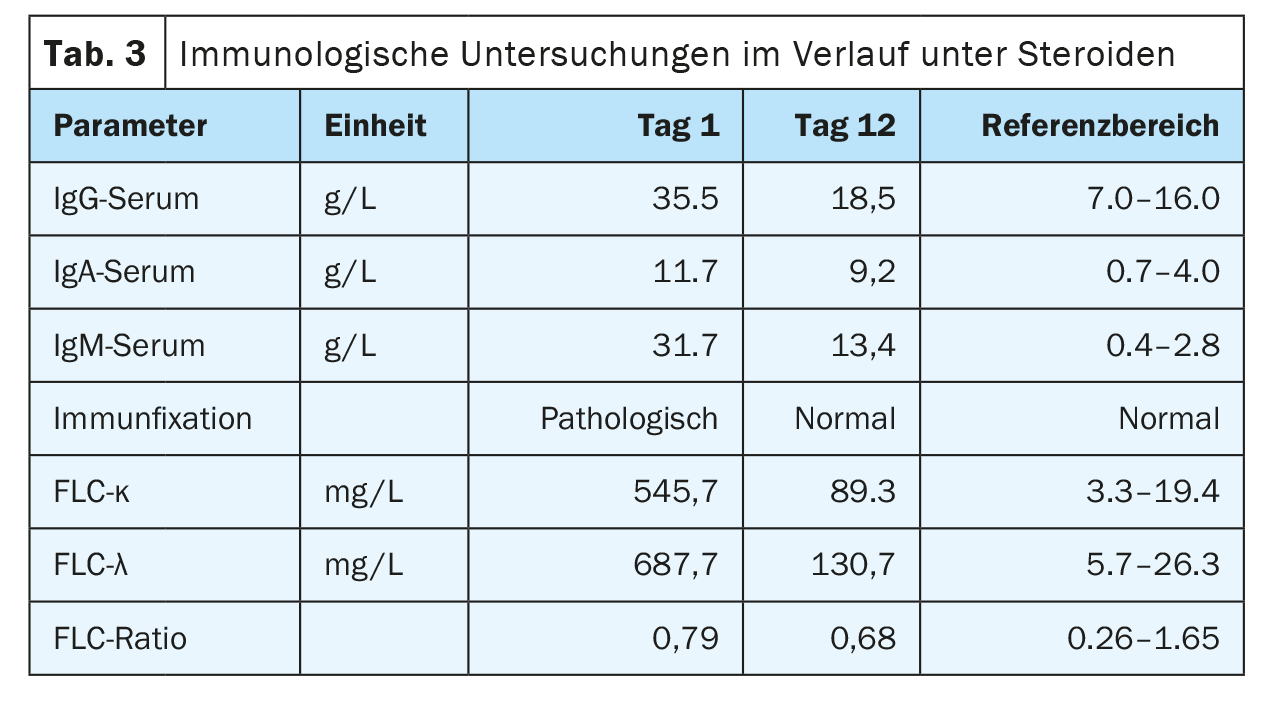
Al momento del ricovero, il paziente era in condizioni cardiopolmonari stabili con una situazione respiratoria compensata. Non c’erano altri sintomi che richiedessero un trattamento, forse associati all’iperviscosità, per cui non c’era alcuna indicazione per la plasmaferesi. L’impressionante reperto esterno di plasmocitosi periferica del 29% è stato confermato. (Tab. 2) (Fig. 1). Ulteriori analisi del sangue hanno rivelato un marcato aumento delle immunoglobuline (IgG, IgM, IgA) e delle catene leggere libere nel siero, ma con un rapporto di catene leggere non evidente. (Tab. 3). Nell’immunofissazione è stata rilevata un’ampia banda IgM lambda, ma non è stata possibile una differenziazione affidabile tra una banda clonale con di-/multimerizzazione e un modello policlonale. Anche la β2-microglobulina era elevata a 17,6 mg/L (intervallo di riferimento <2,5 mg/L). Per un’ulteriore diagnosi, è stato necessario effettuare una verifica della clonalità delle plasmacellule mediante l’immunofenotipizzazione.
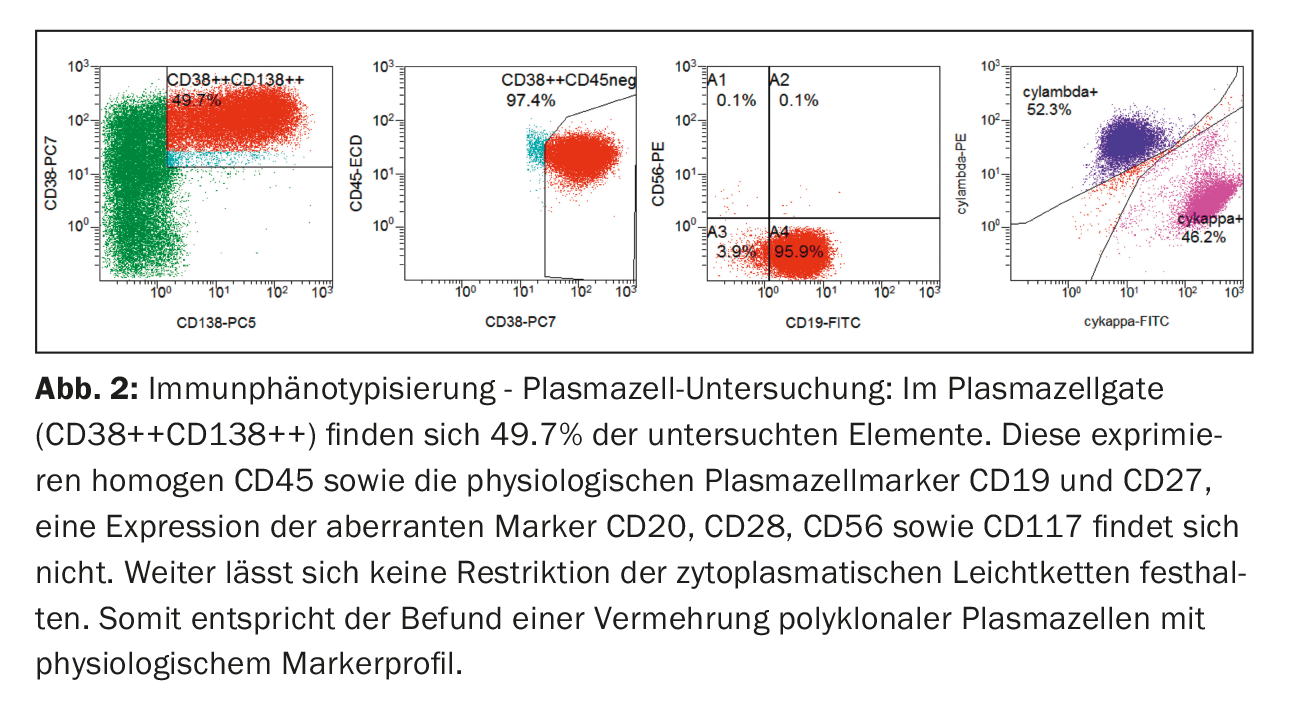
Dal punto di vista immunofenotipico, le plasmacellule nel sangue periferico erano chiaramente aumentate nel classico gate delle plasmacellule (CD38++CD138++). Questi hanno mostrato l’espressione del CD45 e dei marcatori fisiologici delle plasmacellule CD19 e CD27. Non c’era espressione di marcatori aberranti (CD20, CD28, CD56 e CD117) e nessuna restrizione delle catene leggere citoplasmatiche, il che significa che le plasmacellule policlonali stavano proliferando (Fig. 2) .
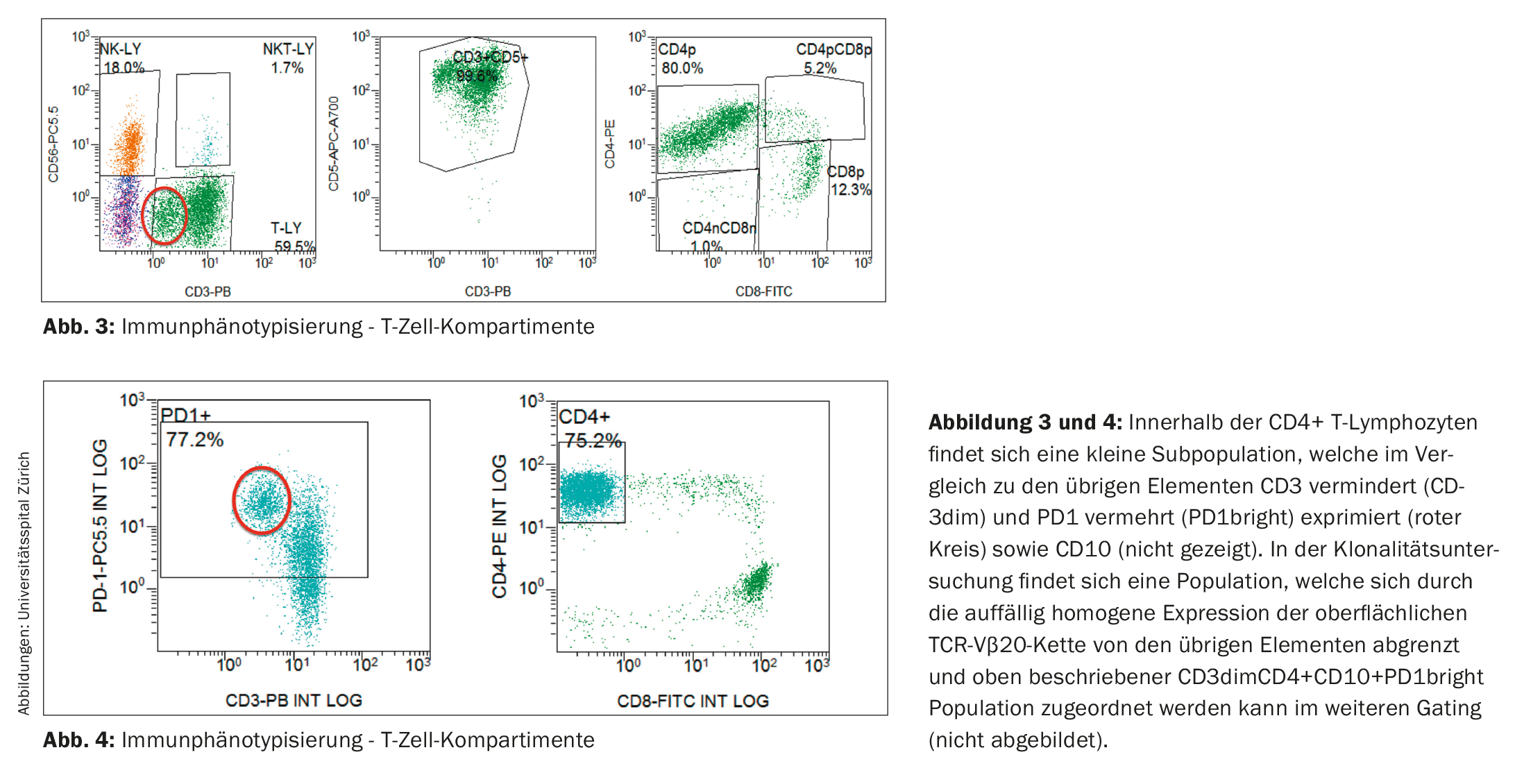
L’esame immunofenotipico dei linfociti è rimasto senza evidenza di una popolazione di cellule B clonali. Al contrario, il compartimento delle cellule T ha mostrato uno spostamento del rapporto CD4:CD8 a favore dei linfociti T CD4-positivi (nel presente studio 6,5:1; intervallo di riferimento nel sangue periferico: rapporto CD4:CD8 2:1), nonché una piccola popolazione con ridotta espressione di CD3 (CD3dim). (Fig. 3). Nell’indagine di follow-up, è stato possibile assegnare a questa popolazione cospicua un immunofenotipo CD4+CD3dimPD-1+CD10+. (Fig. 4) e ha dimostrato di essere clonale alla catena TCR-Vβ20 mediante l’analisi del TCR. Il risultato era quindi coerente con un linfoma non-Hodgkin a cellule T periferiche (T-NHL) di tipo angioimmunoblastico (AITL).
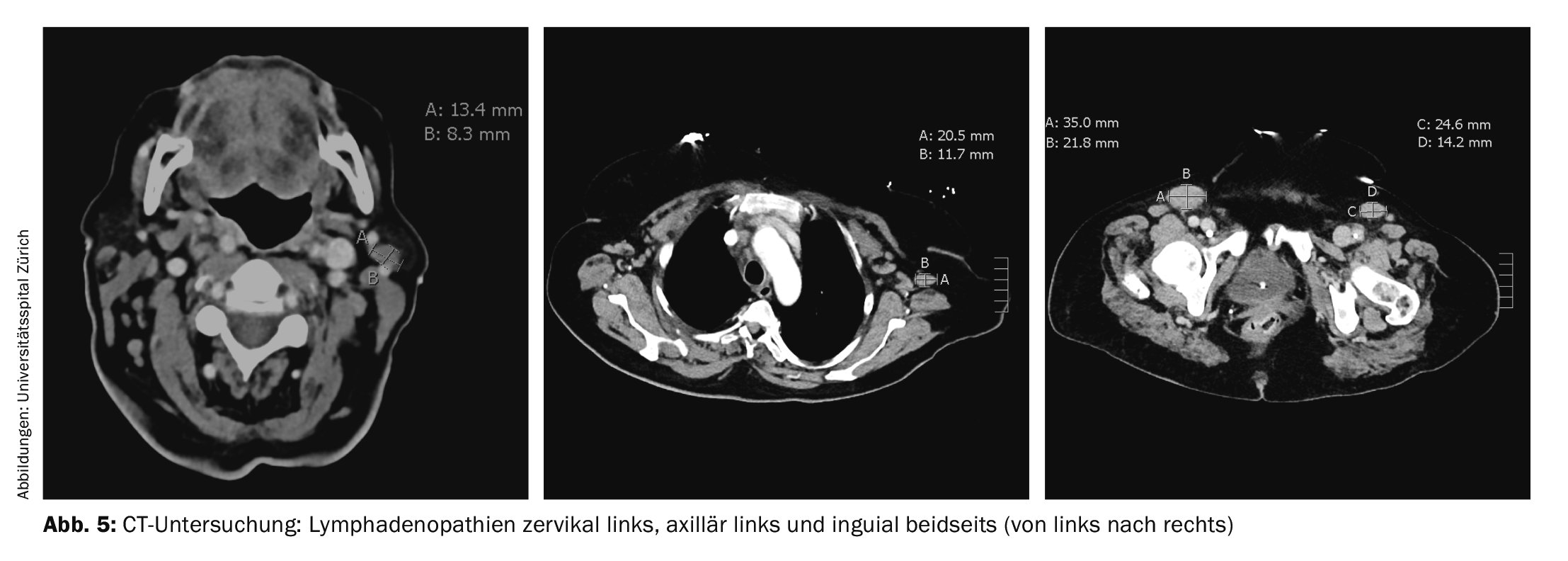
A causa della dispnea persistente, è stata eseguita nuovamente una tomografia computerizzata. L’esame non ha rivelato alcuna evidenza di emboli polmonari, ma ha evidenziato diverse linfoadenopatie, la più grande delle quali era inguinale a sinistra (35×22 mm) (Fig. 5). È stata eseguita un’escissione linfonodale ascellare destra consecutiva, che ha confermato la diagnosi di linfoma angioimmunoblastico a cellule T (AITL). L’esame del midollo osseo ha mostrato un coinvolgimento midollare da parte dell’AITL con un’infiltrazione del 10-15% e una proliferazione di plasmacellule policlonali midollari del 20%.
Questo ha portato alla diagnosi di linfoma angioimmunoblastico a cellule T (AITL), stadio IV Ann-Arbor, con plasmocitosi reattiva (Fig. 6). Inizialmente, è stata somministrata una terapia citoriduttiva con alte dosi di corticosteroidi, che ha portato a un rapido miglioramento del quadro clinico e a una chiara regressione dell’iperglobulinemia G/M/A a breve termine (Tabella 3) . Una volta confermata la diagnosi, è stata avviata una terapia diretta all’AITL con CHOP.
Definizione
La plasmocitosi è definita come una proliferazione delle plasmacellule nel sangue periferico e può essere di origine neoplastica nel senso di una malattia clonale delle plasmacellule, ma può anche essere causata in modo reattivo [12]. La plasmacitosi reattiva è stata descritta per la prima volta nel 1988 da Peterson et al. descritto come “proliferazioni immunoblastiche policlonali sistemiche” in quattro pazienti con proliferazione policlonale delle plasmacellule nel sangue periferico .
In letteratura, il termine plasmocitosi viene talvolta equiparato alla proliferazione delle plasmacellule in generale e viene specificato il comparto interessato (sangue periferico, midollo osseo, altri tessuti).
Epidemiologia ed eziologia
La plasmocitosi reattiva è un fenomeno raro, con pochi casi riportati, mentre la proliferazione reattiva delle plasmacellule nel midollo osseo è relativamente comune [13,14]. Batdorf et al. hanno trovato una proliferazione di plasmacellule (definita come contenuto di plasmacellule >2,0%) nell’8,8% (303/3435) nella loro analisi di 3435 esami del midollo osseo. In uno studio più piccolo di Gupta et al. Sono stati analizzati 830 esami del midollo osseo e la proliferazione delle plasmacellule (definita come contenuto di plasmacellule >3,5%) è stata registrata nel 13,7% (114/830) dei casi. In entrambi gli studi, la proliferazione delle plasmacellule era dovuta al mieloma plasmacellulare in meno del 10% dei casi [3,4].
Sono state osservate cause non maligne come l’anemia da carenza di substrato, l’anemia emolitica, le infezioni (in particolare l’HIV), le malattie autoimmuni e le malattie del fegato (soprattutto nella cirrosi epatica), ma anche processi maligni come malattie associate alla proliferazione reattiva delle plasmacellule. Quest’ultimo nel 15,7%-55,4% dei casi, la maggior parte dei quali erano tumori ematologici. [3,4]. L’entità della proliferazione delle plasmacellule è compresa tra il 5-24% nell’eziologia non neoplastica, meno del 10% nell’anemia e tra il 10-30% nelle infezioni e nel midollo osseo ipoplasico [3]. La proliferazione reattiva delle plasmacellule può essere causata anche dai farmaci. Uno studio di Zamarin et al. ha rilevato che l’iperglobulinemia policlonale e la proliferazione delle plasmacellule midollari del 5-20% (mediana 12%) si sono verificate nel 20% dei pazienti con mieloma plasmacellulare con esposizione prolungata alla lenalidomide (>6 mesi). [15]. Questo fenomeno è associato a una prolungata sopravvivenza libera da progressione, ma il meccanismo non è chiaro.
Esistono solo segnalazioni di casi di plasmocitosi reattive, ma non inaspettatamente lo spettro delle malattie sottostanti è paragonabile: ci sono segnalazioni di plasmocitosi nel contesto di infezioni virali (epatite acuta A, virus di Ebstein-Barr, parvovirus B19, dengue, virus SFTS) ma anche batteriche (S. aureus, K. pneumoniae) [5,7,10,16–20]. Un caso è stato descritto in un paziente con sindrome di Sjögren [8]. Inoltre, ci sono diversi casi di plasmocitosi pronunciata in relazione ai linfomi angioimmunoblastici a cellule T e in un caso è stato persino postulato un collegamento con un mieloma plasmacellulare coesistente [6,9,13,21,22]. Anche se nei casi riportati c’era una plasmocitosi pronunciata in ogni caso, le plasmocitosi reattive sono probabilmente per lo più lievi; ad esempio, in una serie di casi di Jego et al. Solo 2 pazienti su 10 hanno avuto un washout delle plasmacellule >20% al sito [23].
Fisiopatologia
Nelle proliferazioni di plasmacellule reattive, c’è una miscela di precursori di plasmacellule (plasmablasti) e di precursori (plasmacellule precoci), che hanno tutti un’espressione omogenea di CD45bright, mentre nel midollo osseo normale e nel mieloma plasmacellulare c’è un’espressione eterogenea di CD45 [24]. Il meccanismo esatto che porta alla proliferazione non è noto, ma l’aumento del rilascio di citochine sembra probabile come causa, soprattutto perché IL-2 e IL-10 sono forti stimoli per la formazione di plasmablasti e plasmacellule precoci [25]. L’IL-6 potenzia questo effetto ed è essenziale per la sopravvivenza delle plasmacellule .
Il linfoma angioimmunoblastico a cellule T è istologicamente caratterizzato da un infiltrato infiammatorio polimorfo ed è più frequentemente associato a livelli elevati di citochine nel siero (compresa l’IL-6 e l’IL-10) rispetto ad altri linfomi a cellule T periferici. Questa osservazione suggerisce che in questi casi la proliferazione reattiva delle plasmacellule associata è mediata dalle citochine. Ci sono singoli casi descritti in letteratura in cui è stata riscontrata anche una proliferazione monoclonale delle plasmacellule [13,27,28].
Messaggi da portare a casa
- La plasmocitosi reattiva è rara, ma può essere pronunciata (washout delle plasmacellule >20%).
- Nel caso della plasmocitosi, la differenziazione tra la proliferazione delle plasmacellule reattive (policlonali) e monoclonali è possibile in modo rapido e affidabile mediante l’immunofenotipizzazione citometrica a flusso dal sangue periferico.
- Le principali diagnosi differenziali sono le infezioni, i tumori maligni (soprattutto quelli ematologici) e le malattie autoimmuni.
- L’esatto pato-meccanismo non è chiaro; è possibile un aumento del rilascio di citochine (IL-2, IL-6, IL-10) come causa.
Letteratura:
- Peterson LC, Kueck B Fau-Arthur DC, Arthur Dc Fau-Dedeker K, et al: Proliferazioni immunoblastiche policlonali sistemiche.
- Li L, et al: Proliferazione policlonale delle plasmacellule con marcata ipergammaglobulinemia e autoanticorpi multipli. Ann Clin Lab Sci 36, 479-484 (2006).
- Gupta M, et al: Profilo eziologico della plasmocitosi negli aspirati di midollo osseo. Dicle Medical Journal 43, 4, doi: 10.5798/diclemedj.0921.2016.01.0628 (2016).
- Batdorf B, Kroft S, Olteanu H, Harrington A: Plasmocitosi reattiva del midollo osseo: un aggiornamento per l’era moderna. American Journal of Clinical Pathology 142, A102-A102, doi: 10.1093/ajcp/142.suppl1.102 %J American Journal of Clinical Pathology (2014).
- Shtalrid M, Shvidel L, Vorst E: Plasmocitosi policlonale reattiva del sangue periferico che imita la leucemia plasmacellulare in un paziente con sepsi stafilococcica. Leucemia & Linfoma 44, 379-380, doi: 10.1080/1042819021000029713 (2003).
- Ahsanuddin AN, Brynes RK, Li S: Plasmocitosi policlonale del sangue periferico che imita la leucemia plasmacellulare nei pazienti con linfoma angioimmunoblastico a cellule T: rapporto di 3 casi e revisione della letteratura. Int J Clin Exp Pathol 4, 416-420 (2011).
- Desborough MJ, Grech H: Aplasia del midollo osseo e plasmocitosi guidata dal virus di Epstein-Barr che imita una neoplasia plasmacellulare. Br J Haematol 165, 272, doi: 10.1111/bjh.12721 (2014).
- Lee J, Chang Je Fau-Cho YJ, Cho Yj Fau-Han, et al: caso di plasmocitosi reattiva che imita il mieloma multiplo in un paziente con sindrome di Sjogren primaria.
- Sokol K, et al: Estrema plasmocitosi del sangue periferico che imita la leucemia plasmacellulare come caratteristica di presentazione del linfoma angioimmunoblastico a cellule T (AITL). Front Oncol 9, 509, doi: 10.3389/fonc.2019.00509 (2019).
- Zhang J, et al: Plasmocitosi reattiva che imita il mieloma multiplo associata all’infezione da virus SFTS: rapporto di due casi e revisione della letteratura. BMC Infect Dis 18, 528, doi: 10.1186/s12879-018-3431-z (2018).
- SH S, et al: Classificazione OMS dei tumori dei tessuti ematopoietici e linfoidi. IARC Press, Lyon Classificazione dei tumori dell’OMS, 4a edizione rivista, volume 2 (2017).
- J., B. B., Karl-Anton K: Das Blutbild – Diagnostische Methoden und klinische Interpretation. De Gruyter (2017).
- Xu J. et al: Linfoma angioimmunoblastico a cellule T con mieloma plasmacellulare coesistente: rapporto di un caso e revisione della letteratura. Tohoku J Exp Med 235, 283-288, doi: 10.1620/tjem.235.283 (2015).
- Pellat-Deceunynck C, et al: Plasmacitosi reattive, un modello per studiare la biologia dei progenitori e dei precursori delle plasmacellule umane. The hematology journal: the official journal of the European Haematology Association / EHA 1, 362-366, doi: 10.1038/sj/thj/6200053 (2000).
- Zamarin D, et al: Attivazione immunitaria policlonale e plasmocitosi midollare nei pazienti con mieloma multiplo che ricevono una terapia a lungo termine con lenalidomide: incidenza e significato prognostico. Leucemia 27, 2422-2424, doi: 10.1038/leu.2013.126 (2013).
- Wada T, et al: Plasmocitosi reattiva del sangue periferico in un paziente con epatite A acuta.
- Koduri PR, Naides SJ: Plasmocitosi ematica transitoria nell’infezione da parvovirus B19: un rapporto di due casi. Ann Hematol 72, 49-51, doi: 10.1007/bf00663017 (1996).
- Thai KT, et al: Alta incidenza di plasmocitosi del sangue periferico nei pazienti con infezione da virus dengue. Clin Microbiol Infect 17, 1823-1828, doi: 10.1111/j.1469-0691.2010.03434.x (2011).
- Wada T, Iwata Y, Kamikawa Y, et al: Plasmocitosi del sangue periferico nella sindrome di febbre grave con trombocitopenia. Jpn J Infect Dis 70, 470-471, doi: 10.7883/yoken.JJID.2016.575 (2017).
- Moon Y, et al: Klebsiella pneumoniae associata a plasmocitosi estrema. Infect Chemother 45, 435-440, doi:10.3947/ic.2013.45.4.435 (2013).
- Sakai H, et al: Linfoma angioimmunoblastico a cellule T che si presenta inizialmente con sostituzione del midollo osseo e plasmocitosi periferica. Intern Med 46, 419-424, doi: 10.2169/internalmedicine.46.6121 (2007).
- Yamane A, Awaya N, Shimizu T, et al: Linfoma angioimmunoblastico a cellule T con proliferazione policlonale di plasmacellule nel sangue periferico e nel midollo. Acta Haematol 117, 74-77, doi: 10.1159/000096894 (2007).
- Jego G, et al.: Le plasmacitosi reattive sono espansioni di plasmablasti che conservano la capacità di differenziarsi in plasmacellule.
- Pellat-Deceunynck C, Bataille R: Plasmacellule umane normali e maligne: proliferazione, differenziazione ed espansioni in relazione all’espressione del CD45. Blood Cells Mol Dis 32, 293-301, doi:10.1016/j.bcmd.2003.12.001 (2004).
- Jego G, Bataille R, Pellat-Deceunynck C: L’interleuchina-6 è un fattore di crescita per i plasmablasti umani non maligni. Blood 97, 1817-1822, doi:10.1182/blood.v97.6.1817 (2001).
- Jourdan M, et al.: L’IL-6 supporta la generazione di plasmacellule umane a lunga vita in combinazione con i fattori solubili delle cellule APRIL o stromali. Leucemia 28, 1647-1656, doi:10.1038/leu.2014.61 (2014).
- Dogan A, Attygalle AD, Kyriakou C: Linfoma a cellule T angioimmunoblastico. Br J Haematol 121, 681-691, doi: 10.1046/j.1365-2141.2003.04335.x (2003).
- Yi JH, Ryu KJ, Ko YH, et al: Profili delle citochine sieriche e loro implicazioni cliniche nei pazienti con linfoma a cellule T periferiche. Cytokine 113, 371-379, doi: 10.1016/j.cyto.2018.10.009 (2019).
InFo ONCOLOGIA ED EMATOLOGIA 2023; 11(6): 6-10