L’asse IL23/Th17 svolge un ruolo importante nella fisiopatologia della psoriasi. Un numero crescente di prove suggerisce che i processi infiammatori sono coinvolti in molte malattie cardiovascolari e metaboliche associate alla psoriasi. E ci sono prove che l’upregulation del percorso IL23/Th17 gioca un ruolo importante nelle comorbidità cardiometaboliche nella psoriasi.
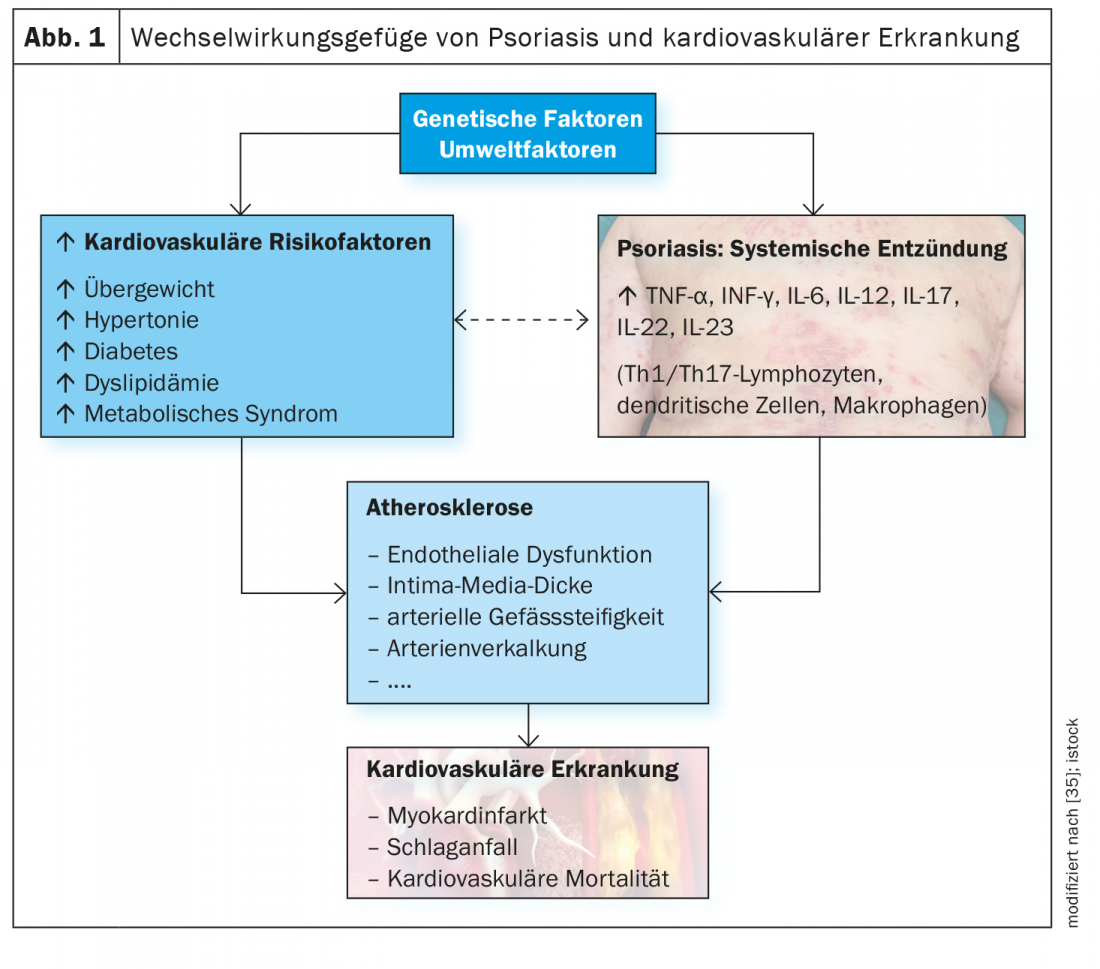
Le malattie cardiovascolari e metaboliche sono tra le comorbidità più comuni della psoriasi a placche da moderata a grave e contribuiscono ad aumentare il rischio di mortalità [1]. Secondo i dati epidemiologici, le malattie cardiovascolari (CVD) sono la causa più comune o la seconda causa di morte nei pazienti affetti da psoriasi [2–4]. Soprattutto nei pazienti con psoriasi grave, il rischio di eventi cardiovascolari è notevolmente aumentato rispetto alla popolazione generale (infarto miocardico: RR 1,70-3,04; ictus: RR 1,38-1,59; mortalità cardiovascolare: 1,37-1,39) [5–8]. Oltre ai profili lipidici anormali e allo stress ossidativo, si ritiene che i processi infiammatori siano coinvolti nello sviluppo di cambiamenti aterosclerotici e nell’aumento associato del rischio cardiovascolare [9,10]. Ci sono sempre più prove che l’infiammazione cronica e la disregolazione immunitaria giocano un ruolo importante e che il percorso IL23/Th17, tra gli altri, è coinvolto.
Malattia coronarica
Il rischio di infarto miocardico come manifestazione della malattia coronarica (CHD) è aumentato fino a tre volte rispetto ai non psoriasici [11–13]. I polimorfismi genetici di IL23-R sembrano essere associati al rischio e alla gravità dell’aterosclerosi [14,15]. Diversi studi mostrano associazioni tra IL23 e infarto miocardico. Yan et al. hanno potuto dimostrare che l’IL23 aumenta fortemente entro tre giorni dall’infarto miocardico, mentre l’IL23-R e l’IL17-A sono regolati fino a sette giorni e l’IL17-R fino a 14 giorni. Sulla base di studi sugli animali (modello murino), si presume che l’IL23 dei macrofagi e dei neutrofili serva come regolatore a monte dell’IL17-A e promuova la produzione di cellule γδT. L’IL17-A presumibilmente guida l’infiltrazione dei neutrofili e la fibrosi nel tessuto miocardico. L’up-regulation dell’IL23 è stata associata a dimensioni maggiori dell’infarto, a livelli più elevati di biomarcatori tipici del danno miocardico (LDH e creatina chinasi), nonché a risposte pro-infiammatorie (aumenti di IL17A, IL6 e TNF-α) e a effetti pro-apoptotici. Attivando JAK2/STAT3, l’IL23 induce il rilascio di IL17-A, che in definitiva aumenta la risposta infiammatoria e il danno miocardico [16,17]. È stato anche riscontrato che la neutralizzazione dell’IL23 mediante anticorpi anti-IL23p19 ha portato a una riduzione dei livelli di IL17-A e a una riduzione della compromissione ischemica e del danno da riperfusione [16,18].
Malattia cerebrovascolare
È ben noto che i processi infiammatori svolgono un ruolo importante nella complessa fisiopatologia dell’ictus ischemico, soprattutto nell’esacerbazione del danno cerebrale. Il verificarsi dell’ischemia è accompagnato dall’attivazione della microglia, con conseguente secrezione di citochine proinfiammatorie (soprattutto IL23 e IL12) e mediatori neuroprotettivi (IL10) [19]. Tra le cellule che infiltrano il cervello, i macrofagi sono coinvolti principalmente nelle fasi iniziali degli infarti, mentre i neutrofili e i linfociti sono coinvolti nelle fasi successive [20]. L’IL23 secreta dai macrofagi e dalle cellule dendritiche promuove la proliferazione delle cellule Th17 e γδT e la produzione di IL17, che contribuisce al danno cerebrale dopo l’ictus [21,22]. In studi sperimentali sull’uomo, è stato dimostrato un aumento dei livelli di IL23 accompagnato da un aumento della proporzione di cellule produttrici di IL17-A, nonché un aumento dei livelli di IL17-A e di altre citochine in vari momenti dopo l’ictus rispetto a un gruppo di controllo [15]. Inoltre, è stata trovata una correlazione positiva tra i livelli di IL23 e il volume della lesione [15]. Il fatto che un aumento dei mediatori pro-infiammatori si sia verificato contemporaneamente a una riduzione delle cellule TReg (cellule T regolatorie) e dei livelli di IL10 supporta l’ipotesi che lo squilibrio pro- e anti-infiammatorio sia un meccanismo coinvolto nell’ictus e nelle lesioni cerebrali [24].
L’effetto del blocco di IL23/IL17 è stato oggetto di diversi studi. Gli animali con carenza di IL23 presentavano livelli significativamente più bassi di cellule γδT e di conseguenza una minore secrezione di IL17 e una riduzione delle dimensioni dell’infarto [23]. La soppressione specifica della subunità IL23p19 ha comportato una riduzione dei livelli delle citochine pro-infiammatorie IL23 e IL17, accompagnata da un’aumento del fattore di trascrizione FoxP3 (“forkhead box protein P3”) espresso dalla cellula TReg. Il blocco della subunità p19 è stato associato, tra l’altro, a una riduzione degli infarti e della disfunzione neurologica [21].
Malattia occlusiva arteriosa periferica
La malattia arteriosa periferica (CAD) degli arti inferiori è una presentazione clinica comune negli adulti, spesso dovuta all’aterosclerosi. Secondo i dati empirici, il rischio di pAVK è del 98% più elevato nei pazienti affetti da psoriasi rispetto al gruppo di controllo (OR: 1,98; 95% CI: 1,32-2,82). [26] (Fig. 1). Sebbene ci sia una base di prove piuttosto ridotta per quanto riguarda il ruolo dell’infiammazione nella PAOD, uno studio caso-controllo suggerisce un possibile coinvolgimento dell’IL23, mostrando che i livelli di IL23 dei pazienti con PAOD erano significativamente più alti rispetto a un gruppo di controllo. [27].
Ipertensione
Gli studi epidemiologici dimostrano che la prevalenza dell’ipertensione è aumentata nei pazienti con psoriasi (OR: 1,58; 95% CI: 1,42-1,76) e ha una correlazione positiva con la gravità della psoriasi [1]. Inoltre, i pazienti affetti da psoriasi hanno una maggiore vulnerabilità a sviluppare un’ipertensione difficile da controllare, il che significa che hanno una probabilità da 16,5 a 19,9 volte maggiore di dover essere trattati con tre o quattro farmaci rispetto ai pazienti ipertesi senza psoriasi [28]. È noto che i processi infiammatori svolgono un ruolo importante nella patogenesi dell’ipertensione ed è altrettanto noto che le cellule immunitarie attivate sono un fattore critico all’interno di questa struttura [29–31]. In particolare, in questo contesto sono stati riportati anche i risultati del coinvolgimento della via di segnalazione IL23/IL17. Le cellule T e i macrofagi si accumulano nel rene e nelle aree perivascolari. Le cellule dendritiche attivano le cellule T, che promuovono la differenziazione Th17 secernendo IL6, TNF-α e IL23, tra gli altri. La produzione di IL17-A stimolata dall’attivazione dei Th17 sembra essere un fattore critico nella disfunzione vascolare e nel mantenimento dell’ipertensione [31–33]. Poiché uno squilibrio di Th17 e TReg è un fattore fisiopatologicamente rilevante per le malattie cardiovascolari, Liu et al. ha studiato se l’uso di farmaci anti-ipertensivi ha un effetto su questo percorso [34]. Hanno scoperto che i pazienti trattati con una combinazione di telmisartan e rosuvastatina hanno mostrato una riduzione sinergica dei fattori pro-infiammatori sierici, tra cui IL23, cellule Th17 e IL17-A, e un aumento dei fattori anti-infiammatori, tra cui TReg, FoxP3 e IL10 [34].
|
Sommario L’asse IL23/Th17 svolge un ruolo importante nella fisiopatologia della psoriasi. L’up-regolazione di questa via, insieme ad altre citochine infiammatorie (ad esempio TNF e IFN di tipo I), contribuisce allo sviluppo di uno “stato pro-infiammatorio” cronico nella psoriasi. Esiste un numero crescente di prove che suggeriscono che i processi infiammatori, attraverso vari mediatori e percorsi, sono coinvolti in diverse malattie cardiovascolari (ad esempio, cardiopatia coronarica, ipertensione) e disturbi metabolici cronici (ad esempio, obesità, fegato grasso non alcolico) che sono prevalenti nella psoriasi. I dati suggeriscono che l’upregulation del percorso IL23/Th17 in combinazione con uno stile di vita sfavorevole è una possibile spiegazione di molte comorbidità cardiometaboliche nella psoriasi. Ci sono ancora molte domande aperte sulle implicazioni terapeutiche di questi risultati. Per quanto riguarda l’ipotesi che gli anticorpi monoclonali altamente specifici utilizzati per il trattamento della psoriasi abbiano anche un effetto sul decorso delle comorbidità, la base di evidenza è ancora piccola. Sono necessari ulteriori studi per comprendere meglio queste relazioni. In base alle conoscenze attuali, le comorbidità nei pazienti affetti da psoriasi dovrebbero essere trattate con le rispettive terapie standard. |
Letteratura:
- Takeshita J, et al: Psoriasi e malattie comorbide: epidemiologia. J Am Acad Dermatol 2017; 76: 377-390.
- Salahadeen E, et al: Studio nazionale basato sulla popolazione dei tassi di mortalità causa-specifici nei pazienti con psoriasi. J Eur Acad Dermatol Venereol 2015; 29: 1002-1005.
- Svedbom A, et al: Aumento della mortalità per cause specifiche nei pazienti con psoriasi lieve e grave: uno studio di registro svedese basato sulla popolazione. Acta Derm Venereol 2015; 95: 809-815.
- Lee M-S, Yeh Y-C, Chang Y-T, Lai M-S: Mortalità per tutte le cause e causa specifica nei pazienti con psoriasi a Taiwan: uno studio basato sulla popolazione nazionale. J Invest Dermatol 2017; 137: 1468-1473.
- Armstrong EJ, Harskamp CT, Armstrong AW: Psoriasi ed eventi cardiovascolari avversi maggiori: una revisione sistematica e una meta-analisi di studi osservazionali. J Am Heart Assoc 2013; 2: e000062.
- Samarasekera EJ, et al: Incidenza di malattie cardiovascolari nei soggetti con psoriasi: una revisione sistematica e una meta-analisi. J Invest Dermatol 2013; 133: 2340-2346.
- Raaby L, Ahlehoff O, de Thurah A: Psoriasi ed eventi cardiovascolari: aggiornamento delle prove. Arch Dermatol Res 2017; 309: 225-228.
- Mehta NN, et al: Stima del rischio attribuibile della psoriasi grave sugli eventi cardiovascolari maggiori. Am J Med 2011; 124: 775. e1-6.
- Zhou Q, Mrowietz U, Rostami-Yazdi M: Lo stress ossidativo nella patogenesi della psoriasi. Free Radic Biol Med 2009; 47: 891-905.
- Asha K, et al: Dislipidemia e stress ossidativo nei pazienti con psoriasi: fattori di rischio cardiovascolare emergenti. Indian J Med Res 2017; 146: 708-713.
- Furue M, et al: Malattie cardiovascolari e metaboliche in comorbilità con la psoriasi: oltre la pelle. Intern Med Tokyo Jpn 2017; 56: 1613-1619.
- Hjuler KF, et al: Aumento della prevalenza di malattia coronarica nella psoriasi grave e nella dermatite atopica grave. Am J Med 2015; 128: 1325-1334.e2.
- Mahiques-Santos L, et al: Psoriasi e malattia coronarica ischemica. Actas Dermosifiliogr 2015; 106: 112-116.
- Zhang M, et al: Polimorfismi funzionali nel recettore dell’interleuchina-23 e suscettibilità alla malattia coronarica. DNA Cell Biol 2014; 33: 891-897.
- Kave M, Shadman M, Alizadeh A, Samadi M: Analisi dell’associazione tra il polimorfismo IL-23R rs11209026 e l’incidenza dell’aterosclerosi. Int J Immunogenet 2015; 42: 341-345.
- Hu X, Ma R, Lu J et al: L’IL-23 promuove il danno da I/R del miocardio aumentando le risposte infiammatorie e le reazioni di stress ossidativo. Cell Physiol Biochem 2016; 38: 2163-2172.
- Liao Y, et: Gli effetti favorevoli dell’IL-23 sull’ischemia e la riperfusione miocardica sono associati ad un aumento dell’espressione dell’IL-17A e ad un’upregolazione della via di segnalazione JAK2-STAT3. Mol Med Rep 2017; 16: 9309-9316.
- Zhu H, et al: L’asse Hmgb1-TLR4-IL-23-IL-17A promuove il danno da ischemia-riperfusione in un modello di trapianto cardiaco. Trapianto 2013; 95: 1448-1454.
- Zhao S-C, et al: Regolazione dell’attivazione microgliale nell’ictus. Acta Pharmacol Sin 2017; 38: 445-458.
- Ma S, et al: L’effetto immunomodulatore delle cellule stromali del midollo osseo (BMSC) sull’ictus ischemico mediato da interleuchina (IL)-23/IL-17 nei topi. J Neuroimmunol 2013; 257: 28-35.
- Zheng Y, et al.: Ruolo centrale dell’interleuchina-23 cerebrale durante il danno immunologico nell’ischemia cerebrale ritardata nei topi. Neuroscienze 2015; 290: 321-331.
- Brait VH, et al: Importanza dei linfociti T nella lesione cerebrale, nell’immunodeficienza e nel recupero dopo l’ischemia cerebrale. J Cereb Blood Flow Metab 2012; 32: 598-611.
- Gelderblom M, et al: le cellule dendritiche convenzionali che producono IL-23 (interleuchina-23) controllano la risposta deleteria dell’IL-17 (interleuchina-17) nell’ictus. Stroke 2018; 49: 155-164.
- Hu Y, Zheng Y, Wu Y, Ni B, Shi S: Squilibrio tra cellule produttrici di IL-17A e cellule T regolatorie durante l’ictus ischemico. Mediators Inflamm 2014; 2014: 813045.
- Jiang C, et al: Cambiamenti nel sistema immunitario cellulare e nei marcatori infiammatori circolanti dei pazienti con ictus. Oncotarget 2016; 8: 3553-3567.
- Prodanovich S, et al: Associazione della psoriasi con le malattie coronariche, cerebrovascolari e vascolari periferiche e la mortalità. Arch Dermatol 2009; 145: 700-703.
- David A, et al: Livelli sierici di interleuchina-23 nei pazienti affetti da arteriopatia periferica. Clin Biochem 2012; 45: 275-278.
- Armstrong AW, et al: Psoriasi e gravità dell’ipertensione: risultati di uno studio caso-controllo. PLoS ONE 2011; 6: e18227.
- Coffman TM: Sotto pressione: la ricerca dei meccanismi essenziali dell’ipertensione. Nat Med 2011; 17: 1402-1409.
- Kirabo A, et al. Le proteine isocetali modificate della DC attivano le cellule T e promuovono l’ipertensione. J Clin Invest 2014; 124: 4642-4656.
- Dixon KB, Davies SS, Kirabo A: Cellule dendritiche e isolevuglandine nell’immunità, nell’infiammazione e nell’ipertensione. Am J Physiol Heart Circ Physiol 2017; 312: H368-H374.
- Loperena R, et al: L’ipertensione e l’aumento dello stiramento meccanico endoteliale promuovono la differenziazione e l’attivazione dei monociti: ruoli di STAT3, interleuchina 6 e perossido di idrogeno. Cardiovasc Res 2018; 114: 1547-1563.
- Madhur MS, et al: L’interleuchina 17 promuove l’ipertensione e la disfunzione vascolare indotta dall’angiotensina II. Hypertens Dallas Tex 1979; 2010; 55: 500-507.
- Liu Z, et al: Il trattamento con la combinazione telmisartan/rosuvastatina ha un effetto sinergico benefico sul miglioramento dello squilibrio funzionale Th17/Treg nei pazienti ipertesi con aterosclerosi carotidea. Aterosclerosi 2014; 233: 291-299.
- Torres T, Bettencourt N: Psoriasi: il killer visibile. Rev Port Cardio 2014; 33 : 95-99.
Ulteriori letture:
- Egeberg A, et al.: Il ruolo del percorso interleuchina-23/Th17 nella comorbidità cardiometabolica associata alla psoriasi. JEADV 2020; 34(8): 1695-1706, https://onlinelibrary.wiley.com/doi/10.1111/jdv.16273
PRATICA DERMATOLOGICA 2020; 30(6): 30-32