L’aumento significativo degli agenti terapeutici disponibili per la CRPC è incoraggiante. L’obiettivo di qualsiasi terapia deve essere il mantenimento della qualità di vita con una riduzione delle complicanze specifiche del tumore. A causa della complessità e della mancanza di dati comparativi, le attuali linee guida dell’EAU raccomandano in genere un approccio multidisciplinare per i pazienti con mCRPC e quindi la presentazione a un comitato tumori.
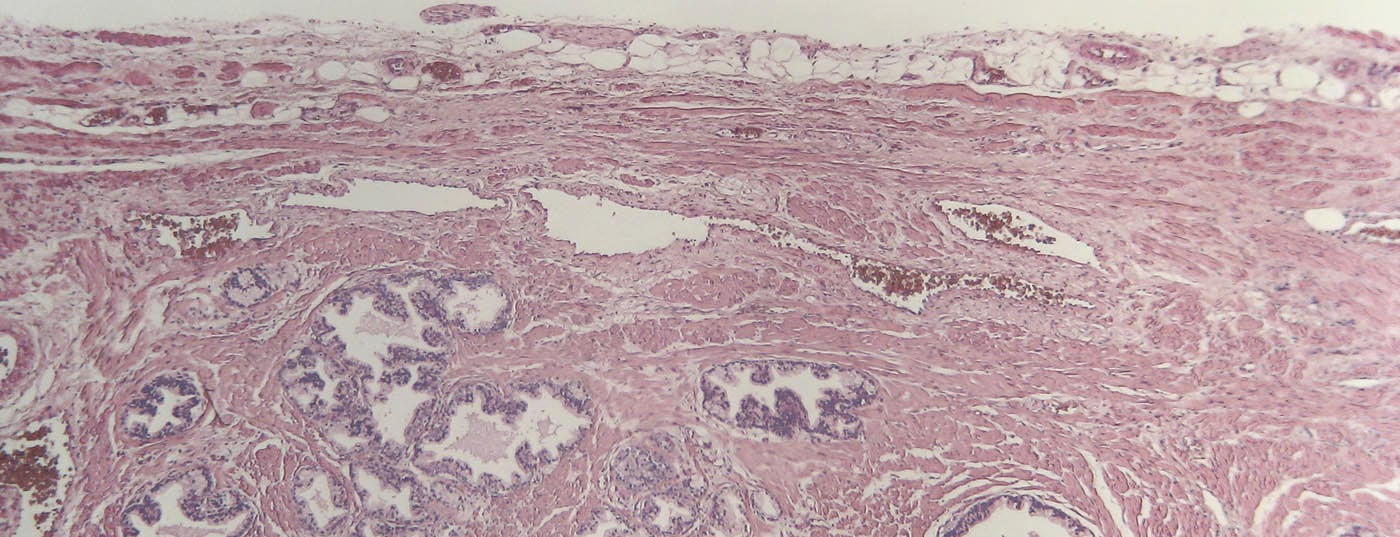
Il carcinoma della prostata (PCa) è un’entità tumorale eterogenea che comprende sia tumori non pericolosi per la vita, sia quelli con decorso altamente aggressivo e letale. Mentre i tumori insignificanti vengono osservati con una sorveglianza attiva, per le forme localizzate si esegue una procedura attiva come la chirurgia radicale o la radioterapia [1,2]. Più problematici dal punto di vista terapeutico sono i tumori aggressivi (recidivanti), che cambiano dinamicamente dal momento della diagnosi fino al decesso correlato al tumore in relazione alla clinica (localizzato vs. localmente avanzato), allo stato ormonale (sensibile alla castrazione vs. refrattario) e alla presenza di metastasi (M0 vs. M+) [3].
Dal PCa ormonale al CRPC
Da uno a tre anni dopo l’inizio della terapia antiormonale (ADT), si sviluppa una resistenza alla terapia con progressione del tumore. L’asse ormonale è ancora di importanza centrale a questo punto [4], motivo per cui è stato effettuato un cambio di nome: Il PCa “ormono-refrattario” è diventato “castration-refractory” (CRPC) [1]. Secondo l’Associazione Europea di Urologia, la CRPC è presente se il livello di testosterone è al livello di castrazione, il livello di PSA aumenta per tre volte a distanza di almeno una settimana l’una dall’altra, con due livelli che superano almeno del 50% il nadir, e il livello massimo è >2 ng/ml – o se si verificano più di due nuove lesioni ossee e se progredisce una lesione dei tessuti molli [2].
La CRPC è considerata una malattia in fase terminale altamente aggressiva e non curabile, con un alto rischio di complicazioni specifiche del tumore e di morte correlata al tumore. La sfida terapeutica risiede nei complessi cambiamenti molecolari da tumore sensibile alla castrazione a tumore refrattario, compresi i cambiamenti dipendenti dal recettore degli androgeni (AR) e indipendenti dall’AR.
Cambiamenti dipendenti dall’AR
Ipersensibilità agli androgeni/amplificazione dell’AR: l’aumento dei tassi di trascrizione dell’mRNA e la migliore stabilizzazione dell’mRNA e della proteina portano a una maggiore amplificazione dell’AR e quindi a un vantaggio di selezione della sopravvivenza [5,6].
Sintesi androgenica intracrina: autoapprovvigionamento di androgeni attraverso una maggiore conversione del testosterone in DHT (tramite un aumento della concentrazione di 5-α-reduttasi). Le linee cellulari CRPC sono in grado di sintetizzare gli androgeni, ad esempio dal colesterolo, grazie all’aumento dell’espressione di tutti i geni di sintesi [7,8].
Attivazione dell’AR indipendente dal legante: le mutazioni aumentano la capacità di attivare gli androgeni surrenali, gli estrogeni, il cortisolo e persino gli antagonisti dell’AR. Le mutazioni del sito di legame per i co-regolatori e le varianti AR-splicing (AR 3, 4 e 5) possono persino portare all’attivazione dell’AR senza alcun ligando [9–11].
Attivazione dell’AR da parte di fattori di crescita, citochine e chinasi tirosiniche recettoriali: I fattori di crescita (IGF-1, EGF) o le citochine (IL6) attivano l’AR e altri percorsi oncogeni come RAS, RAF o MAPK e quindi la crescita tumorale. Le tirosin-chinasi come ERBB2 attivano anche l’AR tramite MAPK e PI3K/AKT [12].
Cambiamenti indipendenti dall’AR
Sovrappressione e attivazione di proteine anti-apoptotiche: BCL2, Clusterin, Hsp27 e TP53INP1 bloccano e bypassano gli stimoli apoptotici generati dalla privazione di androgeni [12–15].
Mutazione/disattivazione dei geni soppressori del tumore (PTEN, RB, p53): La perdita di PTEN porta all’attivazione dell’AR attraverso il percorso PI3K/AKT e, tramite questo, anche agli effetti indipendenti dall’AR, come la riduzione dell’apoptosi e della crescita cellulare. Le mutazioni di RB1/p53 provocano una proliferazione cellulare ab- bastanza indipendente dall’AR [12,16,17].
MicroRNA (miRNA): Per gli OncomiRs miR-221/222, è stata descritta un’upregulation che si correla inversamente con l’espressione dell’inibitore del ciclo cellulare p27. È stato dimostrato che i miR-21, -141 e -221/222 regolano direttamente e indirettamente l’AR, come evidenziato da un effetto sul ciclo cellulare, sull’apoptosi e sulla metastasi. L’espressione di Anti-OncomiR-34 dipende dal soppressore tumorale p53 e determina l’arresto del ciclo cellulare e l’apoptosi attraverso la downregulation di BCl2 e CyclinD1 [18–21].
Nuovi principi attivi per la terapia della CRPC
L’obiettivo di qualsiasi terapia in questa fase palliativa è ridurre le complicanze legate al tumore, mantenendo la qualità di vita e prolungando la sopravvivenza globale. Fino a qualche anno fa, la chemioterapia con docetaxel era il principale trattamento disponibile. Sulla base dei meccanismi di resistenza sopra citati, tuttavia, ad oggi sono state sviluppate diverse nuove sostanze con diversi bersagli (Fig. 1).
Nuove sostanze anti-androgene
Enzalutamide: l ‘enzalutamide (Xtandi®) è un antagonista orale selettivo dell’AR che inibisce l’attivazione dell’AR, la traslocazione nucleare e l’interazione con i geni dipendenti dagli androgeni. Nello studio AFFIRM, 1199 pazienti CRPC con progressione dopo docetaxel sono stati randomizzati al trattamento con enzalutamide (160 mg) o placebo. La sopravvivenza globale ha mostrato un beneficio di 18,4 vs. 13,6 mesi (HR 0,63; p<0,0001), corrispondente a una riduzione del rischio di mortalità del 37% [22]. Nello studio PREVAIL su 1717 pazienti con mCRPC prima di docetaxel, è stata condotta un’analisi ad interim dopo 540 decessi, che ha mostrato una riduzione del 29% della mortalità per enzalutamide (HR 0,71; p<0,0001) – così come una riduzione dell’81% del rischio di progressione radiografica o di morte, entrambi rispetto al placebo. Gli effetti collaterali sono stati principalmente stanchezza, diarrea e vampate di calore [23].
Abiraterone: come inibitore del CYP17, l’abiraterone (Zytiga®) inibisce la biosintesi degli androgeni nelle ghiandole surrenali, nei testicoli ma anche nelle stesse cellule tumorali. L’effetto è stato dimostrato in due studi di fase III in cui abiraterone è stato testato rispetto al placebo sia dopo (COU-AA-301) [24] che prima (COU-AA-302) [25] della terapia con docetaxel. Dopo la chemioterapia, i pazienti con abiraterone hanno mostrato una sopravvivenza significativamente prolungata di 4,6 mesi (HR 0,74). Prima della chemioterapia, è stato dimostrato un miglioramento significativo della PFS. Lo studio è stato interrotto in anticipo a causa dei dati positivi. Dopo un follow-up di oltre quattro anni, c’è stata una riduzione del rischio di mortalità del 19% (34,7 vs. 30,3 mesi; HR 0,81; p=0,0033) per il gruppo abiraterone [26].
Chemioterapici
Docetaxel: il docetaxel (Taxotere®) 75 mg/m2 ogni tre settimane è il trattamento standard per la mCRPC dallo studio Tax327. Il docetaxel 50 mg/m2 ogni quindici giorni ha meno effetti collaterali, senza essere inferiore alla somministrazione trisettimanale in termini di tempo al fallimento del trattamento [27,28].
Cabazitaxel: il cabazitaxel (Jevtana®) è un taxano legato alla tubulina con bassa affinità per la p-glicoproteina (efflusso di farmaci). Nello studio TROPIC sono stati studiati 755 uomini con una progressione dopo il docetaxel. Cabazitaxel con prednisone (10 mg/d) ha mostrato un prolungamento significativo della sopravvivenza globale di 2,4 mesi rispetto al mitoxantrone. I principali effetti collaterali sono la soppressione del mielon e la diarrea [29].
Radioterapia
Alpharadin, radium223: Alpharadin, radium223, è un emettitore alfa con una bassa profondità di penetrazione (<100 μm) e un’emivita di 11,4 giorni. Viene immagazzinato al posto del calcio e porta a rotture del doppio filamento di DNA nelle metastasi ossee. Nello studio di fase III ALSYMPCA, oltre 900 pazienti con mCRPC osseo sintomatico, già sottoposti a terapia con docetaxel o non eleggibili, hanno ricevuto sei iniezioni i.v. di Ra223 a intervalli di quattro settimane o placebo. Ciò ha comportato un vantaggio di sopravvivenza globale per Ra223 del 30% (HR 0,699; p=0,0022) e un tempo prolungato alla prima SRE del 34% (HR 0,66; p<0,001). [30]).
Immunoterapia
Sipuleucel-T: la leucoaferesi viene utilizzata per isolare le cellule mononucleari del sangue, che vengono poi incubate e reinfuse con una proteina ricombinante contenente fosfatasi acida prostatico-specifica e GM-CSF. Nello studio pivotal IMPACT, sipuleucel-T ha mostrato una riduzione del 22,5% del rischio di mortalità (HR 0,78; p=0,03) e un aumento significativo di 4,1 mesi della sopravvivenza [31]. Sebbene sia stato approvato negli Stati Uniti, in questo studio si deve notare che nel gruppo di controllo le cellule mononucleari del sangue non sono state reinfuse e questo potrebbe portare a un indebolimento del sistema immunitario.
Terapia ossea
In caso di metastasi ossee, la terapia con denosumab o bifosfonato deve essere somministrata per la prevenzione. Se necessario, devono essere avviate ulteriori terapie, dagli analgesici a interventi come la radioterapia palliativa o la chirurgia, per evitare una riduzione della qualità di vita [1].
Sequenza terapeutica
L’aggressività del trattamento deve essere adattata alla situazione generale individuale del paziente – tra l’altro con l’obiettivo di migliorare la qualità della vita. La migliore sequenza delle nuove modalità terapeutiche non è chiara.
Terapia di prima linea del CRPC
Il momento ottimale per iniziare la terapia non è chiaro. Il trattamento è indicato nella mCRPC sintomatica, nel rapido raddoppio dei livelli di PSA (<2 mesi) e in presenza di (nuove) metastasi viscerali [32].
PCa metastatizzato sensibile agli ormoni: occorre menzionare brevemente lo studio CHAARTED (Chemo HormonalTherapy Versus Androgen Ablation Randomised Trialfor Extensive Diseasein Prostate Cancer). Attualmente, l’ADT è lo standard di cura per il cancro alla prostata metastatico ma sensibile agli ormoni. Questo standard è stato confrontato nello studio CHAARTED con la combinazione di ADT più un massimo di sei cicli di chemioterapia con docetaxel (75 mg/m2, tre volte alla settimana). I risultati mostrano un vantaggio di sopravvivenza statisticamente significativo di 17 mesi per la PFS e la OS a favore della terapia combinata chemio-ormone [33,34].
CRPC asintomatico senza metastasi (M0) con PSA in aumento: si tratta di uno stadio tumorale raro (circa il 5%), che solleva la questione se le metastasi non siano state semplicemente rilevate con l’imaging attuale. Di conseguenza, dovrebbe essere effettuata una nuova stadiazione; l’inizio ottimale della terapia non è chiaro. Se possibile, questi pazienti dovrebbero essere inclusi negli studi attualmente in corso.
MCRPC asintomatico o minimamente sintomatico senza metastasi viscerali: Possono essere presi in considerazione l’abiraterone e l’enzalutamide (in aggiunta all’ADT). Non esistono dati comparativi diretti e raccomandazioni per entrambe le sostanze. Si è osservato che i pazienti con una bassa risposta all’ADT (meno di dodici mesi) hanno una risposta più scarsa a ulteriori terapie anti-ormonali e pertanto si raccomanda il docetaxel di prima linea piuttosto che l’abiraterone [35,36].
MCRPC sintomatico senza e con metastasi viscerali: La terapia con docetaxel deve essere iniziata nei pazienti sintomatici senza metastasi viscerali. In caso di metastasi prevalentemente ossee, si può proseguire la terapia con Alpharadin. Se sono presenti metastasi viscerali, si raccomanda la chemioterapia con docetaxel [36].
Sequenza terapeutica/terapia di seconda linea del CRPC
Non ci sono dati chiari sulla sequenza ottimale delle varie sostanze, ma ci sono risultati orientativi che dovrebbero essere presi in considerazione.
Non esiste uno studio che confronti direttamente abiraterone prima e dopo la terapia con docetaxel. I dati possono essere interpolati solo da COU-AA-301 e COU-AA-302 e suggeriscono una migliore efficacia in termini di calo del valore del PSA per abiraterone prima della chemioterapia. Al contrario, esistono dati indiretti secondo cui una precedente terapia con abiraterone influisce negativamente sulla successiva terapia con docetaxel in termini di diminuzione del livello di PSA, ma anche di OS. Il beneficio in termini di sopravvivenza osservato in COU-AA-302 si è verificato soprattutto nei pazienti con poco dolore e PSA ≤114 ng/mL, suggerendo un inizio precoce. Merseburger et al. concludono che i pazienti senza queste variabili dovrebbero essere avviati alla chemioterapia precoce [37]. Per i pazienti con progressione rapida durante o poco dopo (meno di tre mesi) la terapia con docetaxel, Cathomas et al. raccomandano. più probabilità di iniziare la chemioterapia di seconda linea con cabazitaxel [32]. A complicare le cose ci sono indicazioni di resistenza incrociata nell’uso di abiraterone ed enzalutamide, che implicano una risposta clinicamente più scarsa della rispettiva somministrazione secondaria, così come indicazioni di resistenza incrociata tra queste sostanze e i taxani [38].
Biomarcatori, monitoraggio e cambio di terapia
Attualmente non esistono biomarcatori in grado di prevedere se i pazienti con mCRPC risponderanno meglio alla chemioterapia con taxani o alla terapia ormonale. In che misura gli approcci attuali, come le cellule tumorali circolanti, potrebbero essere utili, resta da vedere con entusiasmo. Dati recenti mostrano che, ad esempio, la variante 7 di AR nelle CTC è associata alla resistenza ad abiraterone ed enzalutamide [39]. Il monitoraggio della terapia attraverso il controllo del valore del PSA è difficile a causa delle fluttuazioni del PSA descritte con i farmaci moderni o anche della mancata risposta all’alfaradin o all’immunoterapia. In linea di principio, non si dovrebbe cambiare la terapia solo sulla base di un aumento del valore del PSA, ma solo se, ad esempio, si aggiunge una progressione radiologica e/o un peggioramento della malattia da parte dell’AZ [35].
Nuove sostanze
Sperimentalmente, si stanno testando molte nuove sostanze che affrontano i suddetti cambiamenti AR-dipendenti e AR-indipendenti. La loro descrizione va oltre lo scopo di questa recensione, quindi si rimanda all’abstract “Targeting the adaptive molecular landscape of castration-resistant prostate cancer” [40].
Letteratura:
- Heidenreich A, et al: Linee guida EAU sul cancro alla prostata. Parte II: Trattamento del cancro alla prostata avanzato, recidivante e resistente alla castrazione. Urologia Europea 2014; 65(2): 467-479.
- Heidenreich A, et al: Linee guida EAU sul cancro alla prostata. parte 1: screening, diagnosi e trattamento locale con intento curativo – aggiornamento 2013. Urologia Europea 2014; 65(1): 124-137.
- Penning TM: Meccanismi di resistenza ai farmaci che hanno come bersaglio l’asse degli androgeni nel carcinoma prostatico resistente alla castrazione (CRPC). Il Journal of steroid biochemistry and molecular biology 2015; 153; 105-113.
- Chen CD, et al.: Determinanti molecolari della resistenza alla terapia antiandrogena. Medicina naturale 2004; 10(1): 33-39.
- Edwards J, et al: Amplificazioni geniche associate allo sviluppo del cancro alla prostata resistente agli ormoni. Clinical cancer research: an official journal of the American Association for Cancer Research 2003; 9(14): 5271-5281.
- Gregory CW, et al: La stabilizzazione del recettore degli androgeni nel cancro alla prostata ricorrente è associata all’ipersensibilità agli androgeni bassi. Ricerca sul cancro 2001; 61(7): 2892-2898.
- Montgomery RB, et al: Mantenimento degli androgeni intratumorali nel cancro alla prostata metastatico: un meccanismo per la crescita tumorale resistente alla castrazione. Cancer Res 2008; 68(11): 4447-4454.
- Locke JA, et al: I livelli di androgeni aumentano attraverso la steroidogenesi intratumorale de novo durante la progressione del cancro alla prostata resistente alla castrazione. Cancer Res 2008; 68(15): 6407-6415.
- Brooke GN, Bevan CL: Il ruolo delle mutazioni del recettore degli androgeni nella progressione del cancro alla prostata. Current Genomics 2009; 10(1): 18-25.
- Steinkamp MP, et al.: Le mutazioni del recettore degli androgeni dipendenti dal trattamento nel cancro alla prostata sfruttano molteplici meccanismi per eludere la terapia. Cancer Res 2009; 69(10): 4434-4442.
- Hornberg E, et al.: L’espressione di varianti splice del recettore degli androgeni nelle metastasi ossee del cancro alla prostata è associata alla resistenza alla castrazione e alla breve sopravvivenza. PloS one 2011; 6(4): e19059.
- Katsogiannou M, et al: I tratti distintivi dei tumori della prostata resistenti alla castrazione. Cancer Treatment Reviews 2015; 41(7): 588-597.
- McDonnell TJ, et al: Espressione del protooncogene bcl-2 nella prostata e sua associazione con l’insorgenza del cancro alla prostata indipendente dagli androgeni. Cancer Res 1992; 52(24): 6940-6944.
- July LV, et al: L’espressione di clusterina è significativamente aumentata nelle cellule di cancro alla prostata dopo la terapia di sospensione degli androgeni. La Prostata 2002; 50(3): 179-188.
- Rocchi P, et al: L’aumento di Hsp27 dopo l’ablazione degli androgeni facilita la progressione indipendente dagli androgeni nel cancro alla prostata attraverso la soppressione dell’apoptosi mediata dai trasduttori di segnale e dagli attivatori della trascrizione 3. Cancer Res 2005; 65(23): 11083-11093.
- Sarker D, et al.: Prendere di mira il percorso PI3K/AKT per il trattamento del cancro alla prostata. Clinical cancer research: an official journal of the American Association for Cancer Research 2009; 15(15): 4799-4805.
- Burchardt M, et al.: La riduzione della funzione p53 di tipo selvaggio conferisce un fenotipo resistente agli ormoni alle cellule di cancro alla prostata LNCaP. La Prostata 2001; 48(4): 225-230.
- Galardi S, et al.: L’espressione dei miR-221 e dei miR-222 influisce sul potenziale di proliferazione delle linee cellulari di carcinoma prostatico umano, prendendo di mira p27Kip1. Il Journal of biological chemistry 2007; 282(32): 23716-23724.
- Mercatelli N, et al.: L’inibizione dei miR-221 e miR-222 altamente espressi ostacola la crescita degli xenotrapianti di carcinoma prostatico nei topi. PloS one 2008; 3(12): e4029.
- Liu C, et al.: Il microRNA miR-34a inibisce le cellule staminali del cancro alla prostata e le metastasi, reprimendo direttamente il CD44. Medicina naturale 2011; 17(2): 211-215.
- Spahn M, et al.: L’espressione del microRNA-221 è progressivamente ridotta nel cancro alla prostata aggressivo e nelle metastasi e predice la recidiva clinica. International Journal of Cancer 2010; 127(2): 394-403.
- Sternberg CN, et al: Miglioramento degli esiti nei pazienti anziani con carcinoma prostatico metastatico resistente alla castrazione trattati con l’inibitore del recettore degli androgeni enzalutamide: risultati dello studio di fase III AFFIRM. Annali di Oncologia: rivista ufficiale della Società Europea di Oncologia Medica/ESMO 2014; 25(2): 429-434.
- Beer TM, et al: Enzalutamide nel carcinoma prostatico metastatico prima della chemioterapia. The New England Journal of Medicine 2014; 371(5): 424-433.
- de Bono JS, et al: Abiraterone e aumento della sopravvivenza nel cancro alla prostata metastatico. The New England Journal of Medicine 2011; 364(21): 1995-2005.
- Ryan CJ, et al: Abiraterone nel cancro alla prostata metastatico senza precedente chemioterapia. The New England Journal of Medicine 2013; 368(2): 138-148.
- Ryan CJ, et al: Abiraterone acetato più prednisone rispetto a placebo più prednisone in uomini naïve alla chemioterapia con carcinoma prostatico metastatico resistente alla castrazione (COU-AA-302): analisi finale della sopravvivenza globale di uno studio di fase 3 randomizzato, in doppio cieco, controllato con placebo. The Lancet Oncology 2015; 16(2): 152-160.
- Tannock IF, et al: Docetaxel più prednisone o mitoxantrone più prednisone per il cancro alla prostata avanzato. The New England Journal of Medicine 2004; 351(15): 1502-1512.
- Kellokumpu-Lehtinen PL, et al: Docetaxel bisettimanale rispetto a docetaxel trisettimanale per il trattamento del carcinoma prostatico avanzato resistente alla castrazione: studio randomizzato di fase 3. The Lancet Oncology 2013; 14(2): 117-124.
- de Bono JS, et al: Prednisone più cabazitaxel o mitoxantrone per il carcinoma prostatico metastatico resistente alla castrazione in progressione dopo il trattamento con docetaxel: uno studio randomizzato in aperto. Lancet 2010; 376(9747): 1147-1154.
- Parker C, et al: Emettitore alfa radio-223 e sopravvivenza nel cancro alla prostata metastatico. The New England Journal of Medicine 2013; 369(3): 213-223.
- Kantoff PW, et al: Immunoterapia con Sipuleucel-T per il cancro alla prostata resistente alla castrazione. The New England Journal of Medicine 2010; 363(5): 411-422.
- Cathomas R, Steuber T, Gillessen S: Carcinoma prostatico metastatico: basi della terapia nel 2013. Vienna Clin Mag 2013; 16(6): 20-25.
- Fizazi K, Jenkins C, Tannock IF: Il docetaxel dovrebbe essere lo standard di cura per i pazienti con carcinoma prostatico metastatico ormono-sensibile? Pro e contro. Annals of Oncology : rivista ufficiale della Società Europea di Oncologia Medica/ESMO 2015; 26(8): 1660-1667.
- Sweeney CJ, Chamberlain D: Approfondimenti sull’E3805: lo studio CHAARTED. Oncologia futura 2015; 11(6): 897-899.
- Gillessen S, et al: Gestione dei pazienti con carcinoma prostatico avanzato: raccomandazioni della St Gallen Advanced Prostate Cancer Consensus Conference (APCCC) 2015. Annals of Oncology: official journal of the European Society for Medical Oncology/ESMO 2015; 26(8): 1589-1604.
- Parker C, et al: Cancro della prostata: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Annals of Oncology: rivista ufficiale della Società Europea di Oncologia Medica/ESMO 2015.
- Merseburger AS, et al: [Castration resistant prostate cancer 2015]. Urologia attuale 2015; 46(1): 59-65.
- van Soest RJ, et al: La resistenza incrociata tra i taxani e i nuovi agenti ormonali abiraterone ed enzalutamide può influenzare la scelta della sequenza di farmaci nel carcinoma prostatico metastatico resistente alla castrazione. European Journal of Cancer 2013; 49(18): 3821-3830.
- Antonarakis ES, et al: AR-V7 e resistenza a enzalutamide e abiraterone nel cancro alla prostata. The New England Journal of Medicine 2014; 371(11): 1028-1038.
- Wyatt AW, Gleave ME: Puntare sul paesaggio molecolare adattivo del cancro alla prostata resistente alla castrazione. Medicina molecolare EMBO 2015; 7(7): 878-894.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(11-12): 14-19