Nonostante tutti i progressi medici, i difetti cardiaci congeniti corretti (AHF) non sono difetti cardiaci “curati”. A lungo termine, possono verificarsi problemi cardiovascolari come aritmie cardiache, insufficienza cardiaca o ipertensione polmonare, nonostante la correzione riuscita. In circa il 10-15% di tutte le gravidanze di donne con AHF, si verificano complicazioni cardiache che mettono in pericolo madre e figlio. La consulenza preconcettuale e la valutazione dei rischi sono necessarie per garantire che le donne che desiderano avere figli possano prendere una decisione informata a favore o contro la gravidanza. Sono essenziali conoscenze specifiche sul difetto cardiaco e sugli effetti previsti della gravidanza. La successiva assistenza prenatale richiede una stretta collaborazione tra ostetrici e cardiologi. A seconda della complessità del difetto cardiaco e degli interventi eseguiti, è necessaria un’assistenza presso un centro terziario. Nella stragrande maggioranza dei casi, il parto vaginale è la modalità di nascita consigliata dal punto di vista cardiaco. Le complicazioni possono verificarsi solo nel puerperio. A seconda del difetto cardiaco, non è consigliabile una dimissione precoce dopo la nascita.
I difetti cardiaci congeniti (AHF) sono i difetti congeniti più comuni e si riscontrano nello 0,8% di tutti i nati vivi. Grazie ai progressi medici degli ultimi decenni, oltre il 90% dei bambini con AHF raggiunge oggi l’età adulta. Nonostante questo sviluppo, i difetti cardiaci corretti non sono di solito la stessa cosa dei difetti cardiaci “curati”. Nel decorso a lungo termine, possono verificarsi vari problemi cardiovascolari, come aritmie cardiache, degenerazione della valvola o del condotto, insufficienza cardiaca o ipertensione polmonare. Le madri con AHF rappresentano il gruppo più numeroso di donne in gravidanza con malattie cardiache nei Paesi occidentali. Nel Registro di Gravidanza della Società Europea di Cardiologia (ESC), due terzi delle madri >1300 incluse hanno AHF, il 25% ha una malattia valvolare degenerativa (ad esempio dopo la febbre reumatica), il 7% ha una cardiomiopatia e il 2% una cardiopatia coronarica [1]. A causa delle possibili complicazioni a lungo termine, nonostante la correzione del difetto cardiaco, le donne con AHF hanno un rischio otto volte maggiore di eventi cardiovascolari, definiti come morte, insufficienza cardiaca scompensata, aritmie che richiedono un trattamento, evento cerebrovascolare o embolia sistemica. I decessi si verificano in 150 gravidanze su 100.000 con AHF contro 8 gravidanze su 100.000 senza difetti cardiaci [2].
La gravidanza è un carico emodinamico per tutte le donne. Alla fine del secondo/inizio del terzo trimestre, la resistenza periferica diminuisce del 40-70%, il volume sanguigno aumenta del 30-50%, la frequenza cardiaca aumenta di 10-20 battiti al minuto e la gittata cardiaca aumenta del 30-50%. In parole povere, la gravidanza è una situazione di “alta produzione, bassa resistenza” con un’ulteriore tendenza protrombotica [3]. A seconda della riserva contrattile del ventricolo sistemico, dell’emodinamica post-operatoria, dell’entità dei substrati aritmogeni esistenti o degli shunt residui, aumenta il rischio di complicanze legate alla gravidanza. Le donne con AHF e il desiderio di avere figli, che hanno evitato di sottoporsi a cure regolari fin dall’infanzia per vari motivi, non di rado vengono indirizzate a una valutazione cardiologica dal loro medico di famiglia o dal ginecologo in vista di una gravidanza. In questo caso, una valutazione completa del sito è ancora più importante, in quanto possono presentare risultati emodinamici che richiedono un intervento prima di una possibile gravidanza [4]. A seconda della complessità del difetto cardiaco, è necessario rivolgersi a un centro specializzato. I centri specializzati in Svizzera sono elencati su www.sgk-watch.ch.
Consulenza preconcettuale
Le discussioni sulla pianificazione familiare e sulla contraccezione dovrebbero iniziare nell’adolescenza, per evitare gravidanze non pianificate o molto rischiose, se possibile. Durante questa consulenza, viene valutato, tra l’altro, il rischio di gravidanza per la madre e il bambino. L’obiettivo è quello di consentire alle pazienti con AHF di prendere una decisione informata sull’opportunità o meno di affrontare i rischi della gravidanza (Tab. 1) . A seconda del difetto cardiaco e dell’anamnesi familiare, questa valutazione del rischio può includere una raccomandazione per un test genetico.
Valutazione del rischio materno
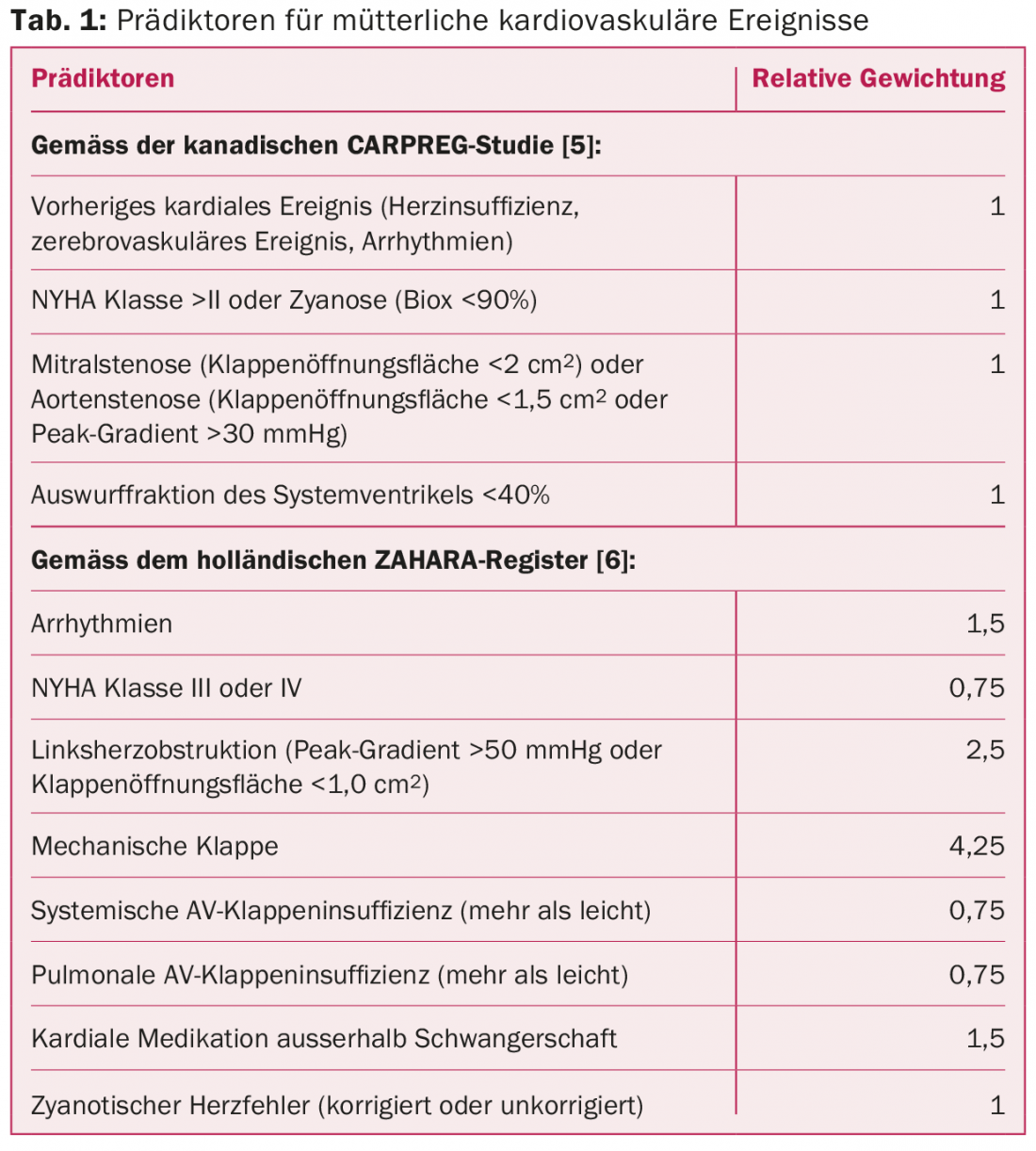
Negli studi prospettici, le complicazioni cardiache si sono verificate nelle donne con AHF in una media del 10-15% di tutte le gravidanze [5,6]. Questi includono aritmie, insufficienza cardiaca scompensata, insulti cerebrovascolari, eventi embolici, endocardite, infarto miocardico e, nel peggiore dei casi, morte cardiaca. Il tasso di complicanze dipende dalla complessità del difetto cardiaco. La performance individuale della paziente prima della gravidanza ci permette di dedurre la sua riserva funzionale e di stimare come gli aggiustamenti emodinamici saranno tollerati nel contesto della gravidanza. I diversi punteggi di rischio consentono una stima approssimativa della probabilità di complicazioni, che viene integrata dagli aspetti specifici del difetto cardiaco in una seconda fase. La Tabella 1 elenca vari predittori di complicazioni cardiache durante la gravidanza.
Una valutazione del rischio semplice e ben validata è fornita anche dalle Linee guida europee sulle malattie cardiache e la gravidanza [7]. Qui si distinguono quattro classi di rischio (Tab. 2).

Nella classe di rischio più bassa OMS I, non ci si deve aspettare un aumento della mortalità, che viene considerato piccolo. Nella classe di rischio IV, la gravidanza deve essere fortemente sconsigliata. Nella classe OMS II il rischio di complicazioni è considerato moderato e nella classe OMS III elevato. Si raccomanda che le donne di classe di rischio OMS I siano valutate cardiologicamente una o due volte durante la gravidanza, le donne di classe OMS II una volta per trimestre e le donne di classe OMS III mensilmente o ogni due mesi. Le donne nelle classi di rischio OMS II-III con ulteriori predittori sfavorevoli o le donne nelle classi OMS III e IV dovrebbero essere affiliate durante la gravidanza a un centro terziario dove un team di ostetrici, cardiologi specializzati con esperienza nella cura di adulti con AHF, anestesia e neonatologia sono coinvolti nel piano di trattamento.
Più difficile da valutare rispetto al rischio materno è la probabilità di complicazioni fetali e neonatali. I possibili fattori di rischio sono elencati nella tabella 3. Sebbene questi fattori di rischio fossero significativamente associati a un esito sfavorevole nei rispettivi studi, gli studi prospettici successivi hanno potuto confermare il loro valore predittivo solo in misura limitata [8].

Rischio di eredità
Nei genitori con AHF, l’ecocardiografia fetale viene eseguita alla 18°-22° settimana di gravidanza. Il momento consigliato per questo è una settimana di gravidanza [7]. A questo punto, lo sviluppo del cuore è completo e sono evidenti i principali difetti cardiaci. Il rischio che il feto di una donna incinta con AHF possa essere a sua volta affetto da AHF è del 3-12%, rispetto al rischio dello 0,8% nella popolazione generale. Alcuni difetti cardiaci possono anche essere associati ad anomalie cromosomiche (ad esempio, la tetralogia di Fallot con microdelezione 22q11). In questi casi, il rischio di ereditarietà è fino al 50% e si dovrebbe parlare di consulenza genetica preconcezionale e di chiarimenti.
Farmaci cardiaci
Alcuni farmaci devono essere interrotti in tempo durante la gravidanza. Questi includono, ad esempio, gli ACE-inibitori o gli antagonisti del recettore dell’angiotensina, gli antagonisti del recettore dell’endotelina, l’amiodarone e le statine. Le linee guida ESC forniscono un’utile panoramica dei farmaci che possono essere utilizzati e di quelli che dovrebbero essere evitati durante la gravidanza e l’allattamento [7]. Per le pazienti con valvole cardiache meccaniche e la necessità di anticoagulazione orale, il pendolo delle raccomandazioni sta attualmente oscillando verso il proseguimento della terapia con antagonisti della vitamina K durante la gravidanza. Recentemente, anche le linee guida americane sconsigliano di utilizzare l’eparina non frazionata o l’eparina a basso peso molecolare come unico anticoagulante durante la gravidanza [9]. L’anticoagulazione orale con antagonisti della vitamina K ed eparina a basso peso molecolare durante la sesta-dodicesima settimana di gravidanza è proposta come soluzione, poiché il rischio di fetopatia indotta da Marcoumar è più elevato in questo periodo. Quando si utilizza l’eparina a basso peso molecolare durante la gravidanza, si deve notare che un dosaggio del farmaco puramente adattato al peso è insufficiente ed è necessario un dosaggio di dodici ore. Si raccomanda di determinare l’attività del fattore Xa (intervallo target 0,8-1,2 U/ml, 4-6 ore dopo la somministrazione) con cadenza almeno quindicinale.
Insufficienza cardiaca
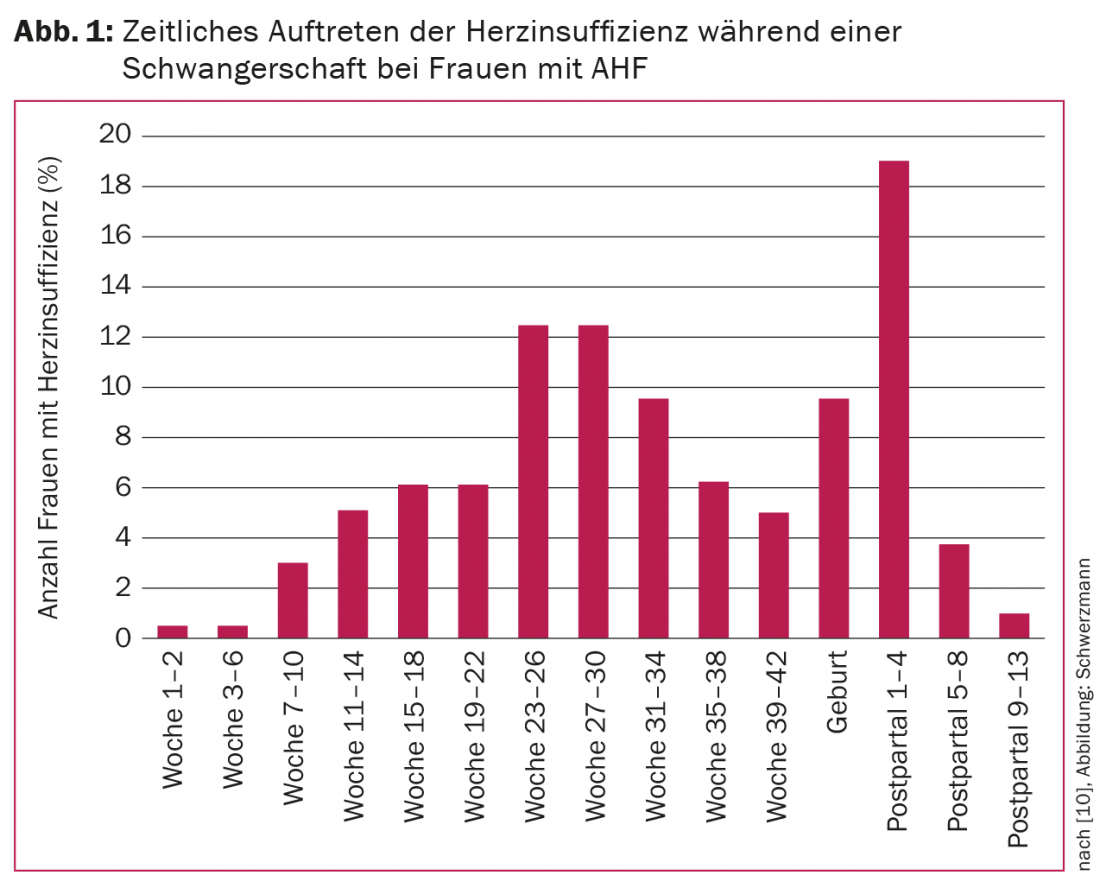
L’insufficienza cardiaca progressiva è una delle complicazioni più comuni durante la gravidanza con AHF. Nell’ostruzione ventricolare sinistra, l’insufficienza cardiaca si verifica spesso alla fine del secondo trimestre; nella cardiomiopatia preesistente (ventricolo destro sistemico, cardiopatia ipertrofica, tetralogia di Fallot, cardiomiopatia) si verifica più frequentemente nel peri- e nel primo post-partum. La Figura 1 mostra l’insorgenza temporale dell’insufficienza cardiaca nelle 173 donne su >1300 del registro ESC che hanno avuto uno scompenso cardiaco durante il decorso. Le madri con difetti cardiaci di classe di rischio III o IV dell’OMS, storia preesistente di insufficienza cardiaca (fattore di rischio più forte), cardiomiopatia nota, ipertensione polmonare o classe NYHA III o IV preconcezionale sono particolarmente a rischio. A seconda del rischio, la probabilità di insufficienza cardiaca è del 4-68%. La mortalità materna e fetale è del 5% ciascuna nelle donne in gravidanza con insufficienza cardiaca, rispetto allo 0,5% e all’1,2% delle donne senza insufficienza cardiaca [10].
Assistenza durante la gravidanza, il parto e il periodo post-partum
I controlli cardiologici in gravidanza hanno lo scopo di documentare i cambiamenti emodinamici indotti dalla gravidanza e, a seconda del decorso, di adeguare le raccomandazioni relative alla modalità del parto. A seconda della situazione, è necessario garantire ulteriori cambiamenti nella terapia farmacologica. Per esempio, la farmacocinetica del metoprololo cambia durante la gravidanza, per cui è necessario un successivo aumento della dose per ottenere un blocco beta stabile.
Da un punto di vista cardiaco, il parto vaginale è preferibile per la maggior parte delle pazienti, in quanto il rischio di emorragia, infezione e tromboembolia è inferiore rispetto al parto cesareo [7]. Inoltre, i cambiamenti dello stato volumetrico sono di solito meno bruschi e pronunciati con il parto vaginale. Sectio è consigliata nelle seguenti situazioni:
- I pazienti Marfan con diametro aortico
- >45 mm o con dilatazione aortica progressiva durante la gravidanza
- Dissezione aortica acuta o cronica
- Insufficienza cardiaca scompensata
- Stenosi aortica grave
- Ipertensione arteriosa polmonare
- Anticoagulazione orale con antagonisti della vitamina K nelle ultime due settimane prima del parto.
L’analgesia epidurale precoce è una componente importante per ridurre la produzione di catecolamine legata al dolore e i suoi effetti sul rischio aritmico e sulla circolazione. Il monitoraggio della circolazione della madre durante il parto dipende dalla situazione emodinamica iniziale. In caso di aumento del rischio di aritmia, si raccomanda un’elettrocardiogramma continuo e nei pazienti con cianosi situazionale, si raccomanda anche una misurazione Biox continua. Le attuali linee guida sull’endocardite non suggeriscono la schermatura antibiotica di routine né per il parto vaginale né per il parto cesareo, anche in presenza di situazioni ad alto rischio come le valvole cardiache artificiali [11].

Il parto è associato a marcati spostamenti di volume intravascolare e nei primi giorni post-partum, come già detto, c’è anche un aumento del rischio di insufficienza cardiaca. Un attento monitoraggio circolatorio in questi casi dovrebbe includere i primi giorni dopo la nascita. Circa quattro-sei mesi dopo la nascita, è necessaria una nuova valutazione cardiologica per poter documentare qualsiasi effetto sfavorevole a lungo termine della gravidanza sul difetto cardiaco. Questo tempo è necessario anche perché a quel punto gli effetti sull’emodinamica indotti dalla gravidanza sono completamente scomparsi.
Letteratura:
- Roos-Hesselink JW, et al: Esito della gravidanza in pazienti con cardiopatia strutturale o ischemica: risultati di un registro della Società Europea di Cardiologia. Eur Heart J 2013; 34(9): 657-665.
- Opotowsky AR, et al: Eventi cardiovascolari materni durante il parto tra le donne con cardiopatia congenita. Cuore 2012; 98(2): 145-151.
- Wald RM, Sermer M, Colman JM: Gravidanza e contraccezione nelle giovani donne con cardiopatia congenita: considerazioni generali. Paediatr Child Health 2011; 16(4): e25-29.
- Yeung E, et al: La mancanza di cure come fattore predittivo di morbilità negli adulti con cardiopatia congenita. Int J Cardiol 2008; 125(1): 62-65.
- Siu SC, et al: Studio prospettico multicentrico sugli esiti della gravidanza nelle donne con malattie cardiache. Circolazione 2001; 104(5): 515-521.
- Drenthen W, et al: Predittori di complicazioni della gravidanza in donne con cardiopatia congenita. Eur Heart J 2010; 31(17): 2124-2132.
- Linee guida ESC sulla gestione delle malattie cardiovascolari in gravidanza: la Task Force sulla gestione delle malattie cardiovascolari in gravidanza della Società Europea di Cardiologia (ESC). Eur Heart J 2011; 32(24): 3147-3197.
- Balci A, et al: Convalida prospettica e valutazione dei modelli di rischio cardiovascolare e della prole per le donne in gravidanza con cardiopatia congenita. Cuore 2014; 100(17): 1373-1381.
- Nishimura RA, Warnes CA: Anticoagulazione durante la gravidanza nelle donne con valvole protesiche: prove, linee guida e domande senza risposta. Cuore 2015; 101(6): 430-435.
- Ruys TP, et al: Insufficienza cardiaca nelle donne in gravidanza con malattie cardiache: dati del ROPAC. Cuore 2014; 100(3): 231-238.
- Habib G, et al.: Linee guida sulla prevenzione, la diagnosi e il trattamento dell’endocardite infettiva (nuova versione 2009): la Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis della Società Europea di Cardiologia (ESC). Approvato dalla Società Europea di Microbiologia Clinica e Malattie Infettive (ESCMID) e dalla Società Internazionale di Chemioterapia (ISC) per le infezioni e il cancro. Eur Heart J 2009; 30(19): 2369-2413.
CARDIOVASC 2015; 14(3): 4-8