La radioterapia dei tumori toracici, in particolare del carcinoma polmonare, si trova in bilico tra l’obiettivo di raggiungere la massima probabilità di controllo del tumore e la prevenzione delle tossicità. Un effetto collaterale rilevante è la polmonite radiogena. Questo si verifica con una latenza temporale da settimane a mesi dopo il completamento del trattamento.
La radioterapia dei tumori toracici, in particolare del carcinoma polmonare, si trova in bilico tra l’obiettivo di raggiungere la massima probabilità di controllo del tumore e la prevenzione delle tossicità.
Un effetto collaterale rilevante è la polmonite radiogena. Si verifica con una latenza temporale che va da settimane a mesi dopo il completamento del trattamento, con la maggior parte dei casi che compaiono nelle prime 8 settimane dopo la radioterapia [1]. Clinicamente, c’è spesso una triade sintomatologica di dispnea da sforzo, tosse non produttiva e ipossia, che contribuiscono alla marcata sensazione soggettiva di malattia del paziente. A differenza delle infezioni batteriche o virali, le febbri sono piuttosto rare, ma possono anche essere secondarie a superinfezioni. Nella fase acuta, la morfologia della TAC mostra un edema interstiziale. Questa condizione infiammatoria acuta può poi guarire spontaneamente o attraverso l’intervento farmacologico. Tuttavia, a lungo termine, è possibile anche la fibrosi del tessuto polmonare interessato, con conseguente restringimento. A seconda dell’entità di questi in relazione al polmone ancora funzionale, i disturbi restrittivi della funzione polmonare possono rimanere come residui irreversibili. Fortunatamente, i decorsi fatali della malattia sono rari e sono riportati in letteratura come inferiori al 2% [2].
Il meccanismo di base della radiopneumonite non è ancora stato completamente decifrato nella sua complessità. Il sistema alveolare è composto da pneumociti di tipo I e II. Mentre i pneumociti di tipo I, come cellule differenziate, rappresentano circa il 90% della superficie alveolare, le cellule di tipo II sintetizzano il tensioattivo e servono come pool di ripopolamento per le cellule di tipo I danneggiate [3]. La deplezione di queste cellule indotta dalle radiazioni comporta la perdita della funzione di barriera nell’alveolo e la riduzione dell’integrità microvascolare. Questi processi portano alla formazione di edema e innescano, tra l’altro, la migrazione dei macrofagi e il rilascio di citochine proinfiammatorie [4]. I pneumociti sopravvissuti possono anche differenziarsi in miofibroblasti e secernere il fattore di crescita trasformante beta (TGF-beta), che alla fine promuove lo sviluppo della fibrosi.
Classificazione della polmonite
La gravità della polmonite è classificata secondo i Criteri di Terminologia Comune per gli Eventi Avversi (CTCAE), versione 4.0: asintomatica (grado 1); sintomatica, necessità di farmaci, compromissione delle attività quotidiane (grado 2), sintomi gravi, necessità di ossigeno, compromissione delle attività quotidiane (grado 3) o disfunzione respiratoria pericolosa per la vita (grado 4). Negli studi clinici, il rischio di polmonite di grado 2 o 3 è particolarmente rilevante.
La probabilità di polmonite di qualsiasi grado nel trattamento primario definitivo del tumore polmonare avanzato è data dal 15 al 40%, a seconda della fonte di letteratura [1]. Tuttavia, questo effetto collaterale legato alla terapia gioca un ruolo anche nell’irradiazione di altre entità. Una meta-analisi di Tonison et al. [5], ad esempio, ha identificato 19 studi con 874 pazienti che hanno ricevuto la radioterapia per il cancro dell’esofago. Questo ha mostrato un tasso di polmonite di grado ≥2 del 6,6%. Un’analisi retrospettiva di Pinnix et al. [6] ha registrato la tossicità polmonare di 150 pazienti sottoposti a radioterapia consolidativa o di salvataggio che includeva il mediastino a causa di un linfoma. L’incidenza di polmonite indipendente dallo stadio è stata del 14%, con gradi clinicamente rilevanti ≥2 che si sono verificati nell’8% dei pazienti. La radioterapia adiuvante del carcinoma mammario può anche comportare una rilevante esposizione alle radiazioni dei polmoni, soprattutto durante l’irradiazione elettiva dei linfonodi mammari interni parasternali. Lo studio EORTC 22922/10925 [7] ha confrontato i risultati della radioterapia adiuvante alla ghiandola mammaria o alla parete toracica da sola con il trattamento aggiuntivo delle vie di drenaggio linfatico mammario interno e sopraclaveare mediale. L’analisi della tossicità mostra un aumento del tasso di polmonite dello 0,7% rispetto allo 0,1% (p<0,0012) con l’irradiazione estesa. Anche se questi valori appaiono numericamente bassi, bisogna tenere presente che la radioterapia adiuvante per il tumore al seno è un’indicazione standard assoluta in molti istituti di radiooncologia. Solo in Germania, ogni anno 70.000 donne ricevono una nuova diagnosi di tumore al seno, una gran parte delle quali si sottopone a irradiazione come parte del concetto terapeutico.
Esistono relazioni dose-risposta sia per il controllo del tumore che per la polmonite radiogena. In teoria, i carcinomi bronchiali di grandi dimensioni e locoregionalmente avanzati richiedono in particolare un’elevata dose di radiazioni nel volume bersaglio, la cui applicazione, tuttavia, è anche associata a un aumento delle dosi nel tessuto polmonare sano e a un maggiore rischio di polmonite. Tradizionalmente, gli oncologi radiologi utilizzano i dati della revisione QUANTEC (Quantitative Analysis of Normal Tissue Effects in the Clinic) come linea guida per valutare la sicurezza di un piano di radiazioni [8]. In questo, la letteratura sulla reazione alle radiazioni indotta dalla terapia sui tessuti normali è stata rivista sistematicamente. Per la valutazione dell’organo polmonare a rischio, si raccomanda di limitare la dose polmonare media a 20 Gy, al fine di mantenere il tasso di polmonite clinicamente manifesta al di sotto del 20%.
Rischio con carboplatino/paclitaxel
Oltre a questi valori guida dosimetrici, tuttavia, ci sono altri fattori di rischio legati al paziente e alla terapia che sono rilevanti. In una meta-analisi completa di Palma et al. [2], sono stati inclusi i dati di un totale di 836 pazienti provenienti da 12 studi e analizzati per quanto riguarda i predittori dell’insorgenza di penumonite di grado ≥2. Tutti i pazienti hanno ricevuto una radiochemioterapia simultanea alla diagnosi di NSCLC (carcinoma polmonare non a piccole cellule) e la dose mediana applicata è stata di 60 Gy. Il volume polmonare che ha ricevuto ≥20 Gy (il cosiddetto V20) potrebbe essere identificato come un parametro dosimetrico rilevante. Questo ha mostrato un OR di 1,03 per 1 aumento di V20 (p=0,008). È stato possibile dimostrare un aumento significativo del rischio per la chemioterapia combinata simultanea con le sostanze carboplatino e paclitaxel (OR 3,33 rispetto alla chemioterapia con cisplatino/etoposide, p<0,001). Per quanto riguarda l’età dei pazienti, c’era solo una tendenza ad un aumento del rischio (OR 1,24 per decade di vita, p=0,09). Tuttavia, l’analisi multivariata ha mostrato che il rischio più elevato di sviluppare una polmonite (>50%) era nella combinazione di età >65 anni e somministrazione contemporanea di carboplatino/paclitaxel.
In un moderno confronto randomizzato di due livelli di dose per la radioterapia del carcinoma polmonare non a piccole cellule (NSCLC), la polmonite ≥ grado 3 si è verificata nel 7% (braccio terapeutico 60 Gy) e nel 4% (braccio terapeutico 74 Gy) [9]. La sopravvivenza significativamente più scarsa nel braccio ad alto dosaggio non è quindi spiegata da un tasso di polmonite più elevato documentato, ma suggerisce comunque un’influenza delle conseguenze terapeutiche non registrate in combinazione con le comorbidità.
Le moderne tecniche di radioterapia, in particolare i metodi di radioterapia a intensità modulata (IMRT), consentono una riduzione rilevante della dose polmonare con una dose costante nel volume target rispetto alla pianificazione convenzionale 3D conformale. In uno studio prospettico di fase 1 condotto da Boyle et al. [10] 24 pazienti sono stati trattati con IMRT definitiva alla diagnosi di NSCLC avanzato e per il confronto è stato calcolato un piano di irradiazione corrispondente con tecnica 3D conformale. Questo ha mostrato un vantaggio dosimetrico dell’IMRT sia in termini di dose polmonare media (11,9 vs. 14,9 Gy, p
Un’altra possibilità per la riduzione della dose nel tessuto normale sano è la pianificazione del volume bersaglio basata sulla PET/CT con 18F-fluorodesossiglucosio–(18F-FDG). Questa procedura è diventata uno standard per la stadiazione del NSCLC e rileva con elevata sensibilità l’attività biologica di un primitivo, ma anche i possibili linfonodi mediastinici interessati. Nella pianificazione radioterapica convenzionale, a seconda della posizione del tumore, di solito vengono irradiate elettivamente anche le stazioni linfonodali mediastiniche drenanti, il che a volte comporta grandi volumi bersaglio. Allo stesso modo, a volte è difficile distinguere tra il tumore primario e l’atelettasia consecutiva nell’imaging TC convenzionale (ad esempio, in caso di ostruzione delle vie aeree), per cui nei casi dubbi, la contornazione è spesso un po’ più generosa.
Uno studio di pianificazione italiano [11] ha confrontato l’esposizione alla dose negli organi a rischio per 18 pazienti che dovevano ricevere la radioterapia primaria per il NSCLC localmente avanzato. Per ogni paziente sono stati creati diversi piani di trattamento individuali, in cui una versione includeva solo le strutture positive alla PET e un’altra versione irradiava anche i livelli linfonodali elettivi. Nel 33% dei pazienti, il downstaging è stato ottenuto sulla base dell’imaging PET, in particolare perché il coinvolgimento mediastinico di Ln non poteva più essere rilevato. Concentrando la radioterapia sui focolai positivi alla PET, è stato possibile ridurre la dose polmonare mediana da 20,5 a 15,5 Gy. Lo stesso vale per il V20, che è sceso dal 34 al 26%.
In uno studio prospettico randomizzato, Nestle et al. [12]se anche la sola radioterapia delle strutture PET-positive porti agli stessi risultati oncologici. Un totale di 205 pazienti con NSCLC localmente avanzato sono stati randomizzati a una pianificazione della radiochemioterapia primaria basata sulla PET o convenzionale. Con un tempo di follow-up mediano di 29 mesi, non è stato possibile dimostrare alcuno svantaggio della radioterapia basata sulla PET in termini di sopravvivenza libera da progressione. Il rischio di progressione locale dopo un anno era solo del 14% rispetto al 29% nel braccio standard (HR 0,57, CI 0,3-1,06). È quindi sicuro adattare il volume target per un paziente individualmente sulla base della PET-CT e quindi ridurlo significativamente se necessario.
In definitiva, ci si chiede se il miglioramento dei parametri dosimetrici si traduca effettivamente in una riduzione del tasso di espressione clinica della polmonite. Nel già citato studio di confronto della dose, condotto da Bradley et al. [9], l’IMRT e la vecchia tecnica conformale 3D erano consentite in entrambi i bracci. L’IMRT è stata utilizzata in pazienti con volumi bersaglio del tumore più grandi (mediana 486 vs 427 ml), ma è stata associata a un tasso inferiore di polmoniti ≥ grado 3 (3,5% vs 7,9%) e tendeva ad avere una sopravvivenza globale a 2 anni ancora migliore (53,2% vs 49,4%) [13].
Riduzione delle cuciture di sicurezza grazie al gating
Un’altra innovazione tecnica nel campo della radioterapia è l’implementazione di procedure di gating. Registrando e/o correggendo la mobilità respiratoria del tumore, questi consentono di ridurre i margini di sicurezza per il volume target di pianificazione (PTV), che tiene conto non solo dell’estensione clinica di un primitivo, ma anche delle imprecisioni posizionali quotidiane. Un approccio di questo tipo viene utilizzato, ad esempio, nella Ciò è possibile effettuando l’irradiazione in un’inspirazione profonda, che in letteratura viene spesso chiamata DIBH (Deep Inspiration Breath Hold). Per realizzarlo, la curva respiratoria del paziente viene registrata digitalmente tramite uno spirometro o con scanner di superficie e resa visibile su un display. I pazienti vengono quindi invitati a fare un respiro profondo tramite un segnale visivo o acustico. Se viene superato un valore di soglia precedentemente definito, l’aria viene fermata in questa posizione per circa 15 secondi. Solo durante questo periodo il dispositivo di trattamento, il cosiddetto acceleratore lineare, riceve il via libera per l’irradiazione, per cui i pazienti possono interrompere la terapia in qualsiasi momento. Dopo una breve “pausa di respirazione”, la procedura continua fino alla fine della sessione di trattamento giornaliera. Dopo una breve fase di familiarizzazione, molti pazienti hanno una tale familiarità con la gestione della procedura che respirano autonomamente al momento giusto sopra la soglia. Così imparano, per così dire, a controllare le radiazioni con il proprio respiro. Uno studio comparativo di Josipovic et al. [14] ha studiato le differenze dosimetriche tra il trattamento di “respirazione libera” e la DIBH per 10 pazienti con NSCLC avanzato e radioterapia primaria. A seconda della tecnica di irradiazione utilizzata, sia la dose polmonare media che la V20 potrebbero essere ridotte significativamente di circa il 20% ciascuna per mezzo della DIBH. In un’altra analisi, lo stesso gruppo di lavoro ha esaminato la questione se i pazienti con NSCLC avanzato siano adatti al trattamento con l’arresto respiratorio, nonostante la loro malattia di base ed eventualmente altre malattie secondarie polmonari (ad esempio la BPCO) [15]. In un’analisi intermedia di uno studio prospettico, siete giunti alla conclusione che circa il 70% dei pazienti esaminati è in grado di eseguire una DIBH di oltre 20 secondi e inoltre trae beneficio dosimetrico da questa tecnica.
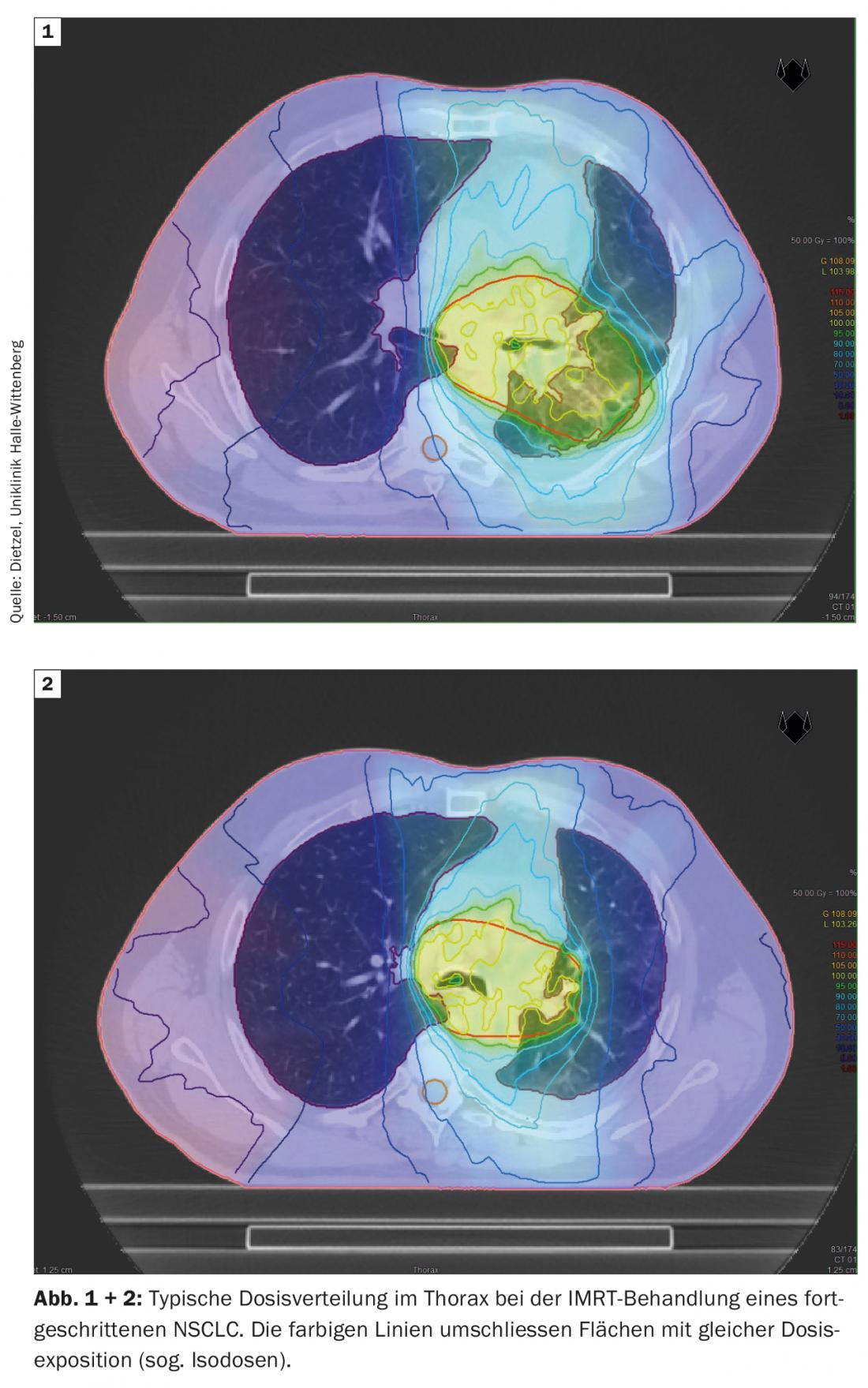
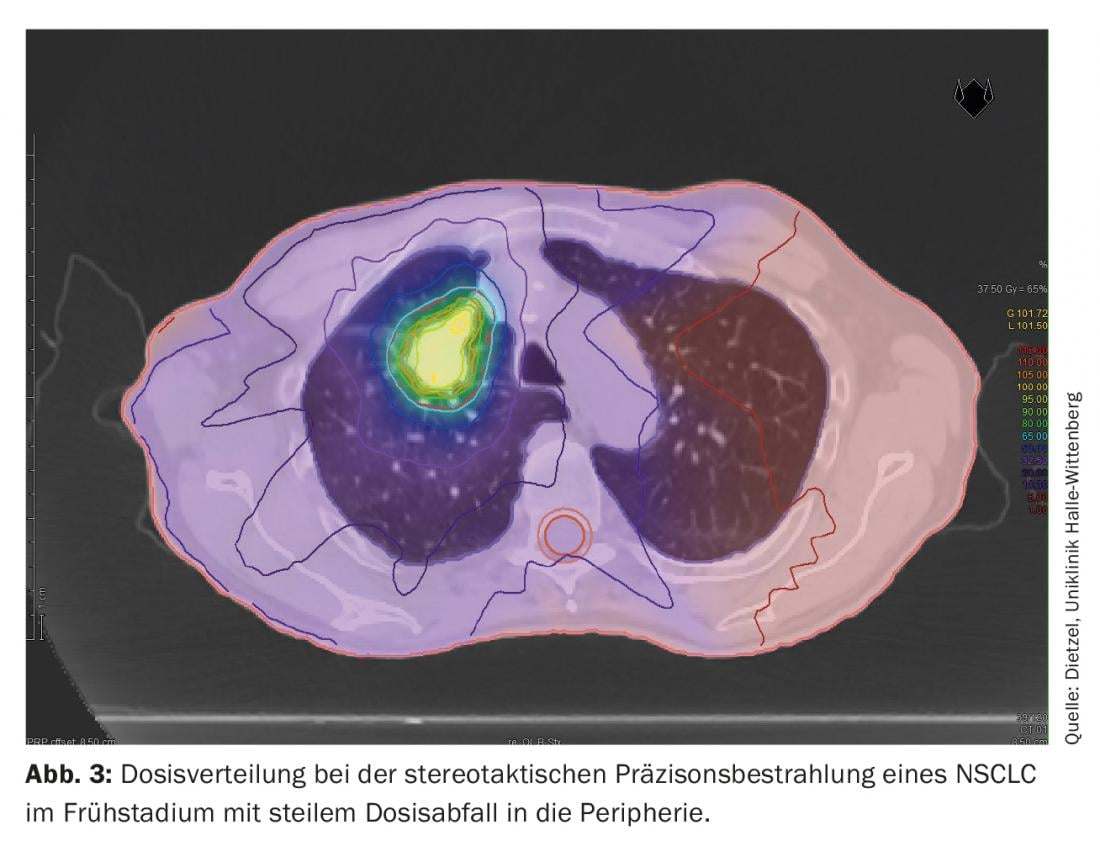
La tecnica DIBH svolge un ruolo decisivo anche nella radioterapia adiuvante del tumore al seno, soprattutto nel caso di tumori del lato sinistro, per evitare inutili dosi di radiazioni negli organi circostanti a rischio. In questo caso, l’effetto dell’insiprazione profonda viene utilizzato principalmente per risparmiare le strutture cardiache, sollevando la parete toracica dal pericardio e abbassando il cuore caudalmente. Tuttavia, come effetto collaterale positivo, l’aumento e lo spostamento del volume proteggono anche i polmoni. Sulla base di uno studio di pianificazione dell’Università Tecnica di Monaco, che ha preso in considerazione 31 pazienti con cancro al seno, è stato dimostrato che la DIBH può ridurre la dose media per il polmone sinistro del 19 ± 9% e il V20 del 24 ± 10% [16]. Mentre nel NSCLC di stadio III, i grandi volumi polmonari sono esposti a dosi più elevate e intermedie. (Fig. 1 e 2), Nella radioterapia stereotassica del NSCLC in fase iniziale, solo piccole sezioni del polmone sono esposte a dosi di radiazioni rilevanti. (Fig. 3), Per questo motivo il metodo viene utilizzato principalmente per i pazienti non operabili internamente – spesso con BPCO di grado elevato e talvolta con O2-obbligo – viene utilizzato. Anche in questo gruppo di pazienti selezionati negativamente, sono stati osservati solo tassi di polmonite di grado 2 e 3, rispettivamente del 7% e del 2%, con i regimi di dose standard [17].
L’immunoterapia apre nuove prospettive
L’introduzione dell’immunoterapia nel trattamento del NSCLC ha aperto nuove prospettive cliniche negli ultimi anni, che hanno contribuito a un miglioramento significativo della prognosi. Ad esempio, per la combinazione sequenziale di radiochemioterapia seguita da durvalumab come terapia primaria, come studiato nello studio PACIFIC, è stato possibile dimostrare una riduzione significativa del numero di pazienti trattati con durvalumab. è stato dimostrato un miglioramento della sopravvivenza a 2 anni dal 55,6% al 66,3% (p=0,005) [18]. Tuttavia, soprattutto per quanto riguarda la tossicità aggiuntiva dell’immunoterapia, attualmente si stanno raccogliendo solo esperienze fondate a lungo termine. Nella valutazione dello studio PACIFIC, è stato riportato solo un basso tasso di polmonite ≥ grado 3 del 3,4%, rispetto al 2,6% nel braccio di controllo (radiochemioterapia seguita da placebo) [18]. Nel trattamento combinato del NSCLC con radioterapia e immuno-oncologia, la polmonite deve essere considerata come una tossicità sovrapposta. I dati iniziali di uno studio di fase II sulla somministrazione contemporanea di nivolumab con la radiochemioterapia hanno mostrato un tasso di polmonite di grado 3 del 10,3%, considerato accettabile dagli autori, ma probabilmente aumentato rispetto alla sola radiochemioterapia [19].
Opzioni terapeutiche
Secondo le raccomandazioni per la terapia della polmonite radiogena nell’attuale linea guida S3 “Terapia di supporto nei pazienti oncologici” [20], il trattamento dovrebbe essere con steroidi. I regimi di dosaggio tipici comprendono una dose giornaliera di prednisone di 60-100 mg/tgl. iniziale, che si riduce lentamente in un periodo di 8-12 settimane [1]. Si tratta di una terapia sintomatica della fase infiammatoria acuta della malattia, che presumibilmente non influisce sullo sviluppo successivo della fibrosi [21]. Dopo una decisione caso per caso (ad esempio, in caso di sollievo insufficiente), la somministrazione di steroidi può essere integrata o sostituita da azatioprina o ciclosporina. La somministrazione profilattica di antibiotici è raccomandata solo per i pazienti con fattori di rischio (ad esempio, soppressione immunitaria, processi stenosanti, ecc.) Se la febbre è pronunciata, può essere somministrata una terapia antibiotica calcolata. Se questo non ha effetto, si deve cercare una conferma microbiologica, ad esempio attraverso un lavaggio bronchiale, per iniziare una terapia basata sul resistogramma o per escludere una polmonite fungina. Nella profilassi farmacologica, si sta discutendo della somministrazione di amifostina, che agisce come scavenger di radicali. Secondo la linea guida, l’applicazione può essere effettuata come uso off-label nei pazienti con radiochemioterapia pianificata. Attualmente non esiste un’opzione di trattamento efficace per la fibrosi preesistente.
In sintesi, la polmonite radiogena è un effetto collaterale rilevante della radioterapia, che può portare alla fibrosi polmonare cronica e quindi a un onere a lungo termine per il paziente. Tuttavia, la conoscenza delle relazioni dose-effetto rilevanti e dei fattori di rischio legati al paziente, insieme alla costante innovazione tecnica nel campo della radioterapia, ha portato al fatto che si può parlare di un rischio calcolabile.
Messaggi da portare a casa
- La polmonite radiogena è un effetto collaterale rilevante dopo l’irradiazione dei tumori toracici e in genere si manifesta solo dopo alcune settimane o mesi.
- Oltre alla fase infiammatoria acuta, nel corso della malattia si può sviluppare una fibrosi con sintomi cronici di accompagnamento.
- Oltre al carico polmonare radiogeno (dose polmonare media e V20), anche i fattori legati al paziente (età, comorbidità) e l’applicazione di terapie sistemiche simultanee hanno un’influenza sulla probabilità di espressione.
- Le moderne tecniche di radioterapia, come la radioterapia a intensità modulata (IMRT), il gating del respiro e la pianificazione basata sulla PET, consentono una riduzione significativa della dose indesiderata nell’area polmonare.
Letteratura:
- Jain V, et al: Pneumonite da radiazioni: vecchio problema, nuovi trucchi. Cancers 2018; 10 (7).
- Palma DA, et al: Previsione della polmonite da radiazioni dopo la chemioradioterapia per il cancro al polmone: una meta-analisi internazionale dei dati dei singoli pazienti. Int J Radiat Oncol Biol Phys 2013; 85 (2): 444-450.
- Giuranno L, et al: Lesione polmonare indotta da radiazioni (RILI). Front Oncol 2019; 9: 877.
- Citrin DE, et al: Ruolo della senescenza dei pneumociti di tipo II nella fibrosi polmonare indotta dalle radiazioni. J Natl Cancer Inst 2013; 105 (19): 1474-1484.
- Tonison JJ, et al: Polmonite da radiazioni dopo la radioterapia a intensità modulata per il cancro esofageo: dati istituzionali e revisione sistematica. Sci Rep 2019; 9 (1): 2255.
- Pinnix CC, et al: Predittori di polmonite da radiazioni nei pazienti sottoposti a radioterapia a intensità modulata per linfoma Hodgkin e non-Hodgkin. Int J Radiat Oncol Biol Phys 2015; 92 (1): 175-182.
- Matzinger O et al: Tossicità a tre anni con e senza irradiazione della catena linfonodale mammaria interna e sopraclaveare mediale nel carcinoma mammario di stadio da I a III (studio EORTC 22922/10925). Acta Oncol 2010; 49 (1): 24-34.
- Bentzen, et al: Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC): un’introduzione alle questioni scientifiche. Int J Radiat Oncol Biol Phys 2010; 76 (3 Suppl): 3-9.
- Bradley JD, et al: Radioterapia conformale a dose standard rispetto a quella ad alta dose con carboplatino concomitante e di consolidamento più paclitaxel con o senza cetuximab per i pazienti con carcinoma polmonare non a piccole cellule in stadio IIIA o IIIB (RTOG 0617): uno studio di fase 3 randomizzato, fattoriale due a due. Lancet Oncol 2015; 16 (2): 187-199.
- Boyle J, et al: Vantaggi dosimetrici della radioterapia a intensità modulata nel carcinoma polmonare localmente avanzato. Adv Radiat Oncol 2017; 2 (1): 6-11.
- Ceresoli GL, et al.: Ruolo della tomografia computerizzata e della fusione di immagini della tomografia ad emissione di positroni [18F] fluorodesossiglucosio nella radioterapia conformale del carcinoma polmonare non a piccole cellule: un confronto con le tecniche standard con e senza irradiazione linfonodale elettiva. Tumori 2007; 93 (1): 88-96.
- Nestle U, et al: Riduzione del volume target basata sull’imaging nella chemioradioterapia per il carcinoma polmonare non a piccole cellule localmente avanzato (PET-Plan): uno studio multicentrico, open-label, randomizzato e controllato. Lancet Oncol 2020; 21 (4): 581-592.
- Chun SG, et al: Impatto della tecnica di radioterapia a modulazione di intensità per il tumore al polmone non a piccole cellule localmente avanzato: un’analisi secondaria dello studio clinico randomizzato NRG Oncology RTOG 0617. J Clin Oncol 2017; 35 (1): 56-62.
- Josipovic M, et al: Radioterapia in apnea con ispirazione profonda per il carcinoma polmonare localmente avanzato: confronto tra diverse tecniche di trattamento sulla copertura del bersaglio, la dose polmonare e il tempo di somministrazione del trattamento. Acta Oncol 2013; 52 (7): 1582-1586.
- Persson GF, et al: Conformità alla respirazione profonda nella radioterapia per il cancro al polmone localmente avanzato. Int J Radiat Oncol Biol Phys 2017; 99 (2): Supplemento 2017: E491.
- Oechsner M, et al.: Respirazione profonda per l’irradiazione del seno sinistro: analisi degli istogrammi dose-massa e impatto dell’espansione polmonare. Radiat Oncol 2019; 14 (1): 109.
- Guckenberger M, et al.: Esiste un limite inferiore di funzione polmonare pre-trattamento per una radioterapia stereotassica corporea sicura ed efficace per il cancro al polmone non a piccole cellule in fase iniziale? J Thorac Oncol 2012; 7 (3): 542-551.
- Antonia SJ, et al: Sopravvivenza complessiva con Durvalumab dopo la chemioradioterapia nel NSCLC in stadio III. N Engl J Med 2018; 379 (24): 2342-2350.
- Peters S, et al: Valutazione della sicurezza di nivolumab aggiunto alla radioterapia in un regime standard di prima linea di chemio-radioterapia nel carcinoma polmonare non a piccole cellule in stadio III – Lo studio ETOP NICOLAS. Cancro al polmone 2019; 133: 83-87.
- Programma di linee guida oncologiche (Società tedesca per il cancro, Aiuto tedesco per il cancro, AWMF): Terapia di supporto nei pazienti oncologici – versione lunga 1.3, 2020, numero di registro AWMF: 032/054OL, www.leitlinienprogramm-onkologie.de/leitlinien/supportive-therapie; ultimo accesso: 24.08.2020.
- Sekine I, et al: Analisi retrospettiva della terapia steroidea per le lesioni polmonari indotte dalle radiazioni nei pazienti con cancro al polmone. Radiother Oncol 2006; 80 (1): 93-97.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2020; 2(4): 6-10