La conoscenza dei marcatori molecolari nella leucemia potrebbe aiutare a identificare i pazienti ad alto rischio in futuro. Inoltre, esiste la possibilità di sviluppare ulteriori approcci terapeutici mirati. Alcuni farmaci già approvati dimostrano la validità di questo percorso verso la terapia personalizzata.
Se si studia la patogenesi delle leucemie, la prima cosa che si nota è che il processo è molto eterogeneo, così come la varietà di malattie leucemiche che ne derivano. In primo luogo, le leucemie si verificano come risultato di cambiamenti genetici molecolari. Particolarmente colpiti sono i geni e i prodotti genici di, ad esempio, BCR-ABL, p53, DNMT3A, ecc. Ma quale ruolo diagnostico e, soprattutto, terapeutico svolgono queste mutazioni geniche?
Le mutazioni genetiche e le aberrazioni cromosomiche si verificano naturalmente in ogni persona sana con l’avanzare dell’età. Nelle persone di età superiore ai 70 anni, tali cambiamenti genetici possono essere riscontrati nel 10-50% di tutte le persone sottoposte al test. Tuttavia, non tutte queste persone anziane sviluppano la leucemia. In molti casi, la malattia è innescata da un accumulo clonale di mutazioni nell’ematopoiesi. Ciò significa che le cellule del sangue alterate formano un clone numericamente ingrandito e quindi diventano determinanti per il quadro ematico. Questa cosiddetta emopoiesi clonale (“emopoiesi clonale di potenziale indeterminato”, CHIP) è, secondo le attuali conoscenze, un fattore di rischio decisivo per la neoplasia ematologica. Inoltre, le aberrazioni cromosomiche nel sangue periferico e, negli uomini anziani, la perdita del cromosoma Y nelle cellule del sangue sono considerati fattori di rischio per lo sviluppo della leucemia.
Di marcatori genici e geni marcatori
La leucemia mieloide acuta (AML) è ancora spesso associata a una prognosi molto sfavorevole. Per i pazienti più anziani, in particolare, spesso non esistono o sono poche le opzioni terapeutiche mirate. Tuttavia, i bersagli genetici (come FLT3, IDH1/2, BCL2) consentono oggi di classificare meglio i pazienti e le rispettive prognosi (favorevole, intermedia, infausta) e di trattarli con l’aiuto delle prime terapie mirate.
Un cambiamento genetico che si verifica non di rado è la mutazione FLT3. Circa il 25% dei pazienti con AML presenta uno o più alleli per questo gene. La mutazione è considerata instabile e quindi causa diverse sensibilità alla terapia, che sicuramente gioca un ruolo importante per i futuri regimi di trattamento. Tuttavia, il primo studio di fase III al mondo specifico per il genotipo, chiamato RATIFY [1], su pazienti con AML e mutazione FLT3, ha dimostrato che la midostaurina, un inibitore multitarget della tirosin-chinasi, ha aumentato la sopravvivenza in combinazione con la chemioterapia. Inoltre, la sopravvivenza libera da eventi è aumentata da 3,2 a 8,2 mesi. Pertanto, dopo oltre 30 anni, la midostaurina, ora approvata, è considerata una vera e propria svolta nella terapia della LAM.
Un “blockbuster” delle future opzioni terapeutiche nella LAM è il venetoclax, un farmaco che agisce come bersaglio delle cellule staminali per BCL2 e che è attualmente in fase III di potenziale approvazione. Anche in monoterapia, finora sono stati dimostrati buoni tassi di risposta (20% ORR) negli studi con venetoclax nei pazienti con AML R/R. Inoltre, il 70% dei rispondenti ha vissuto più di dodici mesi. La risposta al venetoclax è stata rapida e duratura, con poche recidive.
Come la LAM, anche la leucemia linfoblastica acuta (ALL) è molto eterogenea dal punto di vista molecolare (più di dieci sottogruppi diversi), motivo per cui la chemioterapia standard secondo l’approccio “one fits all” non può essere davvero utile. In futuro, ci sarà sicuramente più movimento nel trattamento di queste entità tumorali, ad esempio nella ricerca di TKI adatti e, soprattutto, di approcci di immunoterapia o di terapia con cellule CAR-T. Con blinatumomab (anti-CD19) e inotuzumab ozogamicin (anti-CD22), i primi farmaci approvati sono già sul mercato.
Dopo la sopravvivenza, viene la qualità della vita
In seguito all’introduzione dei TKI nel trattamento della leucemia mieloide cronica (CML), il tasso di sopravvivenza a 10 anni per questa malattia è ora dell’83%, per cui le probabilità di sopravvivenza con la CML sono circa le stesse della popolazione generale. Tuttavia, questo significa che per i pazienti con CML non è più solo una questione di sopravvivenza. Anche la sopravvivenza libera da progressione, il profilo degli effetti collaterali, la tossicità a lungo termine e soprattutto la qualità della vita giocano un ruolo importante per loro. Per gli oncologi, tuttavia, la possibilità di ottenere una remissione senza terapia nei pazienti con CML con i farmaci è in primo piano, perché questo porta effettivamente a una migliore qualità di vita, a minori effetti collaterali e a una minore tossicità a lungo termine.
Attualmente esistono cinque farmaci originali in tutto il mondo, di cui l’imatinib, che è stato approvato anche in questo Paese, è certamente uno dei noti “punti forti” del moderno trattamento della CML. Ad esempio, l’imatinib ha mostrato una sopravvivenza a 5 anni nella CML superiore al 95%. Tuttavia, ulteriori aberrazioni citogenetiche (cromosomiche) possono ridurre il successo della terapia. Pertanto, oltre alla PCR, l’aspirazione del midollo osseo è ancora raccomandata per il rilevamento delle alterazioni nei pazienti con CML.
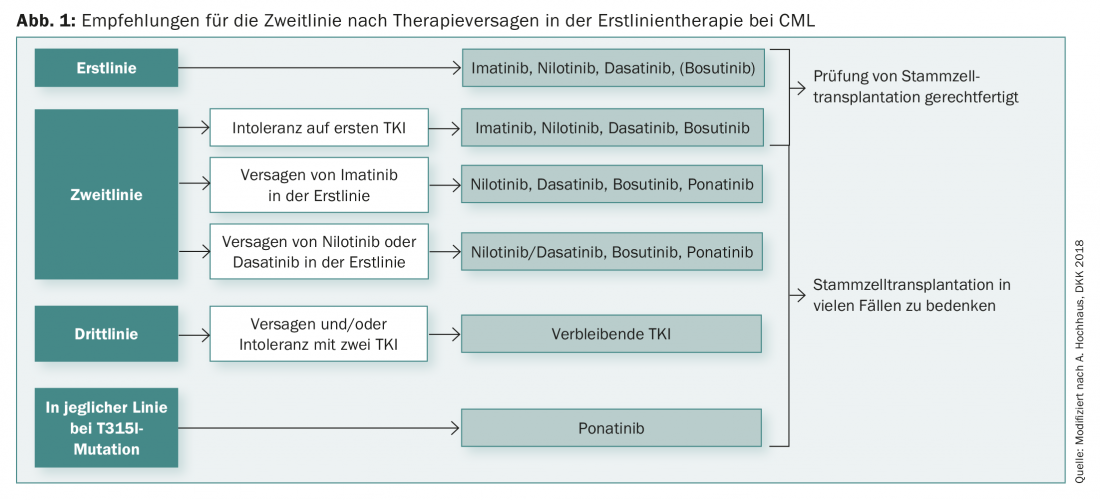
Tuttavia, la scelta della terapia di prima linea per la CML non dipende solo dalla genetica. Inoltre, gli obiettivi terapeutici individuali devono svolgere un ruolo importante, così come eventuali malattie concomitanti (comorbidità). Per molti pazienti, anche la questione della deducibilità della terapia è molto importante. Esistono anche delle raccomandazioni iniziali in merito che, secondo gli studi attuali, consentono di interrompere la terapia nei casi di remissione molecolare profonda superiore a 18 mesi, per ridurre, ad esempio, gli effetti collaterali.
La durata della remissione molecolare profonda (per almeno due anni) è poi un fattore decisivo per la prevenzione delle ricadute. Tuttavia, in molti casi, la terapia è possibile anche dopo una ricaduta e il paziente può raggiungere nuovamente la remissione con la terapia. Dopo il fallimento della terapia di prima linea, esiste oggi un’ampia gamma di opzioni di seconda linea per la CML (Fig. 1).
Fonte: 33° Congresso tedesco sul cancro, 21-24 febbraio 2018, Berlino
Letteratura:
- Stone RM, et al: N Engl J Med 2017; 377: 454-464.











