Nel trattamento delle lesioni cerebrali traumatiche gravi, c’è molta letteratura e poche prove. La stretta osservanza di un protocollo di trattamento porta a risultati migliori e il trattamento dovrebbe avvenire in centri specializzati. Le cause e i fattori scatenanti del danno secondario devono essere ricercati e trattati in modo aggressivo. Normocapnia, normoxaemia, normotensione, normoglicemia, normotermia e ICP normale. I CPP sono l’obiettivo. Il trattamento dell’intero organismo viene effettuato secondo la “buona pratica clinica in medicina intensiva”. Una prognosi affidabile e seria può essere fatta solo a lungo termine. Non è consigliabile prendere decisioni affrettate sulla base dei dati morfologici dell’immagine.
Il trattamento di terapia intensiva dopo una grave lesione cerebrale traumatica (SHT) è una sfida per l’intero team di trattamento. Sono coinvolti medici di terapia intensiva, infermieri di terapia intensiva, neurochirurghi, neurologi e altri specialisti dei settori della logopedia, della terapia occupazionale e della fisioterapia. Il trattamento interdisciplinare, in particolare, richiede uno stretto coordinamento e la gestione degli specialisti. In Svizzera, il trattamento della SHT grave negli adulti può quindi essere effettuato solo in centri dotati dell’infrastruttura necessaria e di personale specializzato. Nella maggior parte delle unità di terapia intensiva, i pazienti vengono trattati secondo un protocollo di trattamento rigoroso [1–5]. Sebbene manchino prove della superiorità di un protocollo di trattamento o di un altro [6], gli studi dimostrano che seguire e aderire a un protocollo è generalmente vantaggioso per il paziente [7].
In Svizzera, circa 715 persone soffrono di SHT grave all’anno [8]. La gravità della lesione viene solitamente determinata utilizzando la Glasgow Coma Scale (GCS) o l’Abbreviated Injury Score (AIS). La SHT grave è definita come GCS <9 o AIS “testa” quattro o cinque e ha una grande importanza socio-economica.
Il trattamento medico intensivo è una parte importante, ma non l’unica decisiva della catena di trattamento nella cura della SHT grave. I principi del trattamento di terapia intensiva vengono applicati anche nelle aree a monte, a partire dall’assistenza pre-ospedaliera di emergenza, passando per l’assistenza clinica di emergenza e la fase chirurgica, fino al ricovero nell’unità di terapia intensiva.
Il danno primario, che è causato da una forza diretta o indiretta che agisce sulla testa e sul cervello per un tempo molto breve (<0,2 msec), è chiamato danno primario. A seconda della causa dell’incidente (incidente ad alta velocità), dell’intensità e della direzione della forza (accelerazione o forze rotazionali), questo si manifesta con ferite da lacerazione-schiacciamento, fratture della cupola cranica (fig. 1 ) , emorragie extraassiali (fig. 2) e intracerebrali, contusioni del tessuto cerebrale, edema cerebrale perifocale o generalizzato e lesioni da taglio dei neuroni. Questo danno strutturale può essere rilevato dalla cCT o dalla cMRI e non può essere invertito da alcuna terapia. Dopo l’angio-TC d’emergenza iniziale nella shock room (a seconda della causa dell’incidente, del decorso degli eventi, ecc. deve essere effettuata anche una TC politrauma), si deve decidere in modo interdisciplinare se è necessario un intervento chirurgico o un approccio conservativo. ha senso.

Evitare i danni secondari
Il principio di base nel trattamento della SHT è la prevenzione del cosiddetto danno secondario, cioè il danno che si verifica dopo l’insulto iniziale. L’attenzione principale è rivolta all’apporto di ossigeno sufficiente al cervello. Pertanto, da un lato, si fa tutto il possibile per consentire un apporto sufficiente di ossigeno al cervello e, dall’altro, si riduce al minimo il consumo di ossigeno del cervello. Questo include una terapia aggressiva con volume e catecolamine, una ventilazione controllata con obiettivi stretti di paO2 e paCO2 e un’analgesia profonda (benzodiazepine, propofol e oppioidi) del paziente.
La pressione di perfusione cerebrale (CPP) è ancora utilizzata come marcatore di un’adeguata ossigenazione, a causa della mancanza di tecniche clinicamente fattibili. Si tratta della differenza di pressione tra la pressione arteriosa media (MAP) e la pressione intracerebrale (ICP) (CPP = MAP-ICP). Ciò richiede la misurazione invasiva dell’ICP [9]. Più comunemente, una sonda di pressione intracranica viene inserita nel parenchima cerebrale o nel sistema ventricolare. Questo permette di misurare la pressione intracranica in modo continuo. Una CPP >60 mmHg è attualmente considerata sufficiente nella maggior parte delle linee guida. Altre tecniche di esame che possono essere utilizzate nel corso del trattamento a seconda del problema sono l’elettrofisiologia (EEG, SSEP), gli esami Doppler transcranici e le misurazioni della perfusione.
Il monitoraggio cerebrale multimodale con misurazione locale del metabolismo del tessuto cerebrale, come la microdialisi cerebrale (lattato, piruvato, glutammato e glicerolo), la misurazione dell’O2 tissutale (ptO2) e la temperatura cerebrale, non è ancora riuscito a imporsi come standard. Attualmente mancano studi clinici che siano stati in grado di dimostrare un beneficio per il paziente quando si utilizza il monitoraggio multimodale, perché di solito vengono analizzati i cosiddetti marcatori surrogati.
Poiché il cervello è racchiuso dal cranio osseo e dalla dura madre, qualsiasi aumento di volume intracerebrale (edema cerebrale, emorragia, accumulo di liquor, dilatazione vascolare venosa o arteriosa), dopo l’esaurimento dei meccanismi di compensazione, porta a un aumento della ICP e quindi compromette la perfusione intracerebrale (dottrina Monro-Kellie). Pertanto, il controllo della ICP è un altro obiettivo terapeutico centrale, oltre alla CPP.
Gli aumenti di ICP possono essere intracerebrali (aumento di volume intracerebrale) o extracerebrali [10]. Le cause extracerebrali di aumento della ICP sono l’ipoventilazione/ipercarbia (dilatazione vascolare cerebrale con aumento della paCO2), l’iponatremia (aumento dell’edema cerebrale), i cali di pressione, l’ipossiemia, la febbre dovuta a infezioni extracerebrali e i disturbi della coagulazione. L’iper- o l’ipoglicemia causano un deficit energetico.
Qualsiasi disturbo della coagulazione deve essere generalmente trattato in modo aggressivo, perché i disturbi della coagulazione portano a emorragie secondarie nel tessuto cerebrale traumatizzato. A causa dell’immobilità dei pazienti con SHT grave, aumenta il rischio tromboembolico, che non viene trattato con farmaci nei primi giorni, ma solo con misure fisiche come le calze antitromboemboliche (ATS) e le calze gonfiabili sequenziali (“dispositivi di calza sequenziale”, SCD).
Il danno al sistema nervoso centrale porta alla neuroinfiammazione con formazione di edema cerebrale vasogenico o citotossico con aumento della pressione intracranica, necrosi e/o apoptosi delle cellule nervose. La somministrazione di steroidi ad alte dosi non è in grado di sopprimere questa neuroinfiammazione e porta addirittura a un peggioramento dell’esito neurologico [11,12]. L’interruzione degli steroidi è una delle pochissime raccomandazioni nel trattamento della SHT grave con evidenze di Grado I.
Se la terapia iniziale conservativa o post-neurochirurgica non stabilizza l’ICP, è necessario eseguire una diagnostica per immagini di emergenza per escludere un’emorragia post-operatoria, un edema cerebrale o una congestione del liquor (Fig. 3) . Insieme ai neurochirurghi, viene discussa un’opzione chirurgica come l’evacuazione dell’ematoma, l’emicraniectomia [13] e/o il drenaggio del liquido cerebrospinale. Se non è possibile un’opzione chirurgica, si procede a un’ulteriore escalation nel regime a stadi (analgesia più profonda, rilassamento muscolare, osmoterapia con mannitolo o soluzione salina ipertonica, ipotermia terapeutica e coma da barbiturici) [14].
Dopo la stabilizzazione, che spesso richiede diversi giorni, si può fare un tentativo di recupero sotto stretto controllo dell’ICP. Questa fase di veglia è caratterizzata da una massiccia reazione di stress dell’organismo, che deve essere soppressa di conseguenza con i farmaci.
Trattare l’intero organismo
Un altro principio fondamentale è stabilire l’omeostasi e trattare l’intero organismo, non solo l’SHT. Soprattutto in caso di lesioni multiple, i principi di trattamento specifici dell’organo possono competere tra loro, come nel caso di lesioni polmonari gravi con strategia di ventilazione protettiva in combinazione con SHT grave (nessuna ipoventilazione a causa della vasodilatazione e dell’aumento della ICP).
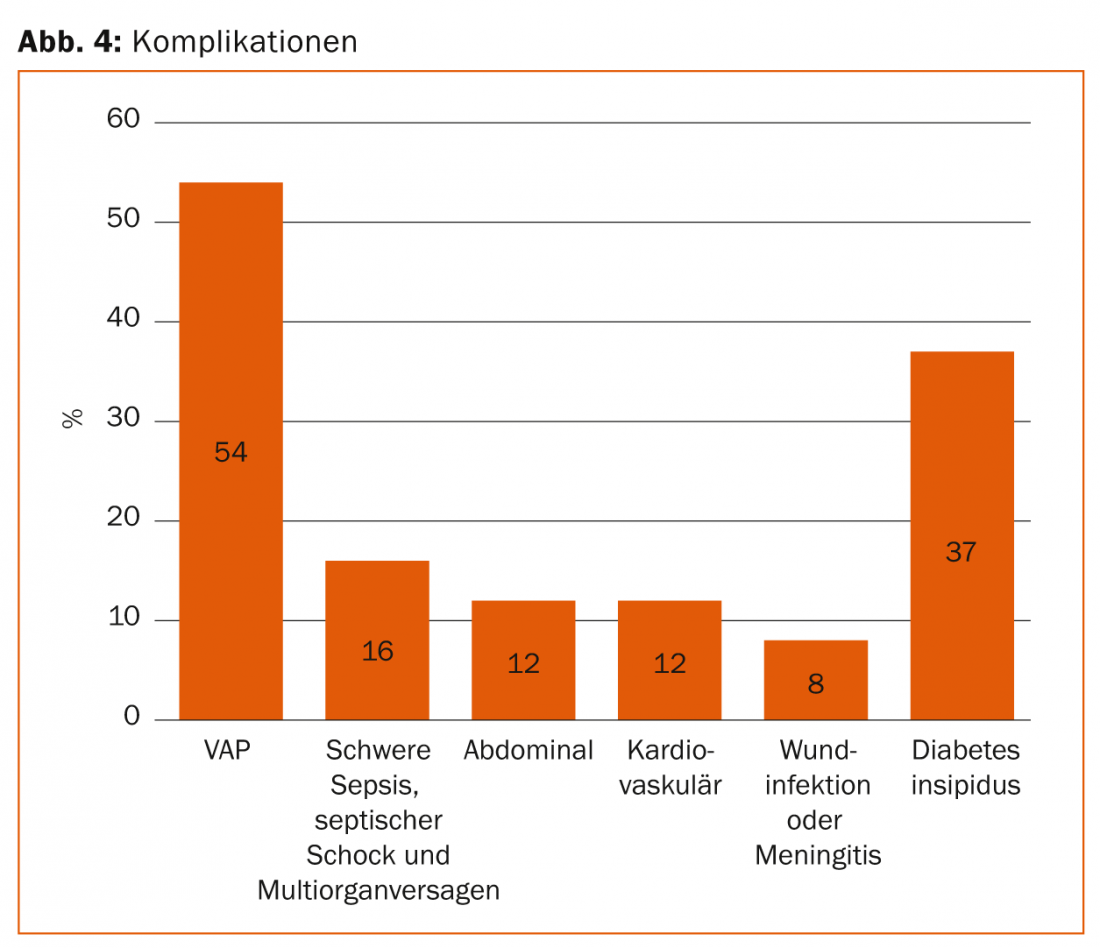
Una regolare terapia intensiva a lungo termine porta a complicazioni come polmonite associata al ventilatore (VAP), paralisi intestinale con accumulo nutrizionale problematico, traslocazione di batteri intestinali con successiva sepsi, grave catabolismo (rottura muscolare) e insufficienza multiorgano (Fig. 4).
Neuroriabilitazione e prognosi
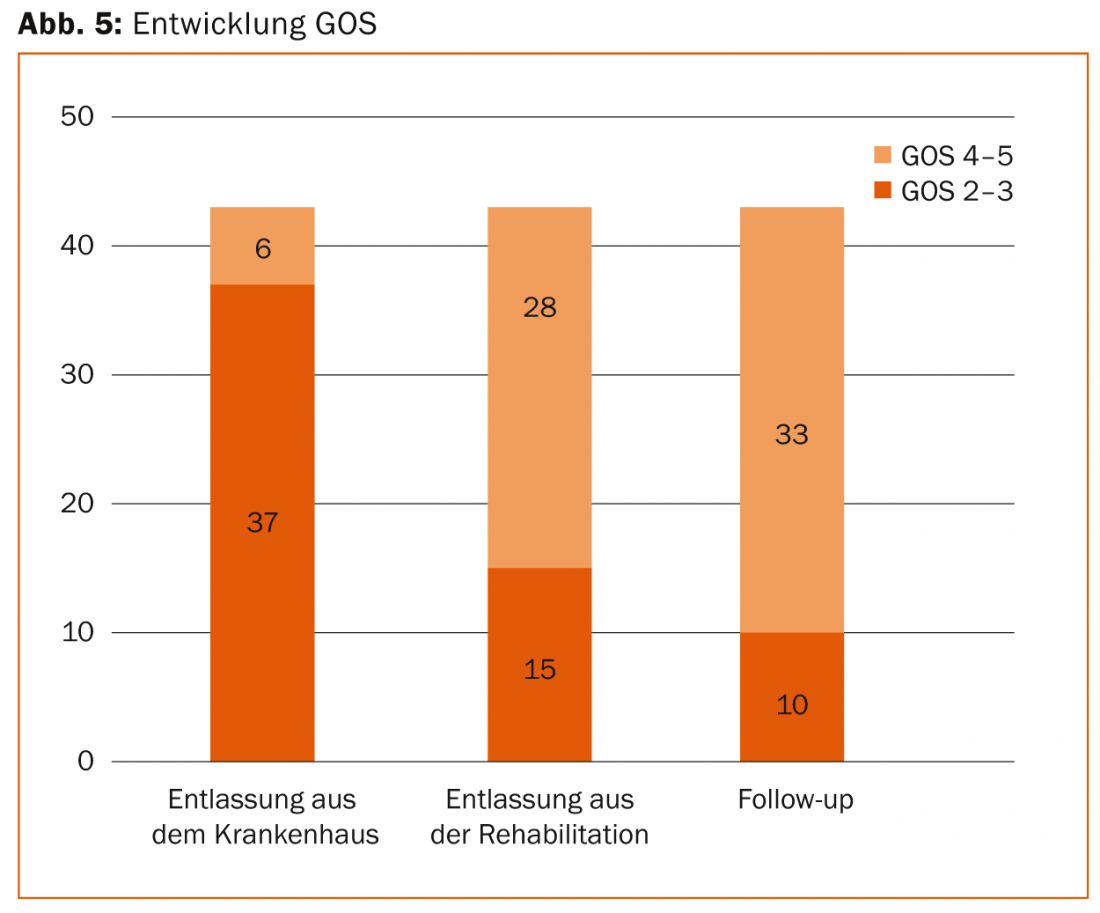
Ogni paziente con una SHT grave ha bisogno di diverse settimane o mesi di neuroriabilitazione dopo la fase di terapia intensiva. La neuroriabilitazione precoce, iniziata già durante la fase di recupero nel reparto di terapia intensiva e successivamente proseguita in cliniche speciali, può portare a un miglioramento significativo della neurologia in molti casi. Ad esempio, i nostri dati retrospettivi hanno mostrato che tre quarti dei pazienti con una grave SHT hanno lasciato l’unità di terapia intensiva con gravi deficit neurologici (GOS 2-3) per la neuroriabilitazione, per poter tornare in modo indipendente alla vita quotidiana mesi dopo dalla neuroriabilitazione in tre quarti dei casi in buone condizioni neurologiche (GOS 4-5). (Fig. 5).
Una prognosi neurologica affidabile può quindi essere fatta solo dopo diverse settimane, mesi o solo dopo un anno, se si sopravvive alla fase critica iniziale instabile. Questo perché la maggior parte dei pazienti con SHT grave muore nei primi giorni a causa di una ICP incontrollabile, che porta alla cessazione della perfusione cerebrale e quindi alla morte cerebrale. In queste situazioni, si pone la questione della donazione di organi, che deve essere discussa con i parenti – in conformità con la presunta volontà del paziente – perché i pazienti giovani raramente hanno un testamento biologico o una tessera di donatore di organi. Pertanto, il team di terapia intensiva si trova di fronte a una grande sfida nella scelta dell’intensità del trattamento. Gli anziani e le persone anziane soffrono più frequentemente di una SHT grave e, a causa delle riserve di organi limitate dall’età e della mancanza di potenziale riabilitativo, la questione dell’intensità del trattamento si pone in modo piuttosto esplicito. Soprattutto in questo tipo di lesioni, la massima “sopravvivere a tutti i costi” è un consiglio sbagliato. Le sequele neurologiche sono spesso così gravi che l’obiettivo della terapia medica intensiva deve essere modificato in base alla presunta volontà del paziente, portando alla terapia palliativa.
Nella maggior parte dei casi, i pazienti dopo una grave SHT presentano handicap cognitivi, motori, sensoriali, psicologici e quindi sociali di vario grado, che devono essere osservati e presi in considerazione da chi fornisce il trattamento di follow-up. Ogni paziente deve quindi ricevere un trattamento di follow-up individuale e incentrato sul paziente.
Link utili:
www.braintrauma.org
www.snacc.org
www.dgnc.de
www.pebita.ch
www.swissneurosurgery.ch
www.swissneuro.ch
www.awmf-online.de
Letteratura:
- The Brain Trauma Foundation: Associazione Americana dei Chirurghi Neurologici; Congresso dei Chirurghi Neurologici: Linee guida per la gestione delle lesioni cerebrali traumatiche gravi. J Neurotrauma 2007; 24(Suppl 1): S1-S106.
- Maas AI, et al: Linee guida EBIC per la gestione del trauma cranico grave negli adulti. Consorzio europeo per le lesioni cerebrali. Acta Neurochir (Vienna) 1997; 139(4): 286-294.
- Grände PO: Il ‘concetto Lund’ per il trattamento del trauma cranico grave – principi fisiologici e applicazione clinica. Intensive Care Med 2006; 32(10): 1475-1484.
- Welling KL, Eskesen V, Romner B, Comitato danese per il neurotrauma: Cura neurointensiva delle lesioni cerebrali traumatiche gravi. Ugeskr Laeger 2010; 172: 2091-2094.
- Menon DK: Protezione cerebrale nelle lesioni cerebrali gravi: determinanti fisiologiche dell’esito e loro ottimizzazione. Br Med Bull 1999; 55(1): 226-258.
- Sundstrøm T, et al.: Gestione delle lesioni cerebrali traumatiche gravi. Prove, trucchi e insidie. Springer 2012. ISBN 978-3-642-28125-9.
- Gerber LM, et al: Marcata riduzione della mortalità nei pazienti con gravi lesioni cerebrali traumatiche. J Neurosurg 2013; 119: 1583-1590.
- Walder B, et al.: Lesioni cerebrali traumatiche gravi in un Paese ad alto reddito: uno studio epidemiologico. Journal of Neurotrauma 2013; 30: 1934-1942.
- Chesnut RM, et al: Una sperimentazione del monitoraggio della pressione intracranica nelle lesioni cerebrali traumatiche. New England Journal of Medicine 2012; 367(26): 2471-2481.
- Maas AI, Stocchetti N, Bullock R: Lesioni cerebrali traumatiche moderate e gravi negli adulti. Lancet Neurol 2008; 7(8): 728-741.
- Collaboratori dello studio CRASH: Effetti dei corticosteroidi endovenosi sulla morte entro 14 giorni in 1008 adulti con trauma cranico clinicamente significativo (studio MRC CRASH): studio randomizzato controllato con placebo. Lancet 2004; 364: 1321-1328.
- Collaboratori dello studio CRASH: Risultati finali di MRC CRASH: studio randomizzato controllato con placebo di corticosteroidi per via endovenosa in adulti con trauma cranico – Risultati a 6 mesi. Lancet 2005; 365: 1957-1959.
- Cooper DJ, et al. per gli investigatori della sperimentazione DECRA e il gruppo di sperimentazione clinica della società australiana e neozelandese di terapia intensiva: Craniectomia decompressiva nella lesione cerebrale traumatica diffusa. New England Journal of Medicine 2011; 364(16): 1493-1502.
- Stubbe H, Wölfler J: Trauma craniocerebrale negli adulti. Medicina intensiva up2date 2012; 8: 253-269.
InFo NEUROLOGIA & PSICHIATRIA 2015; 13(2): 10-14











