La carenza di ferro nei pazienti cardio-renali non è una questione banale. L’insufficienza cardiaca cronica, ad esempio, non solo è una malattia comune, ma è anche spesso associata alla carenza di ferro. Questo a sua volta ha un impatto sulle previsioni. Questo perché i tassi di ospedalizzazione e di mortalità sono strettamente legati allo stato del ferro di questi pazienti. È indicata una sostituzione del ferro precoce e conforme alle linee guida.
L’insufficienza cardiaca (CHF) è principalmente una malattia dell’età avanzata e il motivo più comune di trattamento ospedaliero. Le limitazioni funzionali del cuore spesso vanno di pari passo con una ridotta funzionalità dei reni – e viceversa. Il motivo è la stretta connessione attraverso il sistema nervoso simpatico e il sistema renina-angiotensina-aldosterone. Quest’ultimo controlla, ad esempio, l’equilibrio dei fluidi e degli elettroliti del corpo e quindi influenza anche la pressione sanguigna. Il volume sanguigno arterioso effettivo, a sua volta, è rilevante per la perdita di potassio attraverso i reni. Sia l’insufficienza renale che quella cardiaca cronica sono strettamente associate alla carenza di ferro, che a sua volta è un fattore prognostico sfavorevole in termini di capacità di esercizio, ospedalizzazione e mortalità.
Fisiopatologia della carenza di ferro
La fisiopatologia della carenza di ferro nell’insufficienza cardiaca è probabilmente multifattoriale. Pertanto, è importante non trascurare altre cause, come le ulcere gastrointestinali o le malattie maligne. Ci possono essere fattori semplici, come la perdita di sangue dovuta alla terapia antiaggregante o anticoagulante, che portano alla perdita di ferro. Anche il malassorbimento può avere un ruolo. Inoltre, l’edema intestinale interstiziale può portare a una riduzione dell’assorbimento orale del ferro.
Lo stato infiammatorio cronico associato all’insufficienza cardiaca porta ad un aumento dei livelli di citochine pro-infiammatorie, come l’interleuchina-6 (IL-6). L’infiammazione induce la sintesi dell’epcidina, che riduce il rilascio del ferro immagazzinato. Mentre la maggior parte delle malattie infiammatorie croniche sono associate a livelli più elevati di epcidina, gli studi sui pazienti con HI hanno dimostrato che l’HI avanzata è associata a livelli più bassi di epcidina e non sembra essere correlata all’IL-6 in questo gruppo di pazienti. Questo può essere dovuto in parte all’aumento dei livelli di eritropoietina associati all’HI avanzata e alla soppressione dell’epicidina.
La carenza di ferro è ampiamente sottovalutata, anche se può essere rilevata in quasi un paziente su due. Tuttavia, il ferro è essenziale per la respirazione cellulare e le prestazioni fisiche. Inoltre, è stato dimostrato che la carenza di ferro influisce direttamente sulla funzione dei cardiomiociti umani, compromettendo la respirazione mitocondriale e riducendo la contrattilità e il rilassamento. Per questo motivo, dovrebbe sempre essere bilanciato in anticipo.
Sostituzione anticipata
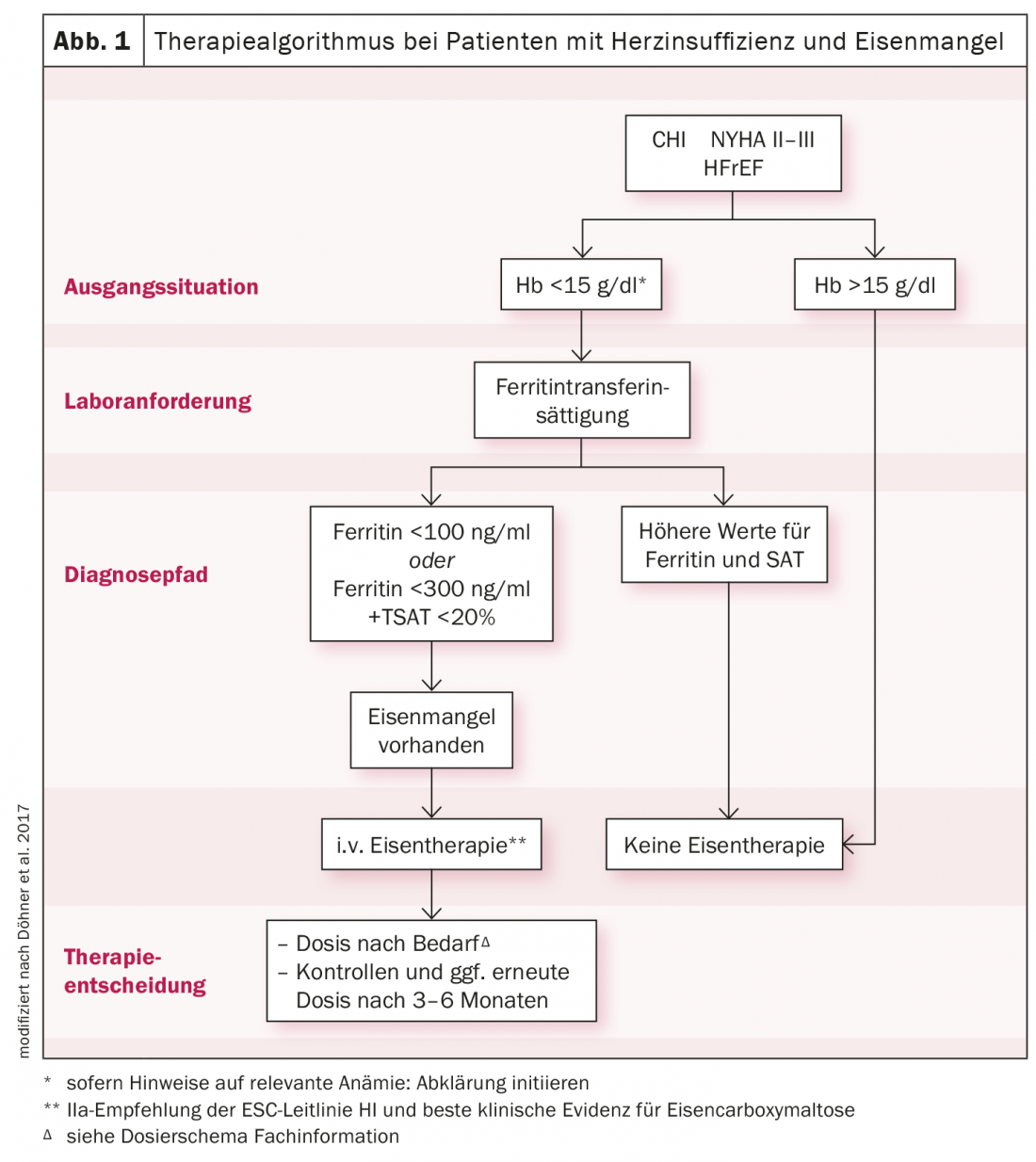
Per la diagnostica di base, è necessario effettuare un emocromo con ferritina, saturazione della transferrina (TSAT), CRP e velocità di filtrazione glomerulare. In un paziente con insufficienza cardiaca, i livelli di ferritina sierica <100 μg/l, o i livelli tra 100-300 μg/l e TSAT <20% indicano già una carenza di ferro che necessita di trattamento. Poiché la sostituzione del ferro per via orale deve essere somministrata per diversi mesi, viene assorbita solo in misura ridotta per via enterale e non ha alcuna influenza sulle prestazioni fisiche, si dovrebbe prendere in considerazione la somministrazione i.v. di ferro carbossimaltosio, secondo le linee guida ESC (Fig. 1). In questo modo, le riserve di ferro possono essere reintegrate in modo efficace, efficiente e controllato in un breve periodo di tempo. I sintomi migliorano e i tassi di ospedalizzazione e di mortalità si riducono. Un quadro simile si osserva nel paziente cardio-renale. Nello stadio III-IV, la carenza di ferro può essere diagnosticata fino al 70%. Uno studio ha dimostrato una ricostituzione significativamente più rapida delle riserve di ferro e un aumento maggiore dei livelli di TSAT con il carbossimaltosio ferrico rispetto al ferro orale.
Carbossimaltosio ferrico rapido efficace
Il carbossimaltosio ferrico ha un’elevata stabilità del complesso e può quindi essere applicato in dosi elevate (fino a 1000 mg/applicazione e settimana) e in tempi brevi (1000 mg in almeno 15 minuti con almeno 30 minuti di follow-up). Poiché il composto complesso è privo di destrano, non si legano gli anticorpi anti-destrano. Pertanto, non c’è un aumento del rischio di reazioni anafilattiche indotte dal destrano.
Ulteriori letture:
- Klip IT, et al: Am Heart J 2013; 165: 575-582.
- Ponikowski P, et al: Eur J Heart Fail 2016; 18: 891-975.
- Okonko DO, et al: J Am Coll Cardio 2011; 58: 1241-1251.
- Jankowska EA, et al: Eur Heart J 2013; 34: 816-826
- Hastka J, et al: Linee guida Carenza di ferro e anemia da carenza di ferro 2018.
- Hoes MF, et al: Eur J Heart Fail 2018; 20: 910-919.
- Cappellini MD, et al: Am J Hematol 2017; 92: 1068-1078.
- Lewis GD, et al: JAMA 2017; 317: 1958-1966.
- Laufs U, et al: DGK 2016; 1: 1-65.
- Anker SD, et al: Eur J Heart Fail 2018; 20: 125-133.
- Qunibi W, et al: Nephrol Dial Transplant 2011; 26: 1599-1607.
- Geisser P: Port J Nephrol Hyperert 2009; 23: 11-16.
- Neiser S, et al: Int J Mol Sci 2016; 17: 1185.
- Doehner W, et al.: Dtsch Med Wochenschr 2017; 142: 752-757.
- Ronco C, et al: J Am Coll Cardiol 2008; 52 (19): 1527-1539.
- Kovesdy CP: Rev Endocr Metab Discord 2017; 18 (1): 41-47.
- Dunn JD, et al: Am J Manag Care 2015; 21 (15 Suppl): s307-s315.
- Bushinsky DA, et al: Kidney Int 2015; 88 (6): 1427-1433.
CARDIOVASC 2021; 20(1): 18-19