In passato, una diagnosi di fibrosi cistica (FC) era sinonimo di morte precoce, di solito prima dei 30 anni. La malattia ereditaria accorcia ancora la vita, ma grazie ai progressi della ricerca e alle nuove terapie, l’aspettativa di vita media in Europa centrale è già aumentata a oltre 50 anni. Per le persone colpite in età adulta, esistono oggi diverse opzioni per gestire la fibrosi cistica.
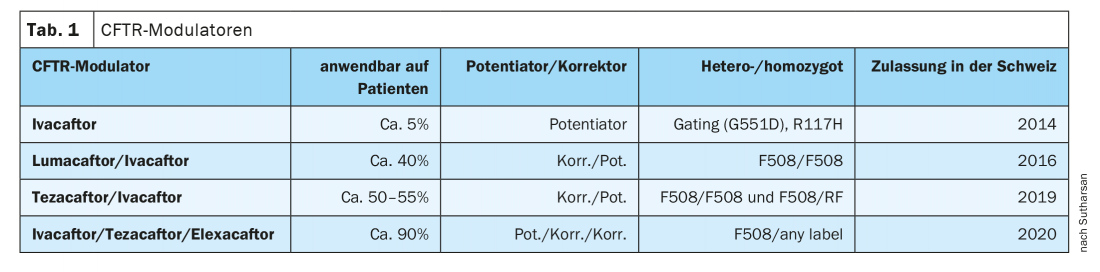
L’introduzione degli enzimi pancreatici ha rappresentato un importante progresso terapeutico, ma anche la creazione di centri in cui i pazienti affetti da FC ricevono un trattamento mirato ha contribuito ad aumentare le probabilità di sopravvivenza, ha detto il dottor Sivagurunathan Sutharsan, medico senior presso la Clinica di Pneumologia, Ruhrlandklinik, Medicina Universitaria di Essen (D), a titolo di introduzione. Nel 1989 è stato scoperto il gene CFTR. Sebbene non esista ancora una terapia genica, la medicina personalizzata è arrivata anche nella fibrosi cistica, afferma l’esperto: nel 2014, l’ivacaftor (IVA) è stato approvato in Svizzera come primo principio attivo per un piccolo gruppo di pazienti (5-6%); nel frattempo, ci sono altri tre modulatori che sono disponibili come combinazioni e, dall’agosto 2020, anche come tripli (Tab.1).
Complicazioni crescenti con l’età
Le prime complicazioni sono evidenti già nella prima infanzia: i bambini spesso (fino al 25%) presentano ileo da meconio come primo indicatore, di solito (>85%), l’insufficienza pancreatica è già presente e spesso si verificano infezioni polmonari (tuttavia, soltanto <25% Pseudomonas aeruginosa). Nel corso dell’infanzia e dell’adolescenza, la percentuale di P. aeruginosa aumenta fino a circa il 45%, ma entrano in gioco anche altri organi, tra cui le malattie del fegato e i polipi nasali (25%). In età adulta, compare infine la malattia vera e propria, che comprende gravi patologie polmonari e ossee (panoramica 1).
Durante il primo decennio di vita, Staphylococcus aureus e Haemophilus influenzae sono i batteri più comuni isolati dall’espettorato nella FC; nel secondo e terzo decennio di vita, Pseudomonas aerugiosa è molto più comune.

Le esacerbazioni aumentano il rischio
La gestione della fibrosi cistica è fondamentale per evitare le esacerbazioni. “I pazienti che hanno più di 2 esacerbazioni polmonari all’anno sono a maggior rischio di morte o di trapianto di polmone”, ha spiegato il dottor Sutharsan. Ridurre il numero di esacerbazioni e la conseguente perdita di funzionalità polmonare dovrebbe quindi essere uno degli obiettivi principali della gestione della FC.
Nella gestione, di solito viene prescritta la fisioterapia per far uscire le secrezioni dai polmoni, la terapia antibiotica è indicata per le infezioni croniche da Pseudomonas o Stafilococchi, e i macrolidi come l’azitromicina sono spesso utilizzati come terapia a lungo termine per la colonizzazione cronica da Pseudomonas. Se i pazienti sanguinano, si può scegliere di eseguire l’occlusione dell’arteria bronchiale. La terapia con i modulatori CFTR è nuova (panoramica 2).

Modulatori CFTR
Nella mutazione più comune, F508del, la proteina viene prodotta, ma di solito viene degradata nella cellula. Ma con i nuovi modulatori, i correttori CFTR elexacaftor (ELX) e tezacaftor (TEZ), il canale del cloruro viene stabilizzato in diversi siti di legame, impedendo così la degradazione. Questo è seguito da un trasporto diretto verso la superficie cellulare, dove il potenziatore CFTR ivacaftor può aumentare la probabilità di apertura del canale del cloruro. Attualmente esistono 4 modulatori CFTR approvati. Mentre l’ivacaftor può essere utilizzato in circa il 5% della popolazione FC, la nuova tripla combinazione di ivacaftor/tezacaftor/elexacaftor può trattare circa il 90% dei pazienti in tutto il mondo. Come prerequisito per il trattamento, è necessario avere almeno una mutazione 508 su un allele. “La seconda mutazione di solito non ha importanza”, dice il dottor Sutharsan. I principali effetti collaterali descritti sono l’eruzione cutanea e il prurito, che di solito sono ben controllati con antistaminici orali o steroidi. Tuttavia, viene descritto un buon effetto non solo sui polmoni, ma anche sui seni paranasali.
Nella sua clinica di Essen, il dottor Sutharsan e i suoi colleghi hanno adattato 133 pazienti affetti da FC alla nuova tripla ELX/TEZ/IVA (80 omozigoti, 32 + 21 (caso di difficoltà) eterozigoti). Nel gruppo omozigote, ci sono stati 96 ricoveri con terapia i.v. a causa di esacerbazioni nei 12 mesi precedenti. In 6 mesi sotto il triplo, questo numero si è ridotto a sole 5 terapie i.v. La situazione era simile negli eterozigoti: 29 + 74 (privazioni) trattamenti i.v. prima dell’inizio in un periodo di 12 mesi sono diventati solo 2 + 7 (privazioni) trattamenti i.v. nei primi 6 mesi con ELX/TEZ/IVA. L’ulteriore corso deve ancora essere visto, ma le cifre “mostrano già l’enorme progresso nella terapia che i nuovi modulatori portano con sé”, ha concluso il dottor Sutharsan.
Fonte: 128. Congresso della Società tedesca di medicina interna (DGIM)
InFo PNEUMOLOGIA & ALLERGOLOGIA 2022; 4(2): 30-31