Il seguente articolo intende fornire una panoramica dei sintomi non motori (NMS) più comuni nella PD, come vengono diagnosticati e trattati, soprattutto perché alcuni sono trattabili e il loro miglioramento ha un impatto significativo sulla qualità di vita dei pazienti. L’apatia può rispondere alla terapia dopaminergica. Nel caso della depressione, il trattamento deve essere principalmente con una terapia dopaminergica e poi preferibilmente con agonisti della dopamina con affinità per il recettore D3. La terapia per le psicosi e i disturbi del controllo degli impulsi prevede inizialmente la riduzione dei farmaci responsabili. La demenza può essere influenzata positivamente dalla terapia con gli inibitori della colinesterasi. Poiché la dopamina svolge un ruolo nel ciclo sonno-veglia, anche i disturbi del sonno possono rispondere alla terapia dopaminergica. L’ottimizzazione e l’uso di analgesici aiutano a gestire il dolore. La stimolazione cerebrale profonda può anche migliorare i sintomi non motori.
I sintomi non motori (NMS) si manifestano nel corso della malattia di Parkinson in quasi tutti i pazienti [1]. Si tratta di un ampio spettro di sintomi che spesso limitano la qualità della vita più dei sintomi motori e spesso non ricevono un’attenzione sufficiente da parte della persona colpita, di chi la assiste e dei medici [2, 3]. Di conseguenza, sono anche sottodiagnosticati e sottotrattati, e alcuni dei sintomi sono considerati un effetto avverso della terapia dopaminergica.
In generale, i sintomi non motori sono più comuni nella PD avanzata, ma alcuni, come l’iposmia, il disturbo del comportamento nel sonno REM, la stipsi e la depressione, possono precedere la PD motoria di diversi anni [4]. È ormai assodato che le NMS come la depressione o i disturbi del sonno, ma soprattutto il numero totale di NMS, riducono in modo significativo la qualità della vita nei pazienti con PD [3, 4]. La fisiopatologia è complessa e si può fare una distinzione tra sintomi dopaminergici e non dopaminergici; è probabile che siano coinvolte anche le connessioni serotoninergiche e noradrenergiche. Secondo il concetto di patologia a sei stadi ascendenti dei corpi di Lewy iniziato da Braak e collaboratori sulla base di autopsie [5], a partire dal bulbo olfattivo e dai nuclei inferiori del tronco encefalico, alcuni degli NMS sembrano essere spiegati come sintomi premotori (Fig. 1).

L’evidenza istologica della α-sinucleina nei nuclei parasimpatici sacrali, nei gangli simpatici e nel plesso nervoso enterico supporta anche l’ipotesi di una patologia ascendente, ma anche sistemica. La classica triade di sintomi motori può essere assegnata agli stadi tre e quattro con coinvolgimento della substantia nigra.
La Tabella 1 fornisce una panoramica dell’ampio spettro di NMS.

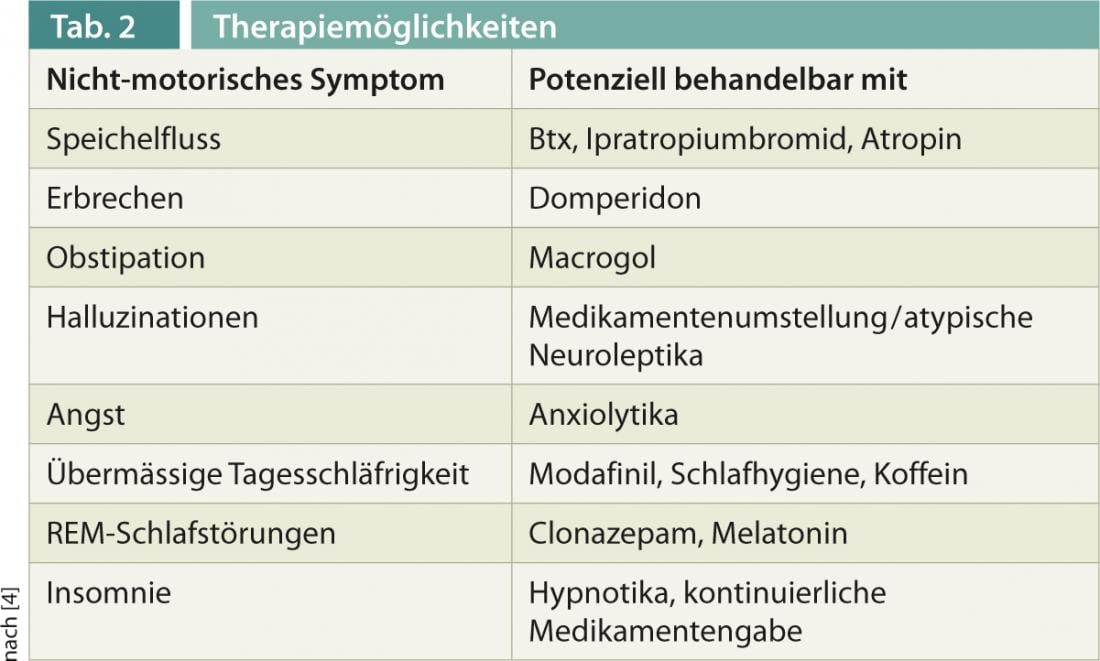
Per l’esplorazione e la documentazione della NMS, negli ultimi anni sono state create diverse scale, come la Scala dei Sintomi Non Motori (NMSS), o questionari per domande specifiche, come la Parkinson’s Disease Sleep Scale (PDSS-2). Per alcuni sintomi, esistono oggi terapie ben collaudate, che sono presentate di seguito e anche nella tabella 2 .
Apatia, depressione e psicosi
I sintomi neuropsichiatrici hanno un impatto significativo sulla qualità della vita, con i pazienti con PD non dominante da tremore a maggior rischio di declino cognitivo, depressione, apatia e allucinazioni [4].
L’apatia è un problema specifico della malattia di Parkinson e può rispondere alla terapia dopaminergica, in particolare alla somministrazione di agonisti della dopamina.
La depressione può precedere i sintomi motori e non esiste una correlazione tra la depressione e la gravità della sindrome di Parkinson motoria. Gli agonisti della dopamina con una chiara affinità per il recettore D3, in questo caso soprattutto il pramipexolo e il ropinirolo, sembrano essere superiori ad altri agonisti della dopamina in termini di effetto antidepressivo. Come passo successivo, possono essere utilizzati gli SSRI e gli SNRI, piuttosto più recenti, e vengono presi in considerazione anche gli antidepressivi più recenti, come la mirtazapina, la reboxetina e la venlafaxina, nonostante le prove ancora limitate [6].
La psicosi è una delle complicanze non motorie più invalidanti della malattia di Parkinson. Le allucinazioni visive possono precedere o accompagnare il deterioramento cognitivo e sono considerate un segnale di allarme per lo sviluppo della demenza nella PD [4]. La terapia, dopo aver escluso altri fattori scatenanti come infezioni o disturbi metabolici, consiste innanzitutto nel ridurre o interrompere i farmaci responsabili (nell’ordine: Anticolinergici, antidepressivi, amantadina, agonisti della dopamina, inibitori MAO-B e infine inibitori COMT e levodopa) e poi la somministrazione di neurolettici atipici come la clozapina o anche la quetiapina, per cui solo la clozapina è approvata per questa indicazione.
Demenza, controllo degli impulsi e Disturbi del sonno
La prevalenza della demenza nei pazienti con PD è del 30-40%. L’età è considerata il principale fattore di rischio per lo sviluppo della demenza, piuttosto che la durata della malattia. In primo luogo, occorre sospendere i farmaci che possono portare a un deterioramento cognitivo; in una seconda fase, si utilizzano gli inibitori della colinesterasi, i cui dati sono più convincenti per la rivastigmina, approvata per la demenza di Parkinson da lieve a moderata [4].
I disturbi del controllo degli impulsi, come il gioco d’azzardo patologico, l’alimentazione, lo shopping o persino l’ipersessualità, di solito non vengono segnalati, anche a causa della vergogna, e si verificano più frequentemente in associazione agli agonisti della dopamina, oltre che negli uomini. I medici curanti devono informarsi attivamente su questi sintomi, perché se i disturbi del controllo degli impulsi vengono trascurati, possono insorgere gravi problemi relazionali permanenti e anche difficoltà finanziarie. La terapia consiste nell’immediata riduzione o sospensione degli agonisti della dopamina, in particolare.
I disturbi del sonno possono presentarsi in molti modi (Tab. 1), sono un problema molto comune e spesso serio e possono avere varie cause. Poiché la dopamina svolge un ruolo nel ciclo sonno-veglia, alcuni disturbi del sonno nella PD possono rispondere a una terapia dopaminergica ottimizzata. Questo è stato dimostrato, ad esempio, per la rotigotina transdermica, che ha portato a un miglioramento significativo sia dei disturbi motori mattutini che dei disturbi del sonno, registrati con il PDSS-2 [7]. Quando si utilizzano gli agonisti della dopamina, bisogna prestare attenzione ai possibili effetti collaterali dell’aumento della sonnolenza diurna e degli attacchi improvvisi di addormentamento, che possono richiedere una riduzione della dose o addirittura l’interruzione [8]. Il disturbo comportamentale del sonno REM è caratterizzato dalla recitazione di sogni (spesso incubi) a causa della mancanza di atonia muscolare durante il sonno REM. La terapia farmacologica consiste nell’uso di clonazepam di notte [9]. Per il trattamento della sindrome delle gambe senza riposo, vengono utilizzati principalmente gli agonisti della dopamina, in alternativa, a seconda della gravità, il gabapentin o il pregabalin, nei casi più gravi anche gli oppioidi [10]. Una componente importante nel trattamento di tutti i disturbi del sonno rimane sempre il mantenimento di una buona igiene del sonno (orari regolari di sonno e di veglia, tempo adeguato a letto, cioè di solito non più di 8 ore). Si devono escludere altre cause trattabili di disturbi del sonno, come la sindrome di apnea ostruttiva del sonno.
Il dolore
Il dolore è un sintomo comune nei pazienti con PD e può avere molte cause diverse (muscoloscheletrico, secondario alla distonia, centrale, radicolare, neuropatico). L’adeguamento della terapia dopaminergica può portare a un miglioramento; in una fase successiva, si dovrebbe prendere in considerazione l’uso di analgesici, a seconda della causa.
Oltre alle fluttuazioni motorie, la stimolazione cerebrale profonda (THS) nel nucleo subtalamico migliora la gravità e le fluttuazioni dei sintomi non motori, come disturbi sensoriali, dolore, urgenza urinaria, disautonomia e disturbi del sonno. Anche i disturbi gastrointestinali sono alleviati, il che porta a un miglioramento complessivo notevole della qualità di vita un anno dopo la THS [11].
Importanza per le terapie neuroprotettive
Soprattutto per quanto riguarda le possibili terapie neuroprotettive in futuro, la diagnosi precoce che tiene conto della suddetta NMS potrebbe essere clinicamente molto rilevante [10]. L’attenzione, la ricerca e la terapia della NMS nella malattia di Parkinson diventeranno sempre più rilevanti.
Stephan Nitschke, MD
Prof. Dr. med. Barbara Tettenborn
Stefan Hägele-Link, MD
Letteratura:
- Barone P, et al: Lo studio PRIAMO: una valutazione multicentrica dei sintomi non motori e del loro impatto sulla qualità di vita nella malattia di Parkinson. Mov Disord 2009; 24(11): 1641-1649.
- Chaudhuri KR, et al: La mancata dichiarazione dei sintomi non motori della malattia di Parkinson agli operatori sanitari: uno studio internazionale che utilizza il questionario dei sintomi non motori. Mov Disord 2010; 25 (6): 704-709.
- Chaudhuri KR, et al: La malattia di Parkinson: i problemi non motori. Parkinsonism Relat Disord 2011 dic; 17(10): 717-723.
- Chaudhuri KR, et al: Manuale dei sintomi non motori nella malattia di Parkinson. Springer 2011.
- Braak H, et al: Stadiazione della patologia cerebrale legata alla malattia di Parkinson sporadica. Neurobiol Aging 2003; 24 (2): 197-211.
- Linee guida DGN, settembre 2012.
- Trenkwalder C, et al.: Effetti della rotigotina sulla funzione motoria mattutina e sul sonno nella malattia di Parkinson: uno studio in doppio cieco, randomizzato e controllato con placebo (RECOVER). Mov Disord 2011, 26(1): 90-99.
- Maass A, et al: Sonno e sintomi non motori nella malattia di Parkinson. J Neural Transm 2013 Apr; 120(4): 565-569.
- Aurora RN, et al: Guida alle migliori prassi per il trattamento del disturbo comportamentale del sonno REM (RBD). J Clin Sleep Med 2010; 6(1): 85-95.
- Garcia-Borreguero D, et al.: Linee guida europee sulla gestione della sindrome delle gambe senza riposo: rapporto di una task force congiunta della Federazione Europea delle Società Neurologiche, della Società Europea di Neurologia e della Società Europea di Ricerca sul Sonno. Eur J Neurol 2012; 19(11): 1385-1396.
- Steigerwald F, Volkmann J: Stimolazione cerebrale profonda (THS) nella malattia di Parkinson: verificare l’indicazione per la THS già alle prime fluttuazioni di effetto. InFoNeurologia&Psichiatria 2013; 15(5): 38-45.











